14.1: Вода - деякі унікальні властивості
- Page ID
- 20649
Опишіть різні властивості води, оскільки вона пов'язана з її полярністю та здатністю утворювати водневі зв'язки.
Придивившись ближче: вода, найважливіша рідина
Земля - єдине відоме тіло в нашій Сонячній системі, яке має рідку воду, вільно існуючу на її поверхні. Це добре, тому що життя на Землі було б неможливим без присутності рідкої води. Вода являє собою просту молекулу, що складається з одного атома кисню, зв'язаного з двома різними атомами водню (рис.\(\PageIndex{1}\)). Через більш високу електронегативності атома кисню зв'язки є полярними ковалентними (полярними зв'язками). Атом кисню притягує спільні електрони ковалентних зв'язків в значно більшій мірі, ніж атоми водню. В результаті атому кисню потрібен частковий негативний заряд\(\left( \delta - \right)\), тоді як атоми водню кожен набувають частковий позитивний заряд\(\left( \delta + \right)\). Молекула приймає зігнуту структуру через двох одиноких пар електронів на атомі кисню. Кут\(\ce{H-O-H}\) зв'язку приблизно\(105^\text{o}\), трохи менше ідеалу\(sp^3\) гібридизованої\(109.5^\text{o}\) атомної орбіталі.Вигнута форма молекули води є критичною, оскільки полярні\(\ce{O-H}\) зв'язки не скасовують один одного, а молекула в цілому є полярною.
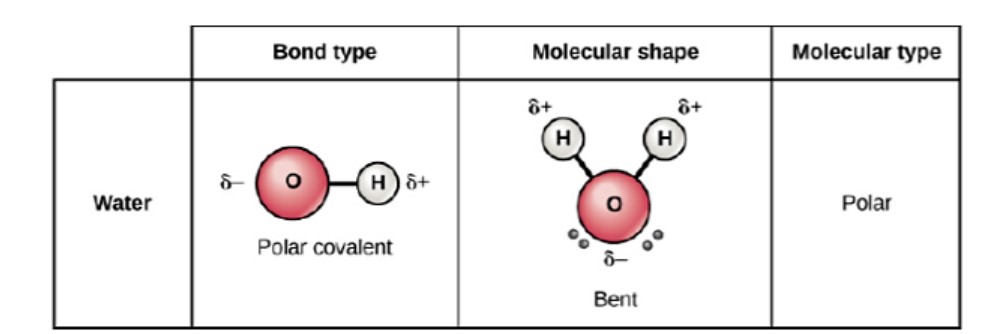
водневі зв'язки
Завдяки полярності води кожна молекула води притягує інші молекули води, оскільки протилежно заряджені кінці молекул притягують один одного. Коли це відбувається, відбувається слабка взаємодія між позитивним водневим кінцем з однієї молекули і негативним кисневим кінцем іншої молекули. Така взаємодія називається водневим зв'язком. Цей водневий зв'язок сприяє наступним унікальним властивостям води.
1. Вода - універсальний розчинник
2. Існує в природі як тверда речовина, рідина, так і газ
3. Щільність льоду менше рідкої води
4. Вода має високу теплоємність
5. Вода має високу теплоту випаровування
6. Вода існує як рідина при кімнатній температурі Важливо зазначити, що навіть ми зосереджуємось лише на воді в цьому підручнику, водневе зв'язування відбувається і в інших речовині, які мають полярні молекули.
Щільність води
Рідка вода - це рідина. Водневі зв'язки в рідкій воді постійно розриваються і реформуються, коли молекули води провалюються одна за одною. Коли вода охолоджується, її молекулярний рух сповільнюється, і молекули поступово рухаються ближче один до одного. Щільність будь-якої рідини збільшується в міру зниження її температури. Для більшості рідин це триває, оскільки рідина замерзає, а твердий стан щільніше, ніж рідкий. Однак вода поводиться інакше (табл.\(\PageIndex{1}\)). Він фактично досягає своєї найвищої щільності приблизно на рівні\(4^\text{o} \text{C}\).
| Температура\(\left( ^\text{o} \text{C} \right)\) | Щільність\(\left( \text{g/cm}^3 \right)\) |
|---|---|
| \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">100 (рідина) | \ (\ left (\ text {г/см} ^3\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.9584 |
| \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">50 | \ (\ left (\ text {г/см} ^3\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.9881 |
| \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">25 | \ (\ left (\ text {г/см} ^3\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.9971 |
| \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">10 | \ (\ left (\ text {г/см} ^3\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.9997 |
| \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">4 | \ (\ left (\ text {г/см} ^3\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» клас = "lt-chem-152224">1.0000 |
| \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0 (рідина) | \ (\ left (\ text {г/см} ^3\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.9998 |
| \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0 (твердий) | \ (\ left (\ text {г/см} ^3\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.9168 |
Між\(4^\text{o} \text{C}\) і щільність поступово зменшується\(0^\text{o} \text{C}\), оскільки водневі зв'язки починають утворювати мережу, що характеризується загалом гексагональної структурою з відкритими просторами посередині шестикутників (рис.\(\PageIndex{2}\)).
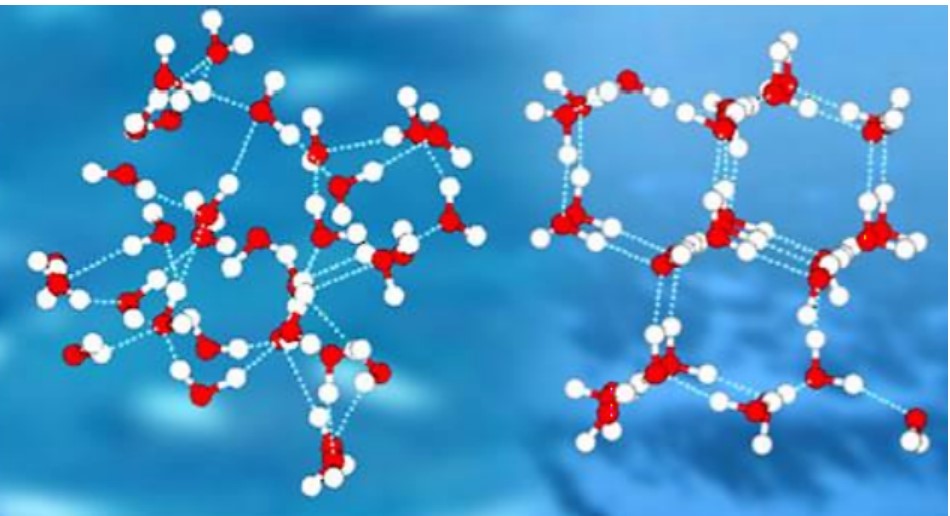
Лід менш щільний, ніж рідка вода і тому плаває. Ставки або озера починають промерзати біля поверхні, ближче до холодного повітря. Шар льоду утворюється, але не тоне, як би вода не мала цієї унікальної структури, продиктованої її формою, полярністю та водневим зв'язком. Якби лід потонув у міру замерзання, цілі озера замерзли б твердими. Оскільки лід не тоне, рідка вода залишається під льодом всю зиму. Це важливо, так як риби та інші організми здатні вижити до зими. Лід - одна з дуже небагатьох твердих речовин, яка менш щільна, ніж його рідка форма.
Розчинна здатність води
Вода зазвичай розчиняє багато іонних сполук і полярних молекул. Неполярні молекули, такі як ті, що містяться в жирі або олії, не розчиняються у воді. Спочатку ми розглянемо процес, який відбувається, коли іонна сполука, така як кухонна сіль (хлорид натрію), розчиняється у воді.
Воду приваблює кристал хлориду натрію, оскільки вода полярна і має як позитивний, так і негативний кінець. Позитивно заряджені іони натрію в кристалі притягують кисневий кінець молекул води, оскільки вони частково негативні. Негативно заряджені іони хлориду в кристалі притягують водневий кінець молекул води, оскільки вони частково позитивні. Дія полярних молекул води розбирає кристалічну решітку (див. Рис.\(\PageIndex{3}\)).

Після виходу з кристала окремі іони потім оточені частинками розчинника в процесі, який називається сольвацією. Зверніть увагу, що окремі\(\ce{Na^+}\) іони оточені молекулами води з атомом кисню, орієнтованим поблизу позитивного іона. Так само іони хлориду оточені молекулами води з протилежною орієнтацією. Гідратація - це процес розчинених частинок, оточених молекулами води, розташованими певним чином. Гідратація допомагає стабілізувати водні розчини, запобігаючи поверненню позитивних і негативних іонів і утворюючи осад.
Столовий цукор є сахарозою\(\left( \ce{C_{12}H_{22}O_{11}} \right)\) і є прикладом молекулярної сполуки. Твердий цукор складається з окремих молекул цукру, скріплених між собою міжмолекулярними силами притягання. Коли вода розчиняє цукор, він відокремлює окремі молекули цукру, порушуючи сили притягання, але не розриває ковалентні зв'язки між атомами вуглецю, водню та кисню. Розчинені молекули цукру також гідратовані, але без такої чіткої орієнтації на молекули води, як у випадку з іонами. Молекули цукру містять багато\(\ce{-OH}\) груп, які можуть утворювати водневі зв'язки з молекулами води, допомагаючи формувати розчин сахарози.
Амфотерна природа води
Вода амфотерна: вона має здатність діяти або як кислота, або основа в хімічних реакціях. Згідно з визначенням Бронстеда-Лоурі, кислота є донором протона (H +), а основа - акцептор протона. При взаємодії з більш сильною кислотою вода виступає в якості основи; при взаємодії з більш сильною основою вона діє як кислота. Наприклад, вода отримує іон Н + з HCl, коли утворюється соляна кислота:
- HCl (кислота) + H 2 O (основа) H 3 O + Cl −
У реакції з аміаком, NH 3, вода дарує іон Н +, і, таким чином, діє як кислота:
- NH 3 (основа) + H 2 O (кислота) NH + 4 + ОН −
Висока теплоємність і питома теплоємність води
Різні речовини реагують на тепло по-різному. Якщо металевий стілець сидить на яскравому сонці в спекотний день, він може стати досить гарячим на дотик. Рівна маса води на одному сонці не стане майже такою ж гарячою. Таблиця\(\PageIndex{2}\) переліку питомих нагрівань різних речовин в порівнянні з водою. Вода має найвищу питому теплоємність будь-якої рідини. Висока теплоємність води - це властивість, спричинена зв'язком водню між молекулами води. Питома теплота визначається як кількість тепла, який один грам речовини повинен поглинати або втратити, щоб змінити свою температуру на один градус Цельсія. Для води ця кількість становить 1 кал/г o С. Одиниці для питомої теплоти можуть бути або в одиницях СІ джоулів на грам на градус\(\left( \text{J/g}^\text{o} \text{C} \right)\) або калорій на грам на градус\(\left( \text{cal/g}^\text{o} \text{C} \right)\). Цей текст буде використовуватися\(\text{J/g}^\text{o} \text{C}\) для питомої теплоти.

Воді потрібно довго нагріватися і довго охолоджуватися. Насправді питома теплоємність води приблизно в п'ять разів більше, ніж у піску. Це пояснює, чому земля остигає швидше, ніж море. Прибережний клімат набагато помірніший, ніж внутрішній клімат через наявність океану. Вода в озерах або океанах поглинає тепло з повітря в спекотні дні і випускає його назад в повітря в прохолодні дні. Вода використовується в якості теплоносія для машин, оскільки вона здатна поглинати велику кількість тепла (рис.\(\PageIndex{4}\)). Завдяки високій теплоємності теплокровні тварини використовують воду для більш рівномірного розсіювання тепла і підтримки температури в своїх тілах: вона діє аналогічно системі охолодження автомобіля, транспортуючи тепло з теплих місць в прохолодні місця, змушуючи організм підтримувати більш рівномірну температуру.
| Речовина | Питома теплоємність\(\left( \text{J/g}^\text{o} \text{C} \right)\) |
|---|---|
| Вода (л) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">4.18 |
| Вода (и) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">2.06 |
| Вода (г) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">1.87 |
| Аміак (г) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">2.09 |
| Етанол (л) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">2.44 |
| Алюміній (и) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.897 |
| Вуглець, графіт (и) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.709 |
| Мідь (и) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.385 |
| Золото (и) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224"> 0.129 |
| Залізо (и) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.449 |
| Свинець (и) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224"> 0.129 |
| Ртуть (л) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» class="lt-chem-152224">0.140 |
| Срібло (и) | \ (\ left (\ text {J/g} ^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр;» клас = "lt-chem-152224">0.233 |
Висока теплота випаровування води
Вода в рідкому вигляді має незвично високу температуру кипіння, значення, близьке до 100° C В результаті мережі водневого зв'язку, присутньої між молекулами води, для перетворення одного грама рідкої води в водяну пару, потрібна висока витрата енергії, яка називається теплота пароутворення. Вода має значення теплоти пароутворення 40,65 кДж/моль. Для здійснення цієї зміни води потрібна значна кількість теплової енергії (586 калорій). Цей процес відбувається на поверхні води. У міру нагрівання рідкої води водневий зв'язок ускладнює відокремлення молекул води один від одного, що потрібно для того, щоб вона увійшла в свою газоподібну фазу (пар). Як результат, вода діє як радіатор або тепловий резервуар, і для кипіння потрібно набагато більше тепла, ніж рідина, така як етанол (зерновий спирт), водневий зв'язок з іншими молекулами етанолу слабкіший, ніж водневий зв'язок води.
Той факт, що водневі зв'язки потрібно розірвати, щоб вода випарувалася, означає, що в процесі використовується значна кількість енергії. У міру випаровування води енергія забирається процесом, охолоджуючи середовище, де відбувається випаровування. У багатьох живих організмах, включаючи людину, випаровування поту, що становить 90 відсотків води, дозволяє організму охолодитися, щоб можна було підтримувати гомеостаз температури тіла.
Резюме
- Полярність води і її здатність до водневого зв'язку сприяють її унікальним властивостям.
- Іонні молекули розчинених речовин гідратовані (оточені молекулами розчинника в певній орієнтації).
- Лід менш щільний, ніж рідка вода, через простори в міжмолекулярній структурі льоду, відсутні у воді.
- Теплоємність - це кількість тепла, необхідне для підвищення температури об'єкта\(1^\text{o} \text{C}\) (на).
- Питома теплоємність речовини - це кількість енергії, необхідної для підвищення температури 1 грама речовини на\(1^\text{o} \text{C}\).
- Дисоціація рідких молекул води, яка змінює речовину на газ, вимагає великої кількості енергії.
Дописувачі та атрибуція
- Template:ContribCK12
- Boundless: The Chemical Foundation of Life
- Libretext: Introduction to Environmental Science (Zendher et al.)
- TextMap: Introductory Chemistry (Tro)
- Template:ContribAgnewM