9.5: Інші аспекти ковалентних зв'язків
- Page ID
- 22568
- Опишіть неполярний зв'язок і полярний зв'язок.
- Використовуйте електронегативність, щоб визначити, чи буде зв'язок між двома елементами неполярним ковалентним, полярним ковалентним або іонним.
- Опишіть енергію зв'язку ковалентного зв'язку.
Розглянемо молекулу Н 2:
\[\mathbf{H}\: \mathbf{: H}\nonumber \]
Оскільки ядра кожного атома Н містять протони, електрони в зв'язку притягуються до ядер (протилежні заряди притягуються). Але оскільки два атоми, що беруть участь у ковалентному зв'язку, є обома атомами Н, кожне ядро притягує електрони на однакову кількість. Таким чином, електронна пара однаково ділиться двома атомами. Рівний розподіл електронів в ковалентному зв'язку називається неполярної ковалентної зв'язком.
Тепер розглянемо\(HF\) молекулу:

У ковалентному зв'язку беруть участь два різних атома. Атом Н має в своєму ядрі один протон, який притягує сполучну пару електронів. Однак атом F має дев'ять протонів у своєму ядрі, що в дев'ять разів перевищує тяжіння атома Н. Атом F притягує електрони настільки сильніше, що електрони залишаються ближче до атома F, ніж до атома Н; електрони вже не однаково збалансовані між двома ядрами. Замість того, щоб представляти молекулу ВЧ як

може бути доцільніше провести ковалентний зв'язок як
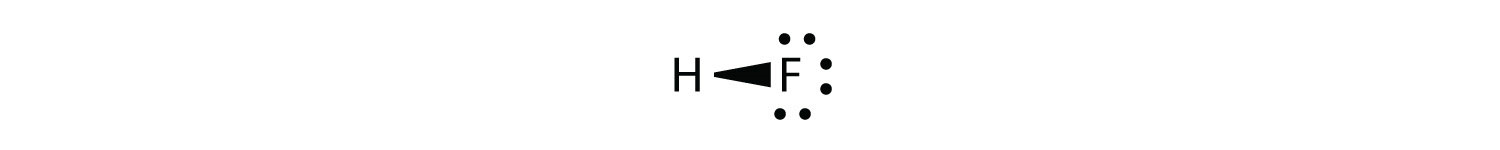
при цьому електрони в зв'язку знаходяться ближче до атома F, ніж атом Н. Оскільки електрони в зв'язку знаходяться ближче до атома F, ця сторона молекули приймає частковий негативний заряд, який представлений Δ− (δ - це мала грецька буква дельта). Інша сторона молекули, атом Н, приймає частковий позитивний заряд, який представлений Δ+:
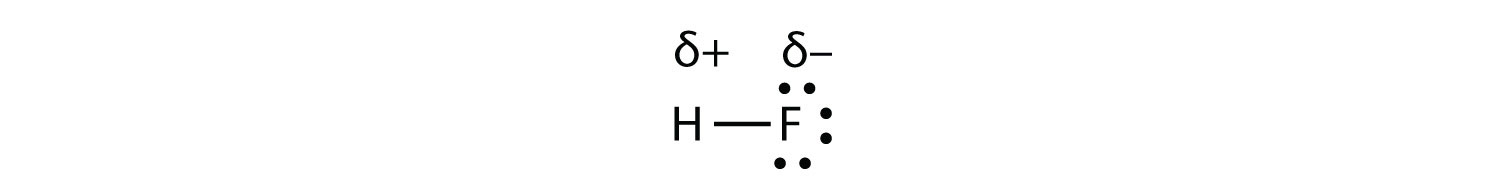
Ковалентний зв'язок між різними атомами, які притягують спільні електрони різними кількостями і викликають дисбаланс розподілу електронів, називається полярної ковалентної зв'язком.
Технічно будь-яка ковалентна зв'язок між двома різними елементами є полярною. Однак важлива ступінь полярності. Ковалентний зв'язок між двома різними елементами може бути настільки злегка неврівноваженим, що зв'язок, по суті, неполярний. Зв'язок може бути настільки полярним, що електрон фактично переходить від одного атома до іншого, утворюючи справжній іонний зв'язок. Як ми оцінюємо ступінь полярності? Вчені розробили шкалу під назвою електронегативність, шкалу для оцінки того, наскільки сильно атоми будь-якого елемента притягують електрони. Електронегативність - це безодиничне число; чим більше число, тим більше атом притягує електронів. Загальна шкала електронегативності показана на рис\(\PageIndex{1}\).
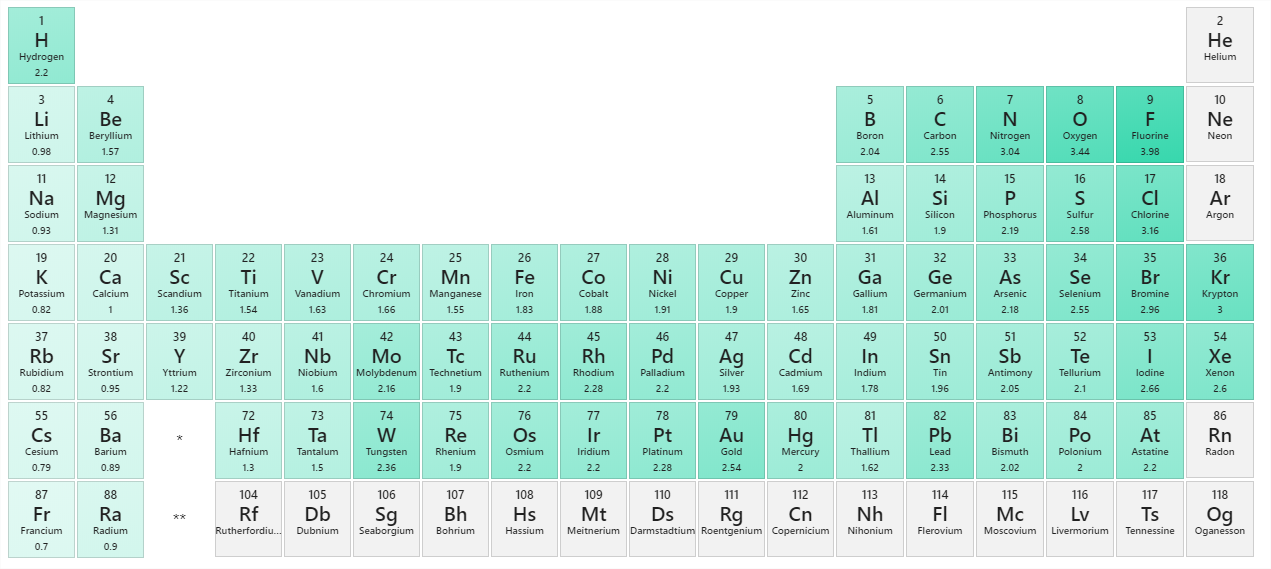
Про полярність ковалентного зв'язку можна судити, визначаючи різницю електронегативностей двох атомів, що беруть участь в ковалентному зв'язку, як це підсумовано в наступній таблиці:
| Різниця електронегативності | Тип облігації |
|---|---|
| 0 | неполярний ковалентний |
| 0-0,4 | злегка полярний ковалентний |
| 0,4—1,9 | виразно полярний ковалентний |
| >1.9 | ймовірно іонний |
Яка полярність кожного зв'язку?
- С—Ч
- О—Ч
Рішення
Використовуючи малюнок\(\PageIndex{1}\), ми можемо обчислити різницю електронегативності атомів, що беруть участь в зв'язку.
- Для зв'язку С—Н різниця в електронегативності становить 2,5 − 2,1 = 0,4. Таким чином, ми прогнозуємо, що цей зв'язок буде трохи полярним ковалентним.
- Для зв'язку O—H різниця в електронегативності становить 3,5 − 2,1 = 1,4, тому ми прогнозуємо, що цей зв'язок буде однозначно полярним ковалентним.
Яка полярність кожного зв'язку?
- Rb—F
- P—Cl
- Відповідь на
-
ймовірно іонний
- Відповідь б
-
полярний ковалентний
Полярність ковалентного зв'язку може мати істотний вплив на властивості речовини. Якщо загальна молекула полярна, речовина може мати більш високу температуру плавлення та температуру кипіння, ніж очікувалося; також вона може бути розчинною або не розчиняється в різних інших речовині, таких як вода або гексан.
Повинно бути очевидним, що ковалентні зв'язки стабільні, оскільки існують молекули. Однак вони можуть бути порушені, якщо в молекулу надходить достатня кількість енергії. Для більшості ковалентних зв'язків між будь-якими двома даними атомами повинна подаватися певна кількість енергії. Хоча точна кількість енергії залежить від молекули, приблизна кількість енергії, що подається, аналогічна, якщо атоми в зв'язку однакові. Приблизна кількість енергії, необхідної для розриву ковалентного зв'язку, називається енергією зв'язку ковалентного зв'язку. У таблиці\(\PageIndex{1}\) перераховані енергії зв'язку деяких ковалентних зв'язків.
| Бонд | Енергія (кДж/моль) | Бонд | Енергія (кДж/моль) | |
|---|---|---|---|---|
| C—C | 348 | Н—Н | 163 | |
| С = С | 611 | N = П | 418 | |
| C≡ C | 837 | N≡ N | 946 | |
| С—О | 351 | Н—Ч | 389 | |
| С=О | 799 | О—О | 146 | |
| С—Cl | 328 | О = О | 498 | |
| С—Ч | 414 | О—Ч | 463 | |
| F—F | 159 | —Ч | 339 | |
| H — Cl | 431 | С=О | 523 | |
| Ч—Ф | 569 | Сі—Н | 293 | |
| Ч—Ч | 436 | Сі—О | 368 |
Кілька тенденцій очевидні з табл\(\PageIndex{1}\). Для облігацій, які включають однакові два елементи, подвійний зв'язок міцніший за одиночний зв'язок, а потрійний зв'язок міцніше подвійного зв'язку. Енергії множинних зв'язків не є точними кратними енергії одного зв'язку; для вуглецево-вуглецевих зв'язків енергія збільшується дещо менше, ніж подвійна або потрійна енергія зв'язку C - C, тоді як для зв'язків азот і азот енергія зв'язку збільшується зі швидкістю більшою, ніж кратна енергії одиночного зв'язку N—N. Енергії зв'язку в таблиці\(\PageIndex{1}\) є середніми значеннями; точне значення енергії ковалентного зв'язку буде незначно відрізнятися серед молекул з цими зв'язками, але повинно бути близьким до цих значень.
Щоб бути розірваними, ковалентні зв'язки завжди вимагають енергії; тобто розрив ковалентних зв'язків - це завжди ендотермічний процес. Таким чином, Δ H для цього процесу є позитивним:
Молекула—O—H → Молекула—O+ H
з Δ Н ≈ +463 кДж/моль
Однак при створенні ковалентного зв'язку енергія завжди виділяється; виготовлення ковалентних зв'язків - це завжди екзотермічний процес. При цьому Δ Н для цього процесу негативний:
Молекула — S + H → Молекула — —Н
з Δ Н ≈ −339 кДж/моль
Енергії зв'язку можуть бути використані для оцінки зміни енергії хімічної реакції. Коли зв'язки розриваються в реагентах, зміна енергії для цього процесу є ендотермічним. Коли в продуктах утворюються зв'язки, зміна енергії для цього процесу носить екзотермічний характер. Ми поєднуємо позитивну енергетичну зміну з негативною зміною енергії, щоб оцінити загальну енергетичну зміну реакції. Наприклад, в
2Н 2 + О 2 → 2Н 2 О
ми можемо намалювати електронні точкові діаграми Льюїса для кожної речовини, щоб побачити, які зв'язки розриваються і які зв'язки утворюються:
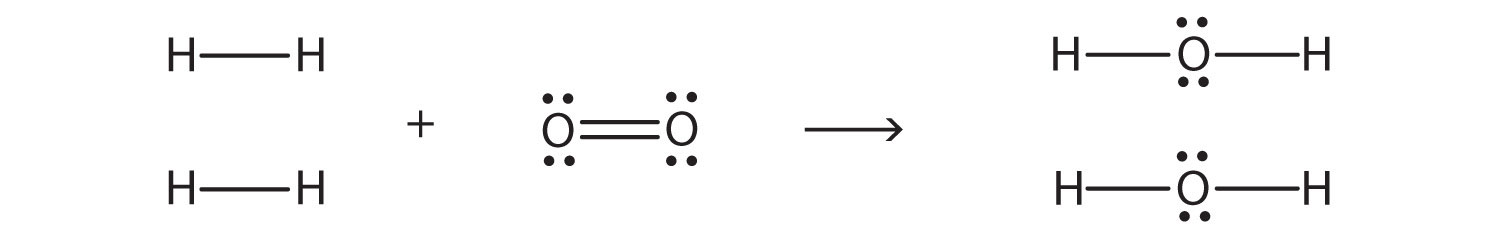
(Самотні електронні пари на атомах O опущені для наочності.) Ми розриваємо дві H—H зв'язки та один подвійний зв'язок O—O та утворюємо чотири одинарні зв'язки O—H. Енергія, необхідна для розриву зв'язків, наступна:
| 2 Н—Н облігації: | 2 (+436 кДж/моль) |
|---|---|
| 1 O = O облігація: | +498 кДж/моль |
| Всього: | +1,370 кДж/моль |
Енергія, що виділяється при виготовленні чотирьох зв'язків O—H, виглядає наступним чином:
| 4 облігації O—H: | 4 (−463 кДж/моль) |
|---|---|
| Всього: | −1,852 кДж/моль |
Об'єднання цих двох чисел:
| +1,370 кДж/моль + (−1,852 кДж/моль) | |
|---|---|
| Чиста зміна: | −482 кДж/моль ≈ Δ Н |
Фактичне Δ H становить −572 кДж/моль; ми вимкнені приблизно на 16%. Хоча це не ідеально, різниця в 16% є розумною, оскільки ми використовували оціночні, а не точні енергії зв'язку.
Оцініть енергетичну зміну цієї реакції.
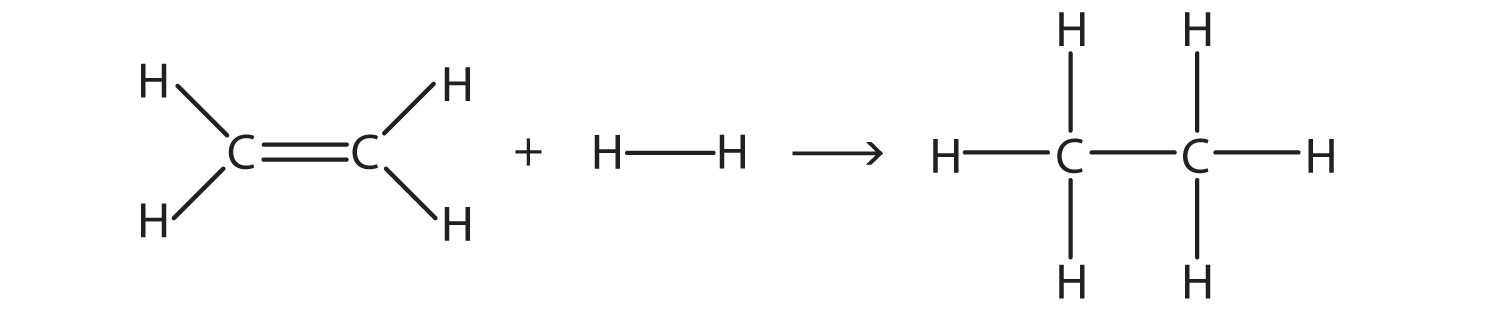
Рішення
Тут ми розриваємо подвійний зв'язок C - C та одинарний зв'язок H—H та робимо одинарний зв'язок C — C та дві одинарні зв'язки C — H. Розрив зв'язків є ендотермічним, тоді як виготовлення облігацій є екзотермічним. Для розриву облігацій:
| 1 С=С: | +611 кДж/моль |
|---|---|
| 1 ГОД-ГОД: | +436 кДж/моль |
| Всього: | +1,047 кДж/моль |
Для виготовлення облігацій:
| 1 С—С: | −348 кДж/моль |
|---|---|
| 2 С—Ч: | 2 (−414 кДж/моль) |
| Всього | −1,176 кДж/моль |
Загалом, зміна енергії становить +1,047 + (−1,176) = −129 кДж/моль.
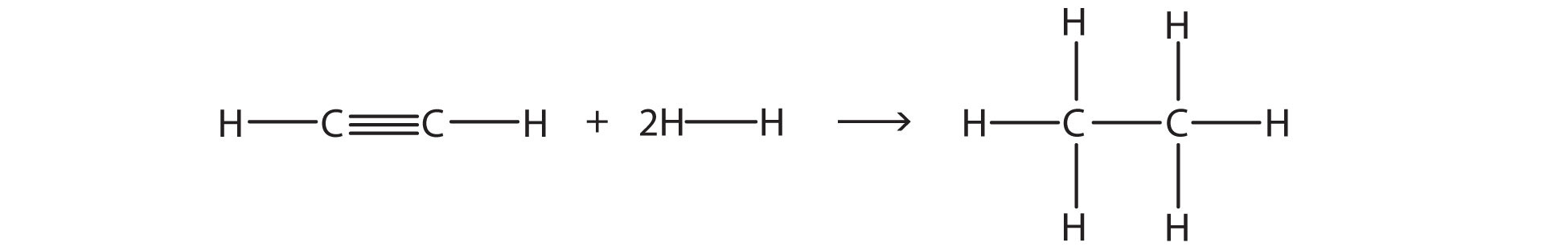
Оцініть енергетичну зміну цієї реакції.
Резюме
- Ковалентні зв'язки можуть бути неполярними або полярними, в залежності від електронегативності задіяних атомів.
- Ковалентні зв'язки можуть бути розірвані, якщо до молекули додати енергію.
- Освіта ковалентних зв'язків супроводжується виділеною енергією.
- Енергії ковалентного зв'язку можуть бути використані для оцінки ентальпійних змін хімічних реакцій.
