9.4: Ковалентні облігації
- Page ID
- 22567
- Визначте ковалентний зв'язок.
- Проілюструйте утворення ковалентних зв'язків за допомогою електронних точкових діаграм Льюї
Іонне з'єднання зазвичай відбувається, коли одному атому легко втратити один або кілька електронів, а інший атом - отримати один або кілька електронів. Однак деякі атоми не відмовляться або набирають електрони легко. І все ж вони все ще беруть участь у формуванні з'єднання. Як? Існує ще один механізм отримання повної валентної оболонки: спільне використання електронів. Коли електрони діляться між двома атомами, вони утворюють ковалентний зв'язок.
Давайте проілюструємо ковалентний зв'язок, використовуючи атоми Н, з розумінням того, що атомам Н потрібні лише два електрони для заповнення підоболонки 1 s. Кожен атом Н починається з одного електрона в його валентній оболонці:
\[\mathbf{H\, \cdot }\; \; \; \; \; \mathbf{\cdot \: H}\nonumber \]
Два атоми Н можуть ділитися своїми електронами:
\[\mathbf{H}\: \mathbf{: H}\nonumber \]
Ми можемо використовувати кола, щоб показати, що кожен атом H має два електрони навколо ядра, повністю заповнюючи валентну оболонку кожного атома:
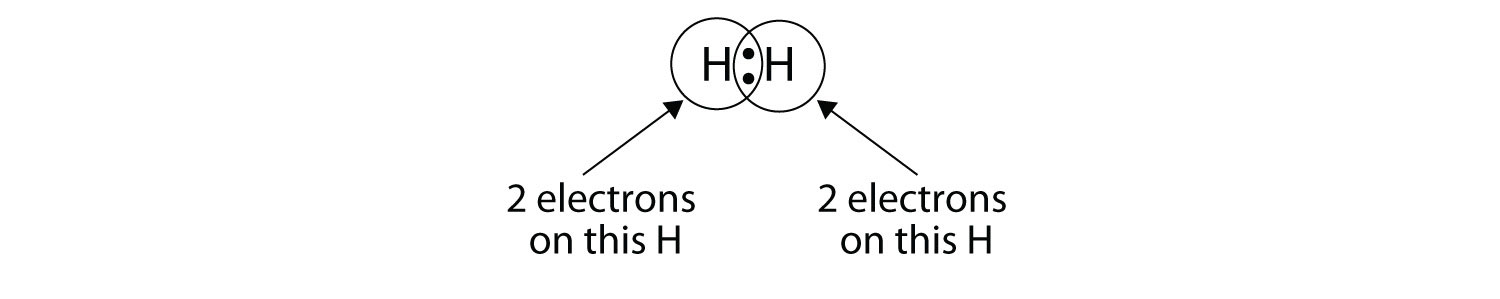
Оскільки кожен атом Н має заповнену валентну оболонку, цей зв'язок стабільний, і ми створили двоатомну молекулу водню. (Це пояснює, чому водень є одним з двоатомних елементів.) Заради простоти, незвично представляти ковалентний зв'язок тире, а не двома крапками:
Ч—Ч
Оскільки два атоми поділяють одну пару електронів, цей ковалентний зв'язок називається єдиним зв'язком. Як інший приклад розглянемо фтор. Атоми F мають сім електронів в валентній оболонці:
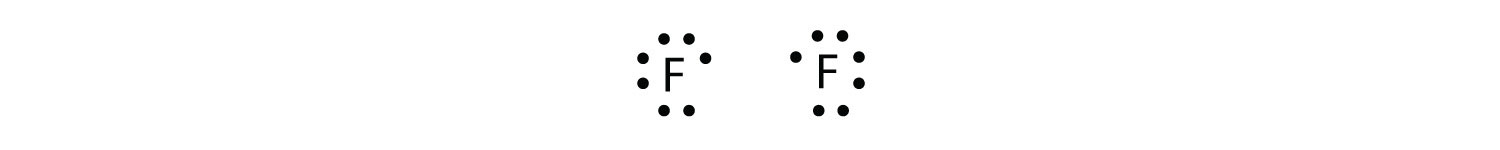
Ці два атоми можуть робити те саме, що і атоми Н; вони поділяють свої непарні електрони, щоб створити ковалентний зв'язок.

Зверніть увагу, що кожен атом F має повний октет навколо нього зараз:
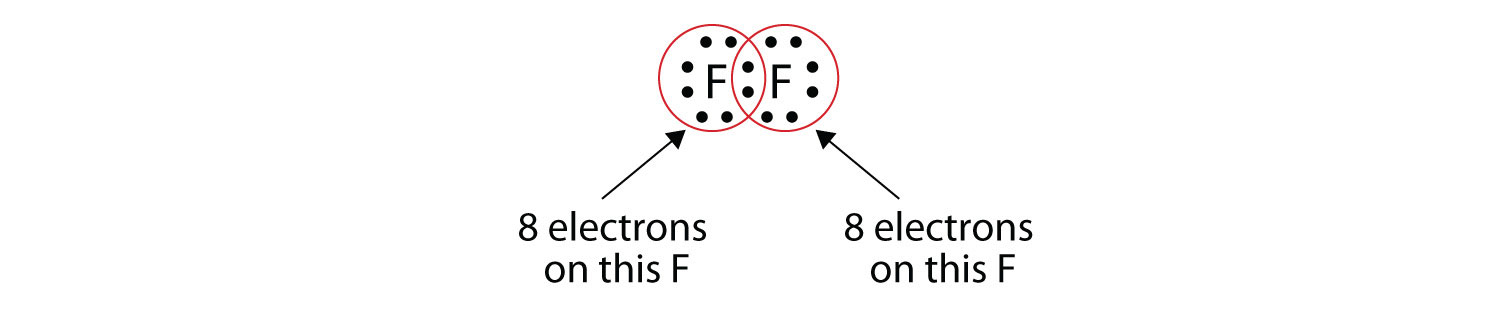
Ми також можемо написати це за допомогою тире для представлення спільної електронної пари:
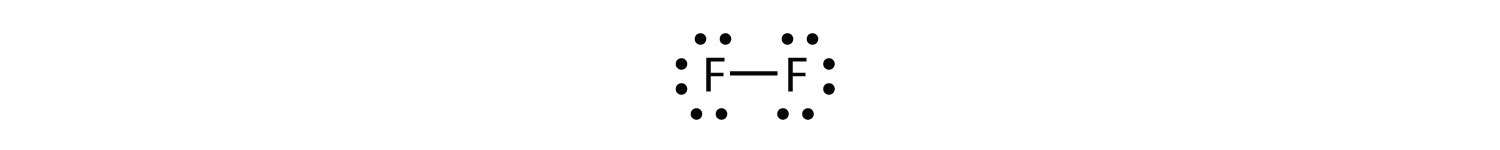
У двоатомній молекулі фтору є два різних типи електронів. Зв'язуюча електронна пара робить ковалентний зв'язок. Кожен атом F має три інші пари електронів, які не беруть участі в зв'язку; вони називаються одинокими парними електронами. Кожен атом F має одну сполучну пару і три одинокі пари електронів.
Ковалентні зв'язки можуть бути зроблені між різними елементами, а також. Одним із прикладів є HF. Кожен атом починається з непарної кількості електронів у своїй валентній оболонці:

Два атоми можуть ділитися своїми непарними електронами, щоб створити ковалентний зв'язок:

Відзначимо, що атом Н має повну валентну оболонку з двома електронами, в той час як атом F має повний октет електронів.
Використовуйте електронні точкові діаграми Льюїса, щоб проілюструвати утворення ковалентних зв'язків у HBr.
Рішення
HBr дуже схожий на HF, за винятком того, що він має Br замість F. Атоми такі:

Два атоми можуть ділитися своїм непарним електроном:
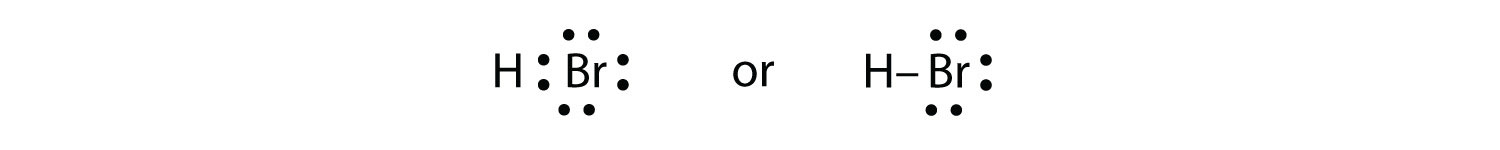
Використовуйте електронні точкові діаграми Льюїса, щоб проілюструвати утворення ковалентних зв'язків у Cl 2.
Відповідь

Більше двох атомів можуть брати участь у ковалентному зв'язку, хоча будь-який даний ковалентний зв'язок буде лише між двома атомами. Розглянемо атоми H і O:

Атоми H і O можуть ділити електрон, утворюючи ковалентний зв'язок:

Атом Н має повну валентну оболонку. Однак атом О має всього сім електронів навколо нього, що не є повним октетом. Це можна виправити, включивши другий атом Н, чий одиночний електрон зробить другу ковалентну зв'язок з атомом O:

(Неважливо, на якій стороні розташований другий атом Н.) Тепер атом О має повний октет навколо себе, і кожен атом Н має два електрони, що заповнюють свою валентну оболонку. Так утворюється молекула води H 2 O.
Використовуйте електронну точкову діаграму Льюїса, щоб показати ковалентний зв'язок у NH 3.
Рішення
Атом N має наступну електронну точкову діаграму Льюїса:

Він має три непарних електронів, кожен з яких може створити ковалентний зв'язок, ділившись електронами з атомом Н. Електронна точкова діаграма NH 3 виглядає наступним чином:

Використовуйте електронну точкову діаграму Льюїса, щоб показати ковалентний зв'язок у pCl 3.
- Відповідь
-

Існує простий набір кроків для визначення електронної точкової діаграми Льюїса простої молекули. По-перше, ви повинні ідентифікувати центральний атом і навколишні атоми. Центральний атом - це атом в центрі молекули, а навколишні атоми - атоми, що утворюють зв'язки з центральним атомом. Центральний атом зазвичай записується першим у формулі з'єднання (Н 2 О є помітним винятком). Після ідентифікації центральних і оточуючих атомів виконайте наступні дії:
- Підрахуйте загальну кількість валентних електронів. Додайте додатково, якщо вид має негативні заряди, і зніміть деякі для кожного позитивного заряду на вид.
- Запишіть центральний атом і оточіть його оточуючими атомами.
- Помістіть пару електронів між центральним атомом і кожним навколишнім атомом.
- Завершіть октети навколо навколишніх атомів (крім H).
- Покладіть залишилися електрони, якщо такі є, навколо центрального атома.
- Переконайтеся, що кожен атом має повну валентну оболонку.
Спробуємо ці кроки, щоб визначити електронну точкову діаграму для BF 4 −. Атом B - центральний атом, а атоми F - навколишні атоми. Існує негативний знак на вид, тому у нас є додатковий електрон для розгляду.
1. Підрахуйте загальну кількість електронів. В має 3, кожен F має 7, а є один зайвий електрон: 3 + 7 + 7 + 7 + 7 + 1 = 32.
2. Запишіть центральний атом, оточений оточуючими атомами.

3. Помістіть пару електронів між центральним атомом і кожним навколишнім атомом. Це використовує вісім електронів, тому у нас залишилося 32 − 8 = 24 електронів.

4. Завершіть октети навколо навколишніх атомів (крім H). Це використовує ще 24 електрони, залишаючи 24 − 24 = 0 електронів.

5. Покладіть залишилися електрони, якщо такі є, навколо центрального атома. Додаткових електронів для додавання до центрального атома немає.
6. Перевірте. Атом B має вісім електронів навколо нього, як і кожен атом F. Кожен атом має повний октет. Це хороша електронна точкова діаграма Льюїса для BF 4 -.
Іноді, однак, ці кроки не працюють. Якби ми дотримувалися цих кроків для сполуки формальдегіду (CH 2 O), ми отримали б наступне:

Атоми H і O мають належну кількість електронів, але атом С має лише шість електронів навколо нього, а не вісім електронів для октету. Як ми це виправити?
Ми фіксуємо це, визнаючи, що два атоми можуть розділяти більше однієї пари електронів. У випадку CH 2 O атоми O і C поділяють дві пари електронів, в результаті чого в результаті наведена наступна електронна точкова діаграма Льюїса:

Обводячи електрони навколо кожного атома, тепер ми можемо побачити, що атоми O і C мають октети, тоді як кожен атом H має два електрони:
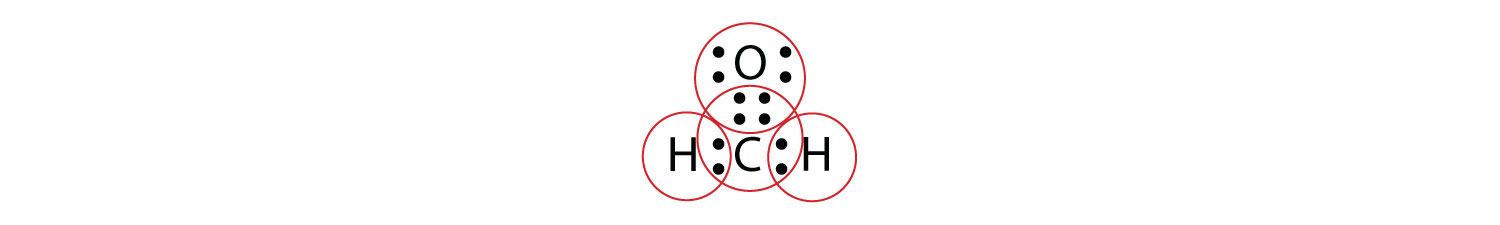
Кожна валентна оболонка заповнена, тому це прийнятна електронна точкова діаграма Льюїса. Якби ми використовували лінії для представлення зв'язків, ми використовували б дві лінії між атомами C і O:

Зв'язок між атомами C і O є подвійним зв'язком і являє собою дві пари зв'язку електронів між атомами. Якщо правила малювання електронних точкових діаграм Льюїса не працюють так, як написано, може знадобитися подвійний зв'язок.
Що таке належна електронна точкова діаграма Льюїса для CO 2?
Рішення
Центральний атом - це атом С, з атомами O як навколишні атоми. У нас всього 4 + 6 + 6 = 16 валентних електронів. Дотримуючись правил для електронно-точкових діаграм Льюїса для сполук дає нам

Атоми O мають повні октети навколо них, але атом С має лише чотири електрони навколо нього. Спосіб вирішення цієї дилеми полягає в тому, щоб зробити подвійний зв'язок між вуглецем і кожним атомом O:

Кожен атом O все ще має вісім електронів навколо нього, але тепер атом С також має повний октет. Це прийнятна електронна точкова діаграма Льюїса для CO 2.
Що таке належна електронна точкова діаграма Льюїса для карбонільного сульфіду (COS)?
Відповідь

Також можлива наявність потрійного зв'язку, в якій між двома атомами знаходяться три пари електронів. Хорошими прикладами цього є елементний азот (N 2) та ацетилен (C 2 H 2):

Ацетилен є цікавим прикладом молекули з двома центральними атомами, які обидва є атомами С. Багатоатомні іони пов'язані між собою ковалентними зв'язками. Оскільки вони є іонами, вони беруть участь в іонному зв'язку з іншими іонами. Таким чином, обидва основні типи склеювання можуть відбуватися одночасно.
Вітаміни - це поживні речовини, які потребують нашому організму в невеликих кількостях, але не можуть синтезувати; тому їх потрібно отримувати з раціону. Слово вітамін походить від «життєво важливий амін», оскільки колись вважалося, що всі ці сполуки мають амінну групу (NH 2) в ньому. Це насправді не так, але назва все одно застрягла.
Всі вітаміни є ковалентно зв'язаними молекулами. Більшість з них прийнято називати буквою, хоча всі вони також мають формальні хімічні назви. Таким чином вітамін А ще називають ретинолом, вітамін С називають аскорбіновою кислотою, а вітамін Е - токоферолом. Єдиного вітаміну В немає, існує група речовин, званих вітамінами комплексу В, які всі розчинні у воді і беруть участь в метаболізмі клітин. Якщо в дієті не вистачає вітаміну, розвиваються такі захворювання, як цинга або рахіт. На щастя, всі вітаміни доступні як добавки, тому будь-який харчовий дефіцит вітаміну можна легко виправити.
Мінерал - це будь-який хімічний елемент, крім вуглецю, водню, кисню або азоту, який необхідний організму. Мінерали, які потребують організму в кількості, включають натрій, калій, магній, кальцій, фосфор, сірку, хлор. Основні мінерали, які потребують організму в крихітних кількостях (так звані мікроелементи), включають марганець, залізо, кобальт, нікель, мідь, цинк, молібден, селен, йод. Мінерали також отримують з раціону. Цікаво, що більшість мінералів споживається в іонному вигляді, а не як елементи або з ковалентних молекул. Як і вітаміни, більшість мінералів доступні у формі таблеток, тому будь-який дефіцит можна компенсувати прийомом добавок.

Резюме
- Ковалентні зв'язки утворюються, коли атоми поділяють електрони.
- Електронні точкові діаграми Льюїса можуть бути намальовані для ілюстрації утворення ковалентного зв'язку.
- Подвійні зв'язки або потрійні зв'язки між атомами можуть знадобитися для правильної ілюстрації зв'язку в деяких молекулах.
