8.6: Концепція рН
- Page ID
- 23131
Результати навчання
- Обчислити між рН/\(\left[ \ce{H^+} \right]\) і pH/\(\left[ \ce{OH^-} \right]\)
- Перетворення між рН, pH, концентрацією іонів водню та концентрацією гідроксид-іонів для даного розчину.
Самоіонізація води
Вода є молекулярною сполукою, тому ви не обов'язково можете очікувати, що вона розпадеться на іони. Однак чутливі експерименти показують, що вода насправді є дуже слабким електролітом. При зіткненні двох молекул води може відбуватися перенесення іона водню з однієї молекули в іншу. Продукти являють собою позитивно заряджений іон гідронію і негативно заряджений гідроксид-іон.
\[\ce{H_2O} \left( l \right) + \ce{H_2O} \left( l \right) \rightleftharpoons \ce{H_3O^+} \left( aq \right) + \ce{OH^-} \left( aq \right)\]
Самоіонізація води - це процес, при якому вода іонізується до іонів гідронію та гідроксидних іонів. Як і в інших водних кислотно-лужних реакціях, процес часто спрощується, щоб показати іонізацію лише однієї молекули води в іон водню та гідроксидний іон.
\[\ce{H_2O} \left( l \right) \rightleftharpoons \ce{H^+} \left( aq \right) + \ce{OH^-} \left( aq \right)\]
Будь-яке рівняння є адекватним, хоча перше є більш точним, оскільки іони водню у водному розчині завжди будуть прикріплені до молекул води. Подальше обговорення кислот та іонізації кислот у цій книзі насамперед покаже іони водню у водному розчині як\(\ce{H^+}\), але майте на увазі, що це лише широко використовувана абревіатура для більш\(\left( \ce{H_3O^+} \right)\) точної структури гідронію.
У чистій воді концентрації іонів водню і гідроксиду рівні один одному. Будь-який водний розчин, в\(\left[ \ce{H^+} \right] = \left[ \ce{OH^-} \right]\) якому кажуть, нейтральний.
Для будь-якого нейтрального розчину при\(25^\text{o} \text{C}\), кожен з цих іонів має концентрацію\(1.0 \times 10^{-7} \: \text{M}\).
Кислий розчин - це розчин, в якому концентрація іонів водню більше концентрації гідроксидних іонів. Наприклад, хлористий водень іонізується для отримання\(\ce{Cl^-}\) іонів\(\ce{H^+}\) і при розчиненні у воді.
\[\ce{HCl} \left( g \right) \rightarrow \ce{H^+} \left( aq \right) + \ce{Cl^-} \left( aq \right)\]
Це збільшує концентрацію\(\ce{H^+}\) іонів в розчині.
Базовим розчином є розчин, в якому концентрація гідроксид-іонів більше концентрації іонів водню. Твердий гідроксид калію дисоціює у воді з отриманням іонів калію та гідроксидних іонів.
\[\ce{KOH} \left( s \right) \rightarrow \ce{K^+} \left( aq \right) + \ce{OH^-} \left( aq \right)\]
Шкала рН
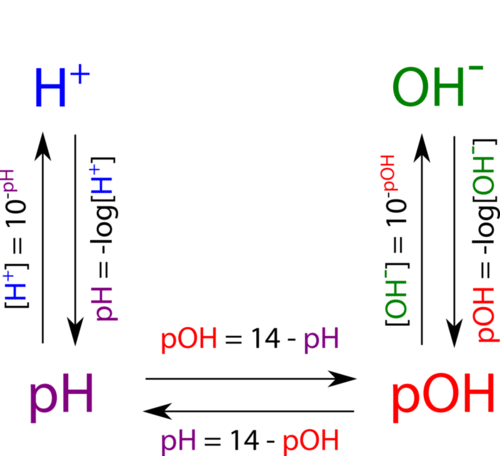
Висловлювання кислотності розчину за допомогою молярності іона водню є громіздким, оскільки кількості, як правило, дуже малі. Данський вчений Søren Sørensen (1868 - 1939) запропонував більш легку систему індикації концентрації\(\ce{H^+}\) називається шкалою рН. Букви pH означають потужність іона водню. РН розчину - це негативний логарифм концентрації іонів водню.
\[\text{pH} = -\text{log} \: \left[ \ce{H^+} \right]\]
У чистій воді або нейтральному розчині\(\left[ \ce{H^+} \right] = 1.0 \times 10^{-7} \: \text{M}\). Підставляємо це значення в вираз pH:
\[\text{pH} = -\text{log} \: \left[ 1.0 \times 10^{-7} \right] = -\left( -7.00 \right) = 7.00\]
Таким чином, рН чистої води або будь-якого нейтрального розчину становить 7,00. Через дещо менш інтуїтивних правил поводження зі значними цифрами в контексті логарифмів значущими цифрами є лише числа праворуч від десяткової крапки у значенні рН. Оскільки\(1.0 \times 10^{-7}\) має дві значні цифри, рН можна повідомити як 7,00.
Логарифмічна шкала конденсує діапазон кислотності до чисел, які прості у використанні. Наприклад, розчин, в якому\(\left[ \ce{H^+} \right] = 1.0 \times 10^{-4} \: \text{M}\) має концентрацію іонів водню, яка в 1000 разів вище, ніж в чистій воді. Показник рН такого розчину становить 4,00, різниця в 3 одиниці рН. Зверніть увагу, що коли\(\left[ \ce{H^+} \right]\) записано в науковому позначенні і коефіцієнт дорівнює 1, рН - це просто показник зі зміненим знаком. РН розчину в якому\(\left[ \ce{H^+} \right] = 1.0 \times 10^{-2} \: \text{M}\) дорівнює 2,0 і рН розчину в якому\(\left[ \ce{H^+} \right] = 1.0 \times 10^{-10} \: \text{M}\) становить 10,0. Якщо коефіцієнт не дорівнює 1, необхідно скористатися калькулятором для пошуку рН. Наприклад, рН розчину в якому\(\left[ \ce{H^+} \right] = 2.3 \times 10^{-5} \: \text{M}\) можна знайти, як показано нижче.
\[\text{pH} = -\text{log} \: \left[ 2.3 \times 10^{-5} \right] = 4.64\]
Як ми бачили раніше, розчин в якому\(\left[ \ce{H^+} \right]\) вище\(1 \times 10^{-7} \: \text{M}\) кислотного, в той час як розчин в якому\(\left[ \ce{H^+} \right]\) нижче, ніж\(1.0 \times 10^{-7} \: \text{M}\) є основним. Отже, розчини зі значеннями рН менше 7 є кислотними, тоді як розчини зі значеннями рН вище 7 є основними. На малюнку нижче ілюструється цей зв'язок разом з деякими прикладами рН для різних розчинів.

Шкала рН, як правило, представлена як працює від 0 до 14, хоча можна мати рН менше 0 або більше 14. Наприклад, висококонцентрований\(3.0 \: \text{M}\) з\(\ce{HCl}\) має негативний рН.
\[\text{pH} = -\text{log} \left( 3.0 \right) = -0.48\]
Коли відомий рН розчину, можна розрахувати концентрацію іона водню. Зворотний логарифм (або антилог) є\(10^x\) ключем на калькуляторі.
\[\left[ \ce{H^+} \right] = 10^{-\text{pH}}\]
Наприклад, припустимо, що у вас розчин з рН 9,14. \(\left[ \ce{H^+} \right]\)c можна знайти наступним чином:
\[\left[ \ce{H^+} \right] = 10^{-\text{pH}} = 10^{-9.14} = 7.24 \times 10^{-10} \: \text{M}\]
Концепція PoH
Як і у випадку з концентрацією іонів водню, концентрація гідроксид-іона може бути виражена логарифмічно PoH. PoH розчину - негативний логарифм концентрації гідроксид-іон.
\[\text{pOH} = -\text{log} \: \left[ \ce{OH^-} \right]\]
РН розчину може бути пов'язаний з pH. Розглянемо розчин з рН\(=\) 4,0. PoH рішення було б 10. Цей приклад ілюструє наступну взаємозв'язок. Це результат концентрації\(\ce{OH^-}\) іонів\(\ce{H^+}\) і, присутніх в чистій воді, про яку ми не будемо обговорювати далі.
\[\text{pH} + \text{pOH} = 14\]
Шкала PoH схожа на шкалу рН, оскільки pH 7 свідчить про нейтральний розчин. Базовий розчин має PoH менше 7, тоді як кислий розчин має PoH більше 7. PoH зручно використовувати при знаходженні концентрації гідроксид-іонів з розчину з відомим рН.
Приклад\(\PageIndex{1}\)
Знайдіть концентрацію гідроксиду розчину з рН 4,42.
Рішення
Крок 1: Перерахуйте відомі значення та плануйте проблему.
Відомий
- рН\(=\) 4,42
- рН\(+\) рН\(=\) 14
Невідомий
- \(\left[ \ce{OH^-} \right]\)
Спочатку розраховується PoH, а потім\(\left[ \ce{OH^-} \right]\)
Крок 2: Вирішіть.
\[\text{pOH} = 14 - \text{pH} = 14 - 4.42 = 9.58\]
\[\left[ \ce{OH^-} \right] = 10^{-\text{pOH}} = 10^{-9.58} = 2.6 \times 10^{-10} \: \text{M}\]
Крок 3: Подумайте про свій результат.
РН - це показник кислого розчину, а отримана концентрація гідроксид-іонів менше\(1 \times 10^{-7} \: \text{M}\). Відповідь має дві значущі цифри, оскільки даний рН має два знака після коми.
На діаграмі нижче показані всі взаємозв'язки між\(\left[ \ce{H^+} \right]\),\(\left[ \ce{OH^-} \right]\), pH та pOH.