19.7: Регулювання ферментів - Аллостеричний контроль та інгібування зворотного зв'язку
- Page ID
- 22097
- Мета 1
- Завдання 2
У попередньому розділі ви дізналися про різні типи інгібіторів ферментів і про те, як їх можна використовувати для уповільнення або зупинки активності ферментів шляхом зв'язування з ферментом або ферментно-субстратним комплексом. Всі ці типи інгібіторів, крім неконкурентних інгібіторів, працюють шляхом зв'язування з активними активними сайтами ферментів. Неконкурентні інгібітори, однак, працюють шляхом зв'язування з ферментом в місці, відмінному від активного сайту, аллостеричного сайту. Інгібітори та інші молекули, звані активаторами, які зв'язуються з ферментами на алостеричних ділянках, вважаються важливою частиною регуляції ферментів, яка називається аллостеричним контролем. У цьому розділі ми розглянемо аллостеричний контроль та контроль зворотного зв'язку, два способи, за допомогою яких активність ферментів регулюється по-різному.
Аллостеричний контроль
Аллостеричні ферменти мають як місце зв'язування, для зв'язування субстрату і каталізу, так і алостеричний ділянку, для регулювання активності ферментів. Коли молекула регулятора зв'язується з алостеричним ділянкою ферменту, як правило, за допомогою нековалентних взаємодій, в активній ділянці ферменту відбувається конформаційна зміна, що впливає на зв'язування субстрату та швидкість реакції. Аллостерична регуляція активності ферментів може бути як позитивною, що збільшує швидкість реакції, так і негативною, що знижує швидкість реакції.
Коли фермент зв'язує негативний регулятор (або інгібітор), він зазнає зміни активної ділянки таким чином, що запобігає зв'язуванню субстрату, тим самим знижуючи швидкість реакції. Як показано на лівій панелі на малюнку\(\PageIndex{1}\), активний сайт змінюється (в цьому випадку стає менше), і підкладка більше не може зв'язуватися. Позитивні регулятори (активатори) зв'язуються з аллостеричними ділянками і викликають конформаційні зміни, які відкривають активну ділянку для сприяння зв'язуванню субстрату, дозволяючи каталізувати або збільшувати швидкість реакції. На правій панелі малюнка\(\PageIndex{1}\) показаний фермент, який буде зв'язувати субстрат тільки тоді, коли активний сайт утворюється після зв'язування аллостеричного активатора.
Деякі ферменти матимуть більше одного аллостеричного сайту, який може взаємодіяти один з одним, що дозволяє високо контрольовану або тонко налаштовану швидкість реакції.

Контроль зворотного зв'язку
Багато біологічні процеси передбачають послідовну дію декількох ферментів, реакційний шлях, при якому продуктом однієї реакції є субстрат для наступного ферменту і так далі до утворення кінцевого продукту. Позитивна або негативна регуляція цих шляхів часто відбувається шляхом контролю зворотного зв'язку, коли продукт від одного з кроків зворотного зв'язку шляху до більш раннього етапу процесу для збільшення або зменшення виробництва. Це може допомогти візуалізувати фабричну складальну лінію з кожною людиною, відповідальною за один крок (каталітична реакція) у виготовленні ідеальної коробки з 12 пончиків. Якщо остання людина в черзі, який відповідає за покладання 12 пончиків в коробку, відстає, пончики почнуть накопичуватися. Щоб не витрачати пончики або мати менше повних коробок в кінці, було б корисно сигналізувати іншим людям, щоб уповільнити або зробити перерву. Процес подібний у біохімічних шляхах: якщо утворюється занадто багато продукту, шлях потрібно вимкнути, щоб енергія та ресурси не витрачалися даремно.
Розглянемо спосіб, показаний нижче, при якому субстрат А перетворюється в продукт D за допомогою трьох ферментів і двох проміжних продуктів (В і С):
\(A\ \xrightarrow{Enzyme\ 1}\ B\ \xrightarrow{Enzyme\ 2}\ C\ \xrightarrow{Enzyme\ 3}\ D\)
Якщо утворюється багато продукту D, було б достатньо для зв'язування з ферментом 1, який би гальмував утворення продуктів B, а згодом продукту C, і D. Цей тип контролю зворотного зв'язку корисний для запобігання відходів субстрату А та будь-якої енергії, необхідної для активності ферментів 1-3. Як ви побачите в наступних розділах, існує багато різних типів контролю зворотного зв'язку, які можуть як негативно, так і позитивно регулювати шляхи. Як правило, контроль зворотного зв'язку відбувається в точках шляхів, де було б енергетично несприятливим для продовження, якщо кінцевий продукт не потрібен.
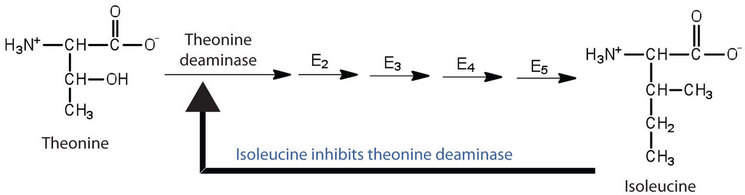
Інгібування зворотного зв'язку використовується для регулювання синтезу багатьох амінокислот. Наприклад, бактерії синтезують ізолейцин з треоніну в серії з п'яти ферментативно-каталізованих етапів. Зі збільшенням концентрації ізолейцину частина його зв'язується як неконкурентний інгібітор з першим ферментом ряду (треонін деаміназа), тим самим спричиняючи зменшення кількості утворюється ізолейцину (рис.\(\PageIndex{2}\)).