11.5: Радіоактивний період напіврозпаду
Цілі навчання
- Визначити період напіврозпаду.
- Визначте кількість радіоактивної речовини, що залишилася після заданої кількості періодів напіврозпаду.
- Опишіть поширену радіометричну техніку датування вуглецю 14.
Незалежно від того, чи є даний ізотоп радіоактивним, є характеристикою цього конкретного ізотопу. Деякі ізотопи стійкі до нескінченності, а інші - радіоактивні і розпадаються через характерну форму випромінювання. З плином часу буде все менше і менше радіоактивного ізотопу, а рівень радіоактивності знижується. Цікавим і корисним аспектом радіоактивного розпаду є період напіврозпаду (t 1/2), який є кількістю часу, необхідного для розпаду половини радіоактивного ізотопу. Період напіврозпаду специфічного радіоактивного ізотопу є постійним; він не впливає на умови і не залежить від початкової кількості цього ізотопу.
Кожен радіоактивний нуклід має характерний, постійний період напіврозпаду (t 1/2), час, необхідний для розпаду половини атомів у зразку. Період напіврозпаду ізотопу дозволяє визначити, як довго буде доступний зразок корисного ізотопу, і як довго зразок небажаного або небезпечного ізотопу повинен зберігатися, перш ніж він розпадається до досить низького рівня випромінювання, який більше не є проблемою.
Наприклад, джерело кобальт-60, оскільки половинаCo6027 ядер розпадається кожні 5,27 року, як кількість матеріалу, так і інтенсивність випромінюваного випромінювання скорочується вдвічі кожні 5,27 року. (Зверніть увагу, що для даної речовини інтенсивність випромінювання, яке воно виробляє, прямо пропорційна швидкості розпаду речовини і кількості речовини.) Таким чином, джерело кобальт-60, який використовується для лікування раку, повинен регулярно замінюватися, щоб продовжувати бути ефективним.

Ми можемо визначити кількість радіоактивного ізотопу, що залишився після заданого числа період напіврозпаду, використовуючи наступний вираз:
amount remaining=initial amount×(12)n
деn - кількість періодів напіврозпаду. Цей вислів працює навіть в тому випадку, якщо кількість періодів напіврозпаду не є цілим числом.
Приклад11.5.1: Фтор-20
Період напіввиведення фтору-20 становить 11,0 с Якщо в зразку спочатку міститься 5,00 г фтору-20, скільки залишається через 44,0 с?
Рішення
Якщо порівняти час, який пройшов до періоду напіврозпаду ізотопу, то зауважимо, що 44.0 с - це рівно 4 періоди напіврозпаду, тому використовуючи попередній вираз, n = 4. Заміна та рішення призводить до наступного:
amount remaining=5.00g×(12)4=5.00g×(116)=0.313g
Залишається менше однієї третини грама фтору-20.
Вправа11.5.1: Титан-44
Період напіввиведення титану-44 становить 60,0 у.Зразок титану містить 0,600 г титаніу-44. Скільки залишається після 240.0 у?
- Відповідь
-
0,0375 г
Період напіврозпаду ізотопів коливається від частки мікросекунди до мільярдів років. Таблиця11.5.1 - Період напіврозпаду різних ізотопів, перераховані періоди напіврозпаду деяких ізотопів.
| Ізотоп | Період напіврозпаду |
|---|---|
| 3 Ч | 12,3 г |
| 14 С | 5730 г |
| 40 Кб | 1,26 × 10 9 років |
| 51 кр | 27,70 г |
| 90 Ср | 29.1 г |
| 131 Я | 8,04 г |
| 222 Рн | 3 823 д |
| 235 U | 7,04 × 10 8 років |
| 238 U | 4,47 × 10 9 років |
| 241 ранку | 432,7 г |
| 248 Кб | 23,7 год |
| 260 Сг | 4 мс |
Хімія всюди: радіоактивні елементи в організмі
Можливо, ви не вважаєте себе радіоактивним, але ви є. Невелика частина певних елементів в організмі людини радіоактивна і постійно піддається розпаду. Велика частина радіоактивності в організмі людини надходить від калію-40 і вуглецю-14. Калій і вуглець - це два елементи, без яких ми абсолютно не можемо жити, тому, якщо ми не зможемо видалити всі радіоактивні ізотопи цих елементів, немає можливості уникнути хоча б деякої радіоактивності. Йдуть суперечки про те, який радіоактивний елемент більш проблематичний. Калію-40 в організмі більше, ніж вуглецю-14, і він має набагато більш тривалий період напіввиведення. Калій-40 також розпадається приблизно в 10 разів більше енергії, ніж вуглець-14, що робить кожен розпад потенційно більш проблематичним. Однак вуглець - це елемент, який становить кістяк більшості живих молекул, завдяки чому вуглець-14 частіше присутній навколо важливих молекул, таких як білки та молекули ДНК. Більшість експертів сходяться на думці, що хоча безглуздо очікувати абсолютно ніякого впливу радіоактивності, ми можемо і повинні мінімізувати вплив надлишкової радіоактивності.
Радіометричні знайомства
Кілька радіоізотопів мають період напіврозпаду та інші властивості, які роблять їх корисними для цілей «датування» походження таких об'єктів, як археологічні артефакти, раніше живі організми або геологічні утворення. Радіоактивність вуглецю-14 забезпечує метод датування об'єктів, які входили до складу живого організму. Цей метод радіометричного датування, який також називають радіовуглецевим датуванням або датуванням вуглецю 14, є точним для датування вуглецевмісних речовин, які досягають приблизно 30 000 років, і може забезпечити досить точні дати максимум близько 50 000 років.
Природний вуглець складається з трьох ізотопів:C126, який становить близько 99% вуглецю на землі;C136, близько 1% від загальної кількості; і слідові кількостіC146. Вуглець-14 утворюється у верхній атмосфері реакцією атомів азоту з нейтронами від космічних променів в просторі:
N147+n10⟶C146+H11
Всі ізотопи вуглецю вступають в реакцію з киснем з утворенням молекул СО 2. СпіввідношенняCO2146 доCO2126 залежить від співвідношенняCO146 доCO126 в атмосфері. Природна велика кількістьCO146 в атмосфері становить приблизно 1 частина на трильйон; до недавнього часу це, як правило, було постійним, як видно з зразків газу, виявлених в пастці в льоду. Включення рослинC146CO2146 іCO2126 в них є регулярною частиною процесу фотосинтезу, а це означає, щоC146:C126 співвідношення, виявлене в живій рослині, таке ж, якC146:C126 співвідношення в атмосфері. Але коли рослина гине, воно більше не затримує вуглець за допомогою фотосинтезу. ОскількиC126 є стабільним ізотопом і не піддається радіоактивному розпаду, його концентрація в рослині не змінюється. Однак вуглець-14 розпадається за рахунок β емісії з періодом напіврозпаду 5730 років:
C146⟶N147+e−01
Таким чином,C146:C126 співвідношення поступово зменшується після загибелі рослини. Зниження співвідношення з часом забезпечує міру часу, що минув з моменту загибелі рослини (або іншого організму, який з'їв рослину). Малюнок11.5.2 візуально зображує цей процес.
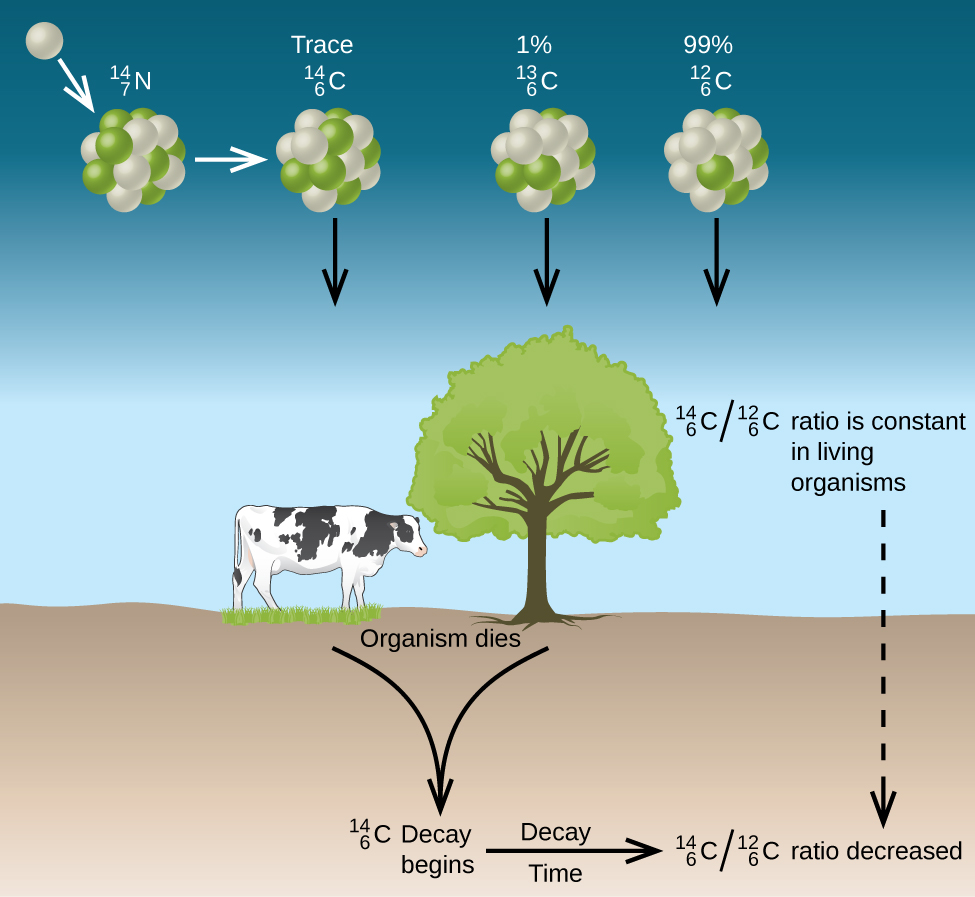
Наприклад, з періодом напіврозпаду 5730 років, якщоC146:C126 співвідношення в дерев'яному об'єкті, знайденому в археологічних розкопках, вдвічі менше, ніж у живому дереві, це вказує наC146 те, що дерев'яному об'єкту 5730 років. Високоточні визначенняC146:C126 співвідношень можна отримати з дуже маленьких зразків (всього лише міліграм) за допомогою мас-спектрометра.
Ключові виноси
- Природні радіоактивні процеси характеризуються періодом напіврозпаду, часом, який потрібен половині матеріалу для радіоактивного розпаду.
- Кількість матеріалу, що залишився після певної кількості періодів напіврозпаду, можна легко розрахувати.