10.10: Буферні розчини
- Page ID
- 21792
- Опишіть склад і функції кислотно-базових буферів
- Обчисліть рН буфера до і після додавання доданої кислоти або основи
Суміш слабкої кислоти і її кон'югатної основи (або суміші слабкої основи і її кон'югатної кислоти) називається буферним розчином, або буфером. Буферні розчини протистоять зміні рН при додаванні невеликих кількостей сильної кислоти або міцної основи (рис.\(\PageIndex{1}\)). Розчин оцтової кислоти (\(\ce{CH3COOH}\)і ацетату натрію\(\ce{CH3COONa}\)) - приклад буфера, який складається зі слабкої кислоти і її солі. Прикладом буфера, який складається зі слабкої основи і його солі, є розчин аміаку (\(\ce{NH3(aq)}\)) і хлористого амонію (\(\ce{NH4Cl(aq)}\)).

Як працюють буфери
Суміш оцтової кислоти та ацетату натрію є кислою, оскільки К а оцтової кислоти більше, ніж K b її кон'югатного ацетату основи. Це буфер, оскільки містить як слабку кислоту, так і її сіль. Отже, він діє, щоб підтримувати концентрацію іонів гідронію (і рН) майже постійною шляхом додавання або невеликої кількості сильної кислоти, або сильної основи. Якщо ми додамо таку основу, як гідроксид натрію, іони гідроксиду реагують з кількома присутніми іонами гідронію. Потім більша частина оцтової кислоти вступає в реакцію з водою, відновлюючи концентрацію іонів гідронію майже до початкового значення:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⟶\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
РН змінюється дуже мало. Якщо додати таку кислоту, як соляна кислота, більшість іонів водню з соляної кислоти з'єднуються з ацетатними іонами, утворюючи молекули оцтової кислоти:
\[\ce{H3O+}(aq)+\ce{CH3CO2-}(aq)⟶\ce{CH3CO2H}(aq)+\ce{H2O}(l) \nonumber \]
Таким чином, спостерігається дуже незначне збільшення концентрації іона гідронію, а рН залишається практично незмінним (рис.\(\PageIndex{2}\)).
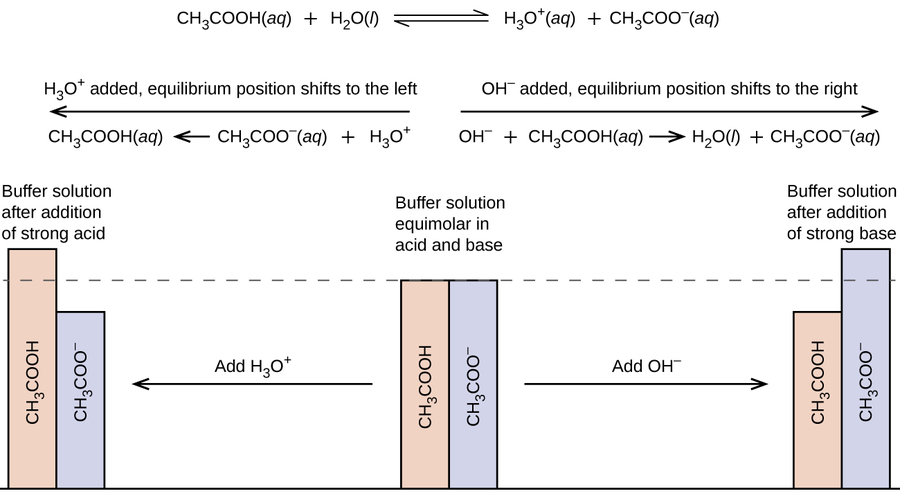
Суміш аміаку та хлориду амонію є основною, оскільки K b для аміаку більше, ніж K a для іона амонію. Це буфер, оскільки він також містить сіль слабкої основи. Якщо додати основу (гідроксидні іони), іони амонію в буфері реагують з гідроксидними іонами, утворюючи аміак і воду і зменшують концентрацію гідроксид-іонів майже до початкового значення:
\[\ce{NH4+}(aq)+\ce{OH-}(aq)⟶\ce{NH3}(aq)+\ce{H2O}(l) \nonumber \]
Якщо додати кислоту (іони гідронію), молекули аміаку в буферній суміші вступають в реакцію з іонами гідронію, утворюючи іони амонію і зменшують концентрацію іонів гідронію майже до початкового значення:
\[\ce{H3O+}(aq)+\ce{NH3}(aq)⟶\ce{NH4+}(aq)+\ce{H2O}(l) \nonumber \]
Три частини наступного прикладу ілюструють зміну рН, що супроводжує додавання основи до буферного розчину слабкої кислоти і до небуферного розчину сильної кислоти.
Ацетатні буфери використовуються в біохімічних дослідженнях ферментів та інших хімічних компонентів клітин для запобігання зміни рН, які можуть змінити біохімічну активність цих сполук.
- Обчисліть рН ацетатного буфера, який представляє собою суміш з 0,10 М оцтової кислоти і 0,10 М ацетату натрію.
- Розрахувати рН після 1,0 мл 0,10 М NaOH додають до 100 мл цього буфера, даючи розчин об'ємом 101 мл.
Рішення
- Обчисліть рН ацетатного буфера, який представляє собою суміш з 0,10 М оцтової кислоти і 0,10 М ацетату натрію.
Для визначення рН буферного розчину використовуємо типовий розрахунок рівноваги (як показано на попередніх прикладах):
- Визначте напрямок змін. Рівновага в суміші Н 3 О +\(\ce{CH3CO2-}\), і СН 3 СО 2 Н становить:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \nonumber \]
Константа рівноваги для CH 3 CO 2 H не задана, тому дивимося її вгору в таблиці E1: K a = 1.8 × 10 −5. При [СН 3 СО 2 Н]\(\ce{[CH3CO2- ]}\) = = 0,10 М і [Н 3 О +] = ~0 М реакція зміщується вправо, утворюючи Н 3 О +.
- Визначте х і рівноважні концентрації. Таблиця змін і концентрацій наступна:
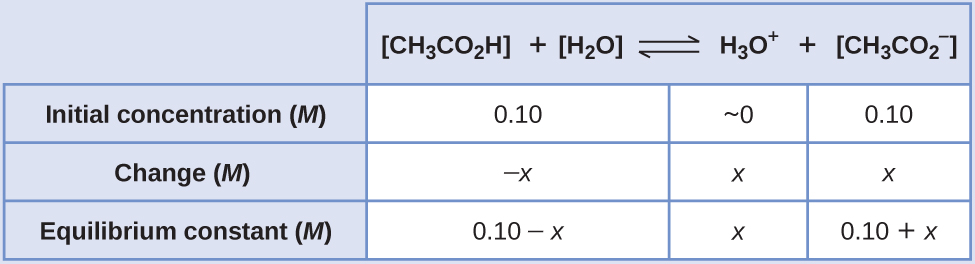
- Визначте напрямок змін. Рівновага в суміші Н 3 О +\(\ce{CH3CO2-}\), і СН 3 СО 2 Н становить:
- Вирішити для x і рівноважних концентрацій. Знаходимо:
\[x=1.8×10^{−5}\:M \nonumber \]
- і
\[\ce{[H3O+]}=0+x=1.8×10^{−5}\:M \nonumber \]
Таким чином:\[\mathrm{pH=−log[H_3O^+]=−log(1.8×10^{−5})} \nonumber \]
\[=4.74 \nonumber \]
4. Перевірте роботу. Якщо обчислити всі розраховані рівноважні концентрації, то виявимо, що рівноважне значення коефіцієнта реакції, Q = K a.
(б) Розрахувати рН після того, як 1,0 мл 0,10 М NaOH додають до 100 мл цього буфера, даючи розчин об'ємом 101 мл.
Спочатку обчислюємо концентрації проміжної суміші, отриманої в результаті повної реакції між кислотою в буфері і доданою основою. Потім визначаємо концентрації суміші при новому рівновазі:
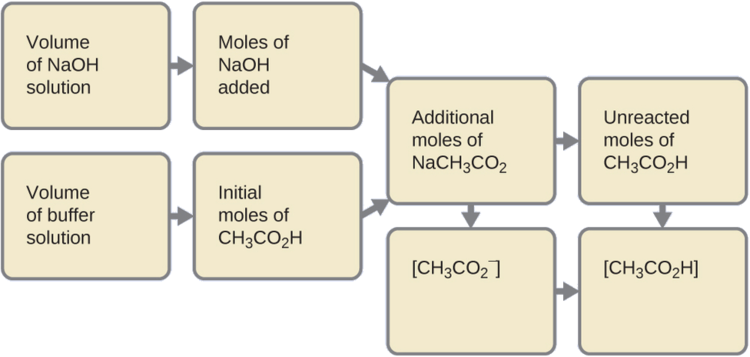
- Визначте родимки NaOH. Один мілілітр (0,0010 л) 0,10 М NaOH містить:
\[\mathrm{0.0010\cancel{L}×\left(\dfrac{0.10\:mol\: NaOH}{1\cancel{L}}\right)=1.0×10^{−4}\:mol\: NaOH} \nonumber \]
- Визначають родимки СН 2 СО 2 Н. Перед реакцією 0,100 л буферного розчину містить:
\[\mathrm{0.100\cancel{L}×\left(\dfrac{0.100\:mol\:CH_3CO_2H}{1\cancel{L}}\right)=1.00×10^{−2}\:mol\:CH_3CO_2H} \nonumber \]
- Вирішити для кількості виробленого NaCH 3 CO 2. 1,0 × 10 −4 моль NaOH нейтралізує 1,0 × 10 −4 моль CH 3 CO 2 H, залишаючи:
\[\mathrm{(1.0×10^{−2})−(0.01×10^{−2})=0.99×10^{−2}\:mol\:CH_3CO_2H} \nonumber \]
і виробляти 1,0 × 10 −4 моль NaCH 3 СО 2. Це робить в цілому:
[\ матрм {(1.0×10^ {−2}) + (0.01×10^ {−2}) =1.01×10^ {−2}\ :моль\ :nach_3Co_2}\ номер\]
4. Знайдіть молярність виробів. Після реакції СН 3 СО 2 Н і NaCH 3 СО 2 містяться в 101 мл проміжного розчину, так:
\[\ce{[CH3CO2H]}=\mathrm{\dfrac{9.9×10^{−3}\:mol}{0.101\:L}}=0.098\:M \nonumber \]
\[\ce{[NaCH3CO2]}=\mathrm{\dfrac{1.01×10^{−2}\:mol}{0.101\:L}}=0.100\:M \nonumber \]
Тепер обчислюємо рН після того, як проміжний розчин, який становить 0,098 М в СН 3 СО 2 Н і 0,100 М в NaCH 3 CO 2, приходить в рівновагу. Розрахунок дуже схожий на той, що в частині (а) цього прикладу:

Цей ряд розрахунків дає рН = 4,75. Таким чином додавання основи ледь змінює рН розчину.
(в) Для порівняння розраховують рН після 1,0 мл 0,10 М NaOH додають до 100 мл розчину небуферизованого розчину з рН 4,74 (1,8 × 10 −5 - М розчин HCl). Обсяг кінцевого розчину - 101 мл.
Рішення
Цей 1,8 × 10 −5 - М розчин HCl має таку ж концентрацію іонів гідронію, що і 0,10- М розчин оцтової кислотно-ацетатного буфера натрію, описаного в частині (а) цього прикладу. Розчин містить:
\(\mathrm{0.100\:L×\left(\dfrac{1.8×10^{−5}\:mol\: HCl}{1\:L}\right)=1.8×10^{−6}\:mol\: HCl} \)
Як показано в частині (b), 1 мл 0,10 М NaOH містить 1,0 × 10 −4 моль NaOH. Коли розчини NaOH і HCl змішуються, HCl є граничним реагентом в реакції. Весь HCl реагує, і кількість NaOH, яка залишається, становить:
\( (1.0×10^{−4})−(1.8×10^{−6})=9.8×10^{−5}\:M \)
Концентрація NaOH становить:
\(\dfrac{9.8×10^{−5}\:M\:\ce{NaOH}}{0.101\:\ce{L}}=9.7×10^{−4}\:M \)
PoH цього рішення:
\(\mathrm{pOH=−log[OH^- ]=−log(9.7×10^{−4})=3.01} \)Показник рН становить:
\(\mathrm{pH=14.00−pOH=10.99} \)
У цьому небуферизованому розчині рН змінюється від 4,74 до 10,99. Це порівнюється зі зміною 4.74 на 4.75, що сталася, коли така ж кількість NaOH була додана до буферного розчину, описаного в частині (b).
Показати, що додавання 1,0 мл 0,10 М HCl змінює рН 100 мл розчину 1,8 × 10 −5 М HCl з 4,74 до 3,00.
- Відповідь
-
Початковий рН 1,8 × 10 −5 М HCl; рН = −лог [H 3 O +] = −лог [1,8 × 10 −5] = 4,74
Молі H 3 O +, додані додаванням 1,0 мл 0,10 М HCl: 0,10 моль/л × 0,0010 L = 1,0 × 10 −4 молі; кінцевий рН після додавання 1,0 мл 0,10 М HCl:
\[\mathrm{pH=−log[H_3O^+]=−log\left(\dfrac{total\: moles\:H_3O^+}{total\: volume}\right)=−log\left(\dfrac{1.0×10^{−4}\:mol+1.8×10^{−6}\:mol}{101\:mL\left(\dfrac{1\:L}{1000\:mL}\right)}\right)=3.00} \nonumber \]
Буферна ємність
Буферні розчини не мають необмеженої здатності підтримувати рН відносно постійним (рис.\(\PageIndex{3}\)). Якщо ми додамо стільки основи до буфера, що слабка кислота вичерпана, більше не буде можлива буферна дія до основи. З іншого боку, якщо ми додамо надлишок кислоти, слабка основа буде вичерпана, і більше ніяких буферних дій щодо будь-якої додаткової кислоти не буде можливим. Насправді нам навіть не потрібно вичерпувати всю кислоту або основу в буфері, щоб перевантажити його; його буферна дія швидко зменшиться, оскільки даний компонент наближається до виснаження.

Малюнок\(\PageIndex{3}\): Колір індикатора (метиловий апельсин) показує, що невелика кількість кислоти, доданої в буферний розчин pH 8 (стакан зліва) мало впливає на буферну систему (середній стакан). Однак велика кількість кислоти вичерпує буферну здатність розчину і рН різко змінюється (стакан праворуч). (кредит: модифікація роботи Марка Отта) Буферна ємність - це кількість кислоти або основи, яку можна додати до заданого обсягу буферного розчину до того, як рН значно зміниться, як правило, на одну одиницю. Буферна ємність залежить від кількості слабкої кислоти і її кон'югатної основи, які знаходяться в буферній суміші. Наприклад, 1 л розчину, який становить 1,0 М в оцтовій кислоті і 1,0 М в ацетаті натрію, має більшу буферну ємність, ніж 1 л розчину, який становить 0,10 М в оцтовій кислоті і 0,10 М в ацетаті натрію, навіть якщо обидва розчини мають однаковий рН. Перший розчин має більшу буферну ємність, оскільки містить більше оцтової кислоти та ацетатного іона.
Вибір відповідних буферних сумішей
Є два корисних правила вибору буферних сумішей:
- Хороша буферна суміш повинна мати приблизно рівні концентрації обох її компонентів. Буферний розчин, як правило, втратив свою корисність, коли один компонент буферної пари менше приблизно 10% іншого. \(\PageIndex{4}\)На малюнку показано оцтову кислотно-ацетатний іонний буфер, як основа додається. Початковий рН - 4,74. Зміна 1 одиниці рН відбувається при зниженні концентрації оцтової кислоти до 11% концентрації ацетат-іонів.
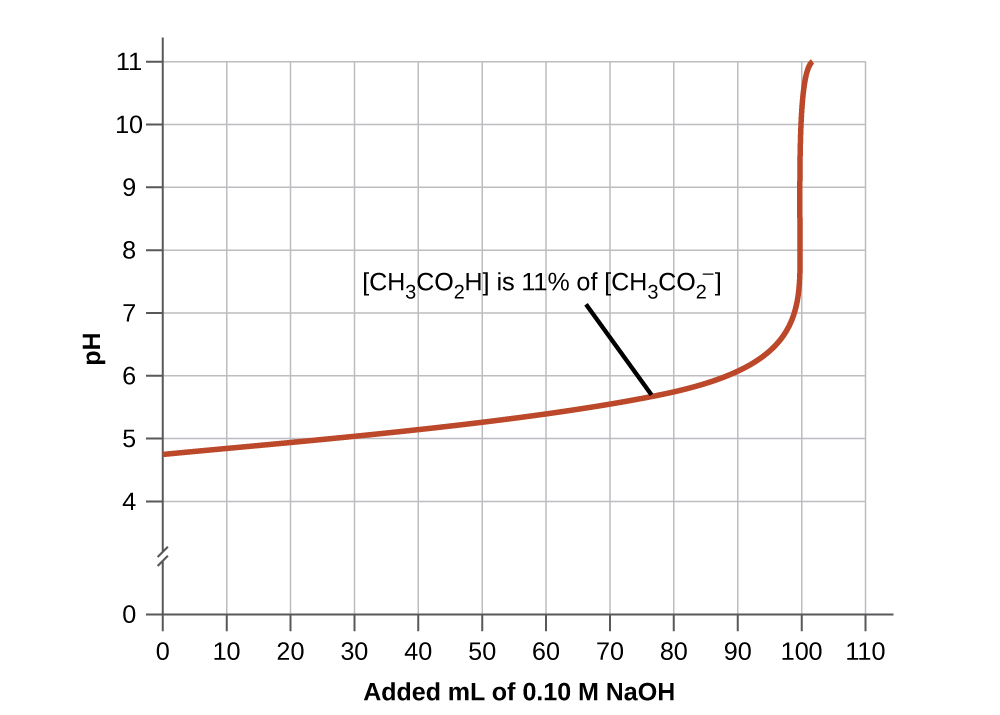
Малюнок\(\PageIndex{4}\): Графік, ілюстрація буферизації дії, показує зміну рН, оскільки зростаюча кількість 0,10-М розчину NaOH додається до 100 мл буферного розчину, в якому спочатку\([\ce{CH3CO2H}] = 0.10\: M\) і\(\ce{[CH3CO2^{-}]}=0.10\:M\).
- Слабкі кислоти та їх солі краще як буфери для рН менше 7; слабкі основи та їх солі краще, як буфери для рН більше 7.
Кров є важливим прикладом буферного розчину, причому основною кислотою та іоном, відповідальними за буферну дію, є вугільна кислота, H 2 CO 3 та іон бікарбонату\(\ce{HCO3-}\). Коли надлишок іона водню потрапляє в кров, він видаляється в першу чергу реакцією:
\[\ce{H3O+}(aq)+\ce{HCO3-}(aq)⟶\ce{H2CO3}(aq)+\ce{H2O}(l) \nonumber \]
Коли надлишок гідроксид-іона присутній, він видаляється реакцією:
\[\ce{OH-}(aq)+\ce{H2CO3}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
При цьому рН крові людини залишається дуже близько 7,35, тобто трохи основним. Варіації зазвичай менше 0,1 одиниці рН. Зміна 0,4 одиниці рН, ймовірно, буде смертельною.
Наближення Гендерсона-Хассельбальха
Іонізаційно-постійний вираз для розчину слабкої кислоти можна записати так:
\[K_\ce{a}=\ce{\dfrac{[H3O+][A- ]}{[HA]}} \nonumber \]
Переставляючи розв'язувати для [H 3 O +], отримуємо:
\[\ce{[H3O+]}=K_\ce{a}×\ce{\dfrac{[HA]}{[A- ]}} \nonumber \]
Беручи негативний логарифм обох сторін цього рівняння, приходимо до:
\[\mathrm{−log[H_3O^+]=−log\mathit{K}_a − log\dfrac{[HA]}{[A^- ]}} \nonumber \]
які можуть бути записані як
\[\mathrm{pH=p\mathit{K}_a+log\dfrac{[A^- ]}{[HA]}} \nonumber \]
де p K a - від'ємний від загального логарифма постійної іонізації слабкої кислоти (p K a = −log K a). Це рівняння пов'язує рН, постійну іонізації слабкої кислоти та концентрації слабкої кислоти та її солі в буферному розчині. Вчені часто використовують цей вислів, званий наближенням Гендерсона-Хассельбальха, для обчислення рН буферних розчинів. Важливо зазначити, що припущення «x є малим» має бути дійсним для використання цього рівняння.
Лоуренс Джозеф Хендерсон (1878—1942) був американським лікарем, біохіміком і фізіологом, щоб назвати лише деякі з його численних занять. Він отримав медичний ступінь в Гарварді, а потім провів 2 роки навчання в Страсбурзі, потім частина Німеччини, перш ніж повернутися, щоб зайняти посаду лектора в Гарварді. Зрештою він став професором Гарварду і пропрацював там все своє життя. Він виявив, що кислотно-лужний баланс в крові людини регулюється буферною системою, утвореною розчиненим вуглекислим газом в крові. Він написав рівняння в 1908 році для опису вуглекислотно-карбонатної буферної системи в крові. Хендерсон був широко обізнаний; окрім своїх важливих досліджень з фізіології крові, він також писав про пристосування організмів та їх відповідність з їхнім середовищем, про соціологію та університетську освіту. Він також заснував лабораторію втоми в Гарвардській школі бізнесу, яка вивчала фізіологію людини з особливим акцентом на роботі в промисловості, фізичних вправах та харчуванні.
У 1916 році Карл Альберт Хассельбальх (1874—1962), датський лікар і хімік, поділився авторством в роботі з Крістіаном Бором в 1904 році, в якій описувався ефект Бора, який показав, що здатність гемоглобіну в крові зв'язуватися з киснем була зворотно пов'язана з кислотністю крові і концентрація вуглекислого газу. Шкала рН була введена в 1909 році іншим датчанином, Соренсеном, а в 1912 році Хассельбальх опублікував вимірювання рН крові. У 1916 році Хасселбальх висловив рівняння Хендерсона в логарифмічних вираженнях, що відповідає логарифмічній шкалі рН, і таким чином народилося рівняння Гендерсона-Хассельбальха.
Нормальний показник рН крові людини становить близько 7,4. Карбонатна буферна система в крові використовує наступну реакцію рівноваги:
\[\ce{CO2}(g)+\ce{2H2O}(l)⇌\ce{H2CO3}(aq)⇌\ce{HCO3-}(aq)+\ce{H3O+}(aq) \nonumber \]
Концентрація вугільної кислоти H 2 CO 3 становить приблизно 0,0012 М, а концентрація іона гідрокарбонату становить близько 0,024 М.\(\ce{HCO3-}\) Використовуючи рівняння Гендерсона-Хассельбальха і p K a вуглекислоти при температурі тіла, можна обчислити рН крові:
\[\mathrm{pH=p\mathit{K}_a+\log\dfrac{[base]}{[acid]}=6.1+\log\dfrac{0.024}{0.0012}=7.4} \nonumber \]
Той факт, що концентрація H 2 CO 3 значно нижче, ніж у\(\ce{HCO3-}\) іона, може здатися незвичайним, але цей дисбаланс обумовлений тим, що більшість побічних продуктів нашого метаболізму, які потрапляють в наш кровотік, є кислими. Тому повинна бути більша частка основи, ніж кислоти, щоб ємність буфера не була перевищена.
Молочна кислота виробляється в наших м'язах, коли ми займаємося фізичними вправами. У міру потрапляння молочної кислоти в кров вона нейтралізується\(\ce{HCO3-}\) іоном, виробляючи Н 2 СО 3. Потім фермент прискорює розщеплення надлишку вугільної кислоти до вуглекислого газу та води, які можна усунути диханням. Насправді, крім регулюючого впливу карбонатної буферної системи на рН крові, організм використовує дихання для регулювання рН крові. Якщо рН крові знижується занадто далеко, збільшення дихання виводить СО 2 з крові через легені, рухаючи реакцію рівноваги, таку, що [Н 3 О +] знижується. Якщо кров занадто лужна, більш низька частота дихання збільшує концентрацію CO 2 в крові, рухаючи реакцію рівноваги в інший бік, збільшуючи [Н +] і відновлюючи відповідний рН.
Резюме
Розчин, що містить суміш кислоти та її кон'югатної основи, або основи та її кон'югатної кислоти, називається буферним розчином. На відміну від розчину кислоти, основи або солі, концентрація іонів гідронію буферного розчину не сильно змінюється, коли в буферний розчин додається невелика кількість кислоти або основи. Основа (або кислота) в буфері реагує з доданою кислотою (або основою).
Ключові рівняння
- р К а = −лог К а
- р К б = −лог К б
- \(\mathrm{pH=p\mathit{K}_a+\log\dfrac{[A^- ]}{[HA]}}\)
Глосарій
- буферна ємність
- кількість кислоти або основи, яку можна додати до обсягу буферного розчину до того, як його рН значно зміниться (зазвичай на одну одиницю рН)
- буфер
- суміш слабкої кислоти або слабкої основи і солі її кон'югату; рН буфера чинить опір зміні при додаванні невеликої кількості кислоти або основи
- Рівняння Гендерсона-Хассельбальха
- рівняння, що використовується для розрахунку рН буферних розчинів
- Визначте родимки NaOH. Один мілілітр (0,0010 л) 0,10 М NaOH містить: