10.4: Вода як кислота і основа
- Page ID
- 21817
- Написати хімічні рівняння для води, що діє як кислота і як основа.
- Визначте та використовуйте константу іонного продукту для води для розрахунку концентрацій водних розчинів\(\ce{H3O+}\) та\(\ce{OH-}\) у них.
Вода (Н 2 О) - цікаве за багатьма параметрами з'єднання. Тут ми розглянемо його здатність вести себе як кислота або основа.
За деяких обставин молекула води прийме протон і, таким чином, діє як основа Бронстеда-Лоурі. Ми бачили приклад розчинення HCl в H 2 O:
\[\rm{HCl + H_2O_{(ℓ)} \rightarrow H_3O^+_{(aq)} + Cl^−_{(aq)}} \label{Eq1} \]
За інших обставин молекула води може пожертвувати протон і, таким чином, діяти як кислота Бронстеда-Лоурі. Наприклад, в присутності амідного іона молекула води дарує протон, роблячи аміак як продукт:
\[H_2O_{(ℓ)} + NH^−_{2(aq)} \rightarrow OH^−_{(aq)} + NH_{3(aq)} \label{Eq2} \]
У цьому випадку NH 2 − є основою Бронстеда-Лоурі (акцептор протонів).
Отже, залежно від обставин, H 2 O може виступати або як кислота Бронстеда-Лоурі, або основа Бронстеда-Лоурі. Вода - не єдина речовина, яка може реагувати як кислота в деяких випадках або основа в інших, але це, безумовно, найпоширеніший приклад - і найважливіший. Речовина, яка може або пожертвувати, або приймати протон, в залежності від обставин, називається амфіпротическим з'єднанням.
Молекула води може виступати кислотою або основою навіть у зразку чистої води. Близько 6 в кожні 100 мільйонів (6 в 10 8) молекул води проходять наступну реакцію:
\[H_2O_{(ℓ)} + H_2O_{(ℓ)} \rightarrow H_3O^+_{(aq)} + OH^−_{(aq)} \label{Eq3} \]
Цей процес називається автоіонізацією води (рис.\(\PageIndex{1}\)) і відбувається в кожному зразку води, будь то чиста або частина розчину. Автоіонізація відбувається в тій чи іншій мірі в будь-якій амфіпротической рідини. (Для порівняння, рідкий аміак також піддається автоіонізації, але лише близько 1 молекули на мільйон мільярдів (1 на 10 15) реагує з іншою молекулою аміаку.)
Визначте воду як кислоту Бронстеда-Лоурі або основу Бронстед-Лоурі.
- Н 2 О () + НІ 2 − (ак) → ГНО 2 (ак) + ОН − (aq)
- НС 2 Н 3 О 2 (ак) + Н 2 О () → Н 3 О + (ак) + С 2 Н 3 О 2 − (ак)
Рішення
- У цій реакції молекула води дарує протон іону NO 2 −, роблячи OH − (aq). Як донор протонів, H 2 O діє як кислота Бронстеда-Лоурі.
- У цій реакції молекула води приймає протон з HC 2 H 3 O 2, стаючи H 3 O + (aq). Як протонний акцептор, H 2 O є основою Бронстеда-Лоурі.
Визначте воду як кислоту Бронстеда-Лоурі або основу Бронстед-Лоурі.
- ГСООН (ак) + Н 2 О () → Н 3 О + (ак) + ГСОО − (aq)
- Н 2 О () + РО 4 3 − (aq) → ОН − (aq) + ГПО 4 2 − (aq)
- Відповідь
-
1. H 2 O діє як протонний акцептор (основа Бронстеда-Лоурі)
2. H 2 O діє як донор протонів (кислота Бронстед-Лоурі)
дисоціація води
Як ми вже бачили, Н 2 О може виступати кислотою або основою. У межах будь-якого заданого зразка води деякі\(\ce{H2O}\) молекули діють як кислоти, а інші\(\ce{H2O}\) молекули діють як основи. Хімічне рівняння виглядає наступним чином:
\[\color{red}{\underbrace{\ce{H2O}}_{\text{acid}}} + \color{blue}{\underbrace{\ce{H2O}}_{\text{base}}} \color{black} \ce{<=> H3O^{+} + OH^{−}} \label{Auto} \]
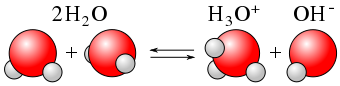
Подібно до слабкої кислоти, автоіонізація води є рівноважним процесом, і правильніше пишеться наступним чином:
\[\ce{H2O(ℓ) + H2O(ℓ) <=> H3O^{+}(aq) + OH^{-}(aq)} \label{Eq7} \]
Ми часто використовуємо спрощену форму реакції:
\[\ce{H2O(l) <=> H+(aq) + OH−(aq)} \nonumber \]
Константа рівноваги для автоіонізації води іменується як іонний продукт для води і дається символом\(K_w\).
\[K_w = [\ce{H^{+}}][\ce{OH^{-}}] \nonumber \]
Константа іонного продукту для води (\(K_w\)) є математичним добутком концентрації іонів водню і гідроксидних іонів. Зверніть увагу, що Н 2 О не входить в іонний продукт вираження, оскільки це чиста рідина. Значення\(K_w\) дуже мало, відповідно до реакції, яка сприяє реагентам. При 25 о С експериментально визначене значення\(K_w\) в чистій воді становить 1,0×10 −14.
\[K_w = [\ce{H^{+}}][\ce{OH^{−}}] = 1.0 \times 10^{−14} \nonumber \]
У зразку чистої води концентрації водню і гідроксидних іонів рівні один одному. Чиста вода або будь-який інший водний розчин, в якому це співвідношення тримається, вважається нейтральним. Щоб знайти молярність кожного іона, береться\(K_w\) квадратний корінь.
[Н +] = [ОН −] = 1,0 × 10 −7
Продукт цих двох концентрацій становить 1,0×10 −14
\[\color{red}{\ce{[H^{+}]}} \color{black}{\times} \color{blue}{\ce{[OH^{-}]}} \color{black} = (1.0 \times 10^{-7})( 1.0 \times 10^{-7}) = 1.0 \times 10^{-14} \nonumber \]
- Для кислот концентрація Н + або [Н +] більше 1,0×10 −7 М
- Для основ концентрація ОН − або [ОН −] більше 1,0×10 −7 М.
Водна HCl є прикладом кислотного розчину. Хлористий водень (HCl) іонізується, утворюючи іони H + і Cl − при розчиненні у воді. Це збільшує концентрацію іонів Н + в розчині. За принципом Ле Шательє рівновага представлена
\[\ce{H2O(l) <=> H^{+}(aq) + OH^{−}(aq)} \nonumber \]
\[\ce{HCl(g) -> H^{+}(aq) + Cl^{−}(aq)} \nonumber \]
Якщо примушують вліво, до реагенту. В результаті концентрація гідроксид-іона зменшується.
Тепер розглянемо KOH (aq), основне рішення. Твердий гідроксид калію (КОН) дисоціює у воді з отриманням іонів калію та гідроксидних іонів.
КОН (и) → К + (aq) + ОН − (aq)
Збільшення концентрації OH − іонів призведе до зменшення концентрації іонів Н +.
Незалежно від того, чи є водний розчин кислотою, основою або нейтральним:і іонний продукт [Н +] [ОН −] залишається постійним.
- Для кислих розчинів [Н +] більше, ніж [ОН −].
- Для базових рішень [OH−] більше, ніж [H +].
- Для нейтральних розчинів [H 3 O +] = [OH−] = 1,0×10 −7 М
Це означає, що якщо ви знаєте\(\ce{[H^{+}]}\) для рішення, ви можете розрахувати що\(\ce{[OH^{−}]}\)) має бути для продукту рівним\(1.0 \times 10^{−14}\), або якщо знаєте\(\ce{[OH^{−}]}\)), ви можете розрахувати\(\ce{[H^{+}]}\). Це також означає, що, як одна концентрація йде вгору, інша повинна йти вниз, щоб компенсувати так, що їх продукт завжди дорівнює вартості\(K_w\).
\[K_w = \color{red}{\ce{[H_3O^+]}} \color{blue}{\ce{[OH^{-}]}} \color{black} = 1.0 \times 10^{-14} \label{eq10} \]
Соляна кислота (HCl) є сильною кислотою, тобто вона 100% іонізується в розчині. Що таке [H +] і [OH −] у розчині 2,0 × 10 −3 M HCl?
Рішення
Крок 1: Перерахуйте відомі значення та плануйте проблему.
Відомий
- [HCl] = 2,0 × 10 −3 М
- КВт = 1,0×10 −14
Невідомий
- [Н +] =? М
- [О −] =? М
Оскільки HCl на 100% іонізований, концентрація іонів H+у розчині буде дорівнює початковій концентрації HCl. Кожна молекула HCl, яка спочатку була присутня, іонізується в один H+іон і один Cl− іон. Потім концентрацію OH− можна визначити з [H+] і Kw.
Крок 2: Вирішіть.
[H +] =2.0×10 −3 М
кВт = [Н +] [ОН −] = 1,0×10 −14
[ОН −] = кВт/ [Н +] = 1,0×10 −14 /2,0 ×10 −3 = 5,0×10 −12 М
Крок 3: Подумайте про свій результат.
[H +] набагато вище, ніж [ОН −], оскільки розчин є кислим. Як і у випадку з іншими константами рівноваги, одиницю для КВт прийнято опускати.
Вправа\(\PageIndex{2}\)
Гідроксид натрію (NaOH) є міцною основою. Що таке [H +] і [OH −] в 0,001 М розчині NaOH при 25° C?
- Відповідь
-
[ОН −] = 0,001М або 1 х 10 -3 М; [H +] =1×10 − 11 М.
Концепція Огляд Вправи
- Поясніть, як вода може діяти як кислота.
- Поясніть, як вода може виступати в якості основи.
Відповіді
- За правильних умов H 2 O може пожертвувати протон, роблячи його кислотою Бронстеда-Лоурі.
- За правильних умов H 2 O може прийняти протон, роблячи його основою Бронстеда-Лоурі.
Ключ на винос
- Молекули води можуть виступати як кислотою, так і основою, в залежності від умов.
Вправи
- Чи діє Н 2 О () як кислота або основа?
Н 2 О () + Н 4 + (ак) → Н 3 О + (ак) + NH 3 (aq)
- Чи діє Н 2 О () як кислота або основа?
СН 3 − (ак) + Н 2 О () → СН 4 (ак) + ОН − (aq)
- У водних розчині деяких солей один з іонів з солі може вступати в реакцію з молекулами води. У деяких розчинах C 2 H 3 O 2 − може відбуватися наступна реакція:
С 2 Н 3 О 2 − (ак) + Н 2 О () → НС 2 Н 3 О 2 (ак) + ОН − (ак)
Чи діє Н 2 О як кислота або основа в цій реакції?
- У водних розчині деяких солей один з іонів з солі може вступати в реакцію з молекулами води. У деяких розчині NH 4 + може виникнути наступна реакція:
Н 4 + (ак) + Н 2 О → Н 3 (ак) + Н 3 О + (ак)
Чи діє Н 2 О як кислота або основа в цій реакції?
- Чому чиста вода вважається нейтральною?
Відповіді
- база
- кислота
- кислота
- база
5. При іонізації води утворюються рівні кількості H + (кислота) і OH − (основа), тому розчин не є ні кислим, ні основним: H 2 O () → H + (aq) + OH − (aq)
[БІЧНА ПРИМІТКА: Це рідко, щоб по-справжньому мати чисту воду. Вода, що піддається впливу повітря, зазвичай буде слабокислою, оскільки розчинений вуглекислий газ, або вугільна кислота, зменшує рН трохи нижче 7. Крім того, розчинені мінерали, такі як карбонат кальцію (вапняк), можуть зробити воду трохи основною.]