9.10: Осмос та осмотичний тиск
- Page ID
- 21891
- Опишіть осмос і як він відноситься до осмотичного тиску.
Осмотичний тиск
Останнє колігативне властивість розчинів, які ми розглянемо, є дуже важливим для біологічних систем. Він включає осмос, процес, за допомогою якого молекули розчинника можуть проходити через певні мембрани, але частинки розчинених речовин не можуть. Коли по обидва боки цих мембран присутні два розчини різної концентрації (звані напівпроникними мембранами), спостерігається тенденція до переміщення молекул розчинника з більш розведеного розчину в більш концентрований розчин до тих пір, поки концентрації двох розчинів не будуть рівні. Така тенденція називається осмотичним тиском. Зовнішній тиск може надаватися на розчин для протидії потоку розчинника; тиск, необхідний для зупинки осмосу розчинника, дорівнює осмотичному тиску розчину.
Осмолярність (осмол) - це спосіб звітування загальної кількості частинок в розчині для визначення осмотичного тиску. Він визначається як молярність розчиненої речовини разів на кількість частинок, яку формула одиниця розчиненої речовини робить, коли вона розчиняється (представлена\(i\)):
\[osmol = M \times i\label{Eq1} \]
Якщо в розчині присутній більше одного розчиненого речовини, окремі осмолярності є добавкою для отримання загальної осмолярності розчину. Розчини, які мають однакову осмолярність, мають однаковий осмотичний тиск. Якщо на протилежних сторонам напівпроникної мембрани присутні розчини різної осмолярності, розчинник перейде з розчину нижчої осмолярності в розчин з вищою осмолярністю. Протитиск, що діє на розчин з високою осмолярністю, зменшить або зупинить перенесення розчинника. Ще більший тиск може надаватися, щоб змусити розчинник з високоосмолярного розчину до розчину з низькою осмолярністю, процес, який називається зворотним осмосом. Зворотний осмос використовується для виготовлення питної води з морської води, де джерел прісної води мало.
На протилежні сторони напівпроникної мембрани розміщують 0,50 М водного розчину NaCl і 0,30 М водного розчину Ca (NO 3) 2. Визначте осмолярність кожного розчину і прогнозуйте напрямок потоку розчинника.
Рішення
Розчинник буде надходити в розчин більш високої осмолярності. Розчинений розчин NaCl розділяється на два іони - Na + та Cl - коли він розчиняється, тому його осмолярність така:
осмол (NaCl) = 0,50 М × 2 = 1,0 осмол
Розчинена речовина Ca (NO 3) 2 розділяється на три іони - один Ca 2 + і два NO 3 - - коли він розчиняється, тому його осмолярність така:
осмол [Са (NO 3) 2] = 0,30 М × 3 = 0,90 осмол
Осмолярність розчину Ca (NO 3) 2 нижче, ніж у розчину NaCl, тому вода буде переходити через мембрану з розчину Ca (NO 3) 2 в розчин NaCl.
З протилежних сторін напівпроникної мембрани укладають 1,5 М С 6 Н 12 О 6 водний розчин і 0,40 М водного розчину Al (NO 3) 3. Визначте осмолярність кожного розчину і прогнозуйте напрямок потоку розчинника.
- Відповідь
-
осмол С 6 Н 12 О 6 = 1,5; осмол Al (NO 3) 3 = 1,6
Розчинник перетікає з розчину С 6 Н 12 О 6 (нижча осмолярність) до\(\ce{Al(NO3)3}\) розчину (вища осмолярність).
Клітинні стінки є напівпроникними мембранами, тому осмотичний тиск рідин організму має важливі біологічні наслідки. Якщо розчини різної осмолярності існують по обидва боки клітин, розчинник (вода) може переходити всередину або з клітин, іноді з плачевними результатами. Розглянемо, що станеться, якщо еритроцити поміщені в гіпотонічний розчин, що означає розчин меншої осмолярності, ніж рідина всередині клітин. Клітини набухають, коли вода потрапляє в них, порушуючи клітинну активність і в кінцевому підсумку змушуючи клітини лопнути. Цей процес називається гемолізом. Якщо еритроцити поміщаються в гіпертонічний розчин, тобто той, що має вищу осмолярність, ніж існує всередині клітин, вода залишає клітини, щоб розріджувати зовнішній розчин, а еритроцити зморщуються і гинуть. Цей процес називається кренацією. Тільки якщо еритроцити поміщені в ізотонічні розчини, які мають таку ж осмолярність, як існує всередині клітин, вони не впливають на негативний вплив осмотичного тиску. Розчини глюкози близько 0,31 М, або розчини хлориду натрію близько 0,16 М, ізотонічні з плазмою крові.
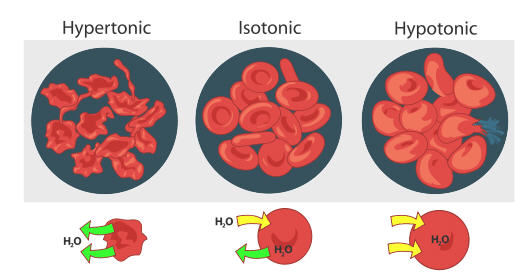
Концентрація ізотонічного розчину хлориду натрію (NaCl) лише вдвічі менше, ніж у розчину ізотонічної глюкози (C 6 H 12 O 6), оскільки NaCl виробляє два іони, коли формульна одиниця розчиняється, тоді як молекулярна C 6 H 12 O 6 виробляє лише один частинки, коли формула одиниця розчиняється. Тому осмолярності однакові, хоча концентрації двох розчинів різні.
Осмотичний тиск пояснює, чому не слід пити морську воду, якщо вас кинули на рятувальному плоту посеред океану. Його осмолярність приблизно в три рази вище, ніж у більшості тілесних рідин. Ви насправді стали б спраглими, оскільки вода з ваших клітин була витягнута, щоб розбавити солону океанську воду, яку ви проковтнули. Наші органи краще справляються з гіпотонічними розчинами, ніж з гіпертонічними. Надлишок води збирається нашими нирками і виводиться з організму.
Ефекти осмотичного тиску використовуються в харчовій промисловості для виготовлення солінь з огірків та інших овочів та при розсолі м'яса для виготовлення солонини. Це також фактор механізму потрапляння води від коренів до верхівок дерев!