8.6: Закон Чарльза - Зв'язок між гучністю та температурою
- Page ID
- 21967
Хоча Закон Бойла досліджує вплив тиску на обсяг газу, Закон Чарльза вивчає вплив температури. Знову ж таки, ви, напевно, знайомі з тим, що підвищення температури газу призведе до розширення газу. Вперше цей ефект кількісно вивчив у 1787 році Жаком Шарлем (1746 - 1823) Франції. Типові дані такого експерименту наведені в табл\(\PageIndex{1}\). Ви можете бачити, що для 0,0466 моль H 2 (г) при постійному тиску підвищення температури на 50° C призводить до збільшення обсягу на 0,18 літра, незалежно від того, збільшується температура від 0,0 до 50,0° C або від 100,0 до 150,0° C Хоча цей експеримент показує, що температура і об'єм взаємопов'язані, це має більш глибокі, більш значущі наслідки, а також.
Таблиця\(\PageIndex{1}\) варіації об'єму H 2 (g) з температурою.
| Температура (градус С) | Обсяг (л) |
|---|---|
| Дані для 0,0446 моль Н 2 (г) при 1 атм (101,3 кПа) | |
| 0.0 | 1.00 |
| 50.0 | 1.18 |
| 100.0 | 1.37 |
| 150.0 | 1.55 |
| Дані для 0,100 моль Н 2 (г) 1 атм (101,3 кПа) | |
| 0.0 | 2.24 |
| 50.0 | 2.65 |
| 100.0 | 3.06 |
| 150.0 | 3.47 |
Температурна шкала Кельвіна і абсолютний нуль
Коли експериментальні дані таблиці\(\PageIndex{1}\) графуються, отримуємо рис\(\PageIndex{1}\). Зверніть увагу, що чотири точки, що відповідають 0,0446 моль H 2 (g), лежать на прямій лінії, як і точки для 0.100 моль H 2 (g). Якщо лінії екстрапольовані (витягнуті за межі експериментальних точок) на дуже низькі температури, ми виявимо, що обидві вони перетинають горизонтальну вісь при —273° C. поведінка H 2 (g) (і багатьох інших газів) при нормальних температурах говорить про те, що якщо ми достатньо охолодити газ, його обсяг стане нульовим при -273° C.
Звичайно, справжня речовина конденсується в рідину і заморожується до твердої речовини, коли вона охолоджувалася. Коли тиск становить 1,00 атм (101,3 кПа), Н 2 (г) зріджується при -253° C і замерзає при -259° C, і тому всі експерименти, пов'язані з цим, повинні бути виконані вище —253° C. якби ми могли знайти газ, який не конденсувався, все одно було б неможливо охолодити його нижче —273° C, тому що при що температура її обсяг дорівнював би нулю. Перехід до нижчої температури відповідав би негативному об'єму - те, що дуже важко уявити. Отже —273° C називають абсолютним нулем температури - неможливо піти нижче.
На малюнку\(\PageIndex{1}\) b нуль температурної осі зміщений в абсолютний нуль. Температурна шкала, яка використовується в цьому графіку, називається абсолютною або термодинамічною температурою. Він вимірюється в одиницях СІ під назвою K elvins (скорочено K), на честь англійського фізика Вільяма Томсона, лорда Кельвіна (1824 по 1907).
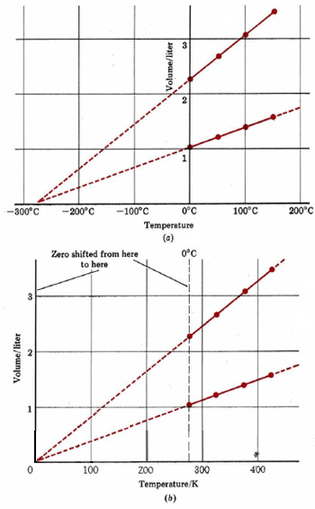
Температурний інтервал 1 К відповідає зміні 1°C, але нуль за термодинамічною шкалою (0 К) дорівнює —273,15°С, температура замерзання води при тиску 1,00 атм (101,3 кПа) становить 273,15 К. Переходячи до абсолютної шкали температури, ми спростили графік об'єму газу в порівнянні з температурою.
Закон Чарльза
На малюнку 1 б видно, що обсяг газу прямо пропорційний його термодинамічній температурі за умови, що кількість газу і тиск залишаються постійними. Це відоме як закон Чарльза, і може бути виражено математично так, де T представляє абсолютну температуру (зазвичай вимірюється в кельвінів).
\[V \propto T \nonumber \]Як і у випадку з попередніми газовими законами, можна ввести постійну пропорційності, в даному випадку k C:\[V=k_{\text{C}}T\text{ or }\frac{V}{T}=k_{\text{C}}\text{ (2)} \nonumber \]
В якості додаткового ресурсу Консорціум Конкорд має інструмент, який дозволяє змінювати температуру газу в контейнері і спостерігати за результуючою зміною обсягу. Цей інструмент може допомогти закріпити ваше розуміння закону Чарльза та співвідношення між об'ємом та температурою: Інтерактивний закон Чарльза.
Проба Н 2 (г) займає обсяг 69,37 см³ при тиску рівно 1 атм при зануренні в суміш льоду і води. При зануренні газу (при цьому тиску) в киплячий бензол його обсяг розширюється до 89,71 см 3. Яка температура кипіння бензолу?
Рішення Як і у випадку з законом Бойла, можливі два способи вирішення.
а) Алгебраїчно, ми маємо, від Eq. (2),\(\frac{V_{\text{1}}}{T_{\text{1}}}=k_{\text{C}}=\frac{V_{\text{2}}}{T_{\text{2}}}\) і підставляючи в рівняння\(T_{\text{2}}=\frac{V_{\text{2}}T_{\text{1}}}{V_{\text{1}}}=\frac{\text{89}\text{.71 cm}^{\text{3}}\text{ }\times \text{ 273}\text{.15 K}}{\text{69}\text{.37 cm}^{\text{3}}}=\text{353}\text{.2 K}\), виходить бажаний результат. (Суміш крижаної води повинна бути на рівні 273,15 К, температура замерзання води.) б) Зі здоровим глуздом стверджуємо, що оскільки газ розширився, його температура повинна була підвищуватися. Таким чином,\(T_{\text{2}}=\text{273}\text{.15 K }\times \text{ ration greater than 1}=\text{273}\text{.15 K }\times \text{ }\frac{\text{89}\text{.71 cm}^{\text{3}}}{\text{69}\text{.37 cm}^{\text{3}}}=\text{353}\text{.2 K}\) Примітка: У цьому прикладі ми використовували розширення газу замість розширення рідкої ртуті для вимірювання температури.