5.4: Концентрація розчинів
- Page ID
- 25628
Концентрація розчину говорить про кількість розчиненої речовини, розчиненої в заданій кількості розчину.
Робимо рішення концентрації знати
Відміряну кількість розчиненого речовини розчиняють в достатній кількості розчинника, щоб зробити потрібний обсяг розчину, як показано на рис. 5.4.1. Концентрація розчину може бути виражена різними способами, використовуючи масу, об'єм або моль одиниць, як пояснюється нижче.
Концентрація у відсотках (%)
Відсоток (%) - це число або співвідношення, що представляють частку 100.
Наприклад, 5% означає 5:100, де 5 - частина, а 100 - загальна. Відсоток розраховується як сто разів від загальної частини, т. Е.
\ begin {рівняння}
\ текст {Відсоток} (\%) =\ frac {\ text {частина}} {\ text {Всього}}\ раз 100. \ nonumber
\ end {рівняння}
50,0 г NaCl розчиняють у воді, щоб вийшов 500 г розчину. Який відсоток NaCl в розчині?
Рішення
Дана частина = 50,0 г NaCl, а всього = 500 г розчину. Бажано:% NaCl в розчині?
Формула:\(\text { Percentage }(\%)=\frac{\text { part }}{\text { Total }} \times 100 \text {. }\nonumber\)
Розрахунки:\(\text { Percentage }(\%)=\frac{50.0 cancel{\mathrm{~g}}}{500 cancel{\mathrm{~g}}} \times 100=10.0 ~\% \mathrm{NaCl}\)
Одиниці скасовуються в частині розрахунку дробу, і до відповіді додається знак%, щоб сказати, що це частка зі ста.
Масовий відсоток (м/м)% концентрації
Масова процентна концентрація виражає масові одиниці розчиненої речовини в ста масових одиницях розчину.
\ begin {рівняння}
\ ім'я оператора {Маса} (\%) =\ frac {\ текст {маса розчиненої речовини} (г)} {\ текст {маса розчиненої речовини} (г) +\ текст {маса розчинника} (г)}\ times 100=\ frac {\ text {маса розчиненої речовини} (г)} {\ текст {маса розчину} (г)} {\ текст {маса розчину} (г)} номер
\ кінець {рівняння}
Зверніть увагу, що в цілому розчинений розчин і розчинник, додані разом, тобто розчин.
Яка маса% NaOH в розчині, приготованому шляхом розчинення 10,0 г NaOH в 100 г води?
Рішення
Враховуючи розчинену речовину = 10,0 г, а розчинник = 100 г, Бажано: Маса% NaOH?
Формула:\(\text { Mass }(\%)=\frac{\text { mass of solute }(g)}{\text { mass of solute }(g)+\text { mass of solvent }(g)} \times 100\)
Розрахунки:\(\text { Mass }(\%)=\frac{10.0 \mathrm{~g} \mathrm{NaOH}}{(10.0 \mathrm{~g}+100 \mathrm{~g}) \text { solution }} \times 100=9.09 \% \mathrm{NaOH}\)
Зверніть увагу, що маса% концентрації та її зворотний коефіцієнт є двома коефіцієнтами перетворення:\(\frac{\text { given } g \text { solute }}{100 g \text { solution }}\) і\(\frac{100 g \text { solution }}{\text { given g solute }}\)
Неоспорін антибіотик являє собою 3,5% м/м розчин неоміцину. Скільки грам неоміцину в 50 г мазі?
Рішення
Дано:\(3.5 \% \text { neomycin }=\frac{3.5 \mathrm{~g} \text { neomycin }}{100 \mathrm{~g} \text { solution }}\), а кількість розчину = 50 г, Бажане:? г неоміцину
Розрахунки:\[50 \cancel{\mathrm{~g} \text { solution }} \times \frac{3.5 \mathrm{~g} \text { neomycin }}{100 \cancel{\mathrm{~g} \text { solution }}}=1.8 \mathrm{~g} \text { neomycin. }\nonumber\]
Об'ємний відсоток (v/v)% концентрації
Об'ємна процентна концентрація виражає об'ємні одиниці розчиненої речовини в ста об'ємних одиницях розчину.
Математична форма v/v% дорівнює:
\ begin {рівняння}
\ текст {Том} (\%) =\ frac {\ text {обсяг розчиненої речовини} (\ mathrm {mL})} {\ текст {обсяг розчину} (\ mathrm {mL})}\ раз 100\ nonumber
\ end {рівняння}
На рис. 5.4.2 показані об'ємні процентні діапазони концентрацій різних класів ароматизаторів.

Який об'єм% екстракту троянди в розчині, приготованому шляхом розчинення 14,0 мл екстракту троянди в розчиннику, щоб зробити 200 мл розчину?
Рішення
Дано: Розчинна речовина = 14,0 г, а розчин = 200 г, Бажаний: Обсяг% розчину троянди?
Формула:\ begin {рівняння}
\ text {Том} (\%) =\ frac {\ text {обсяг розчиненої речовини} (м L)} {\ text {обсяг розчину} (м L)}\ раз 100\ nonumber
\ end {рівняння}
Обчислення:\ begin {рівняння}
\ текст {Том} (\%) =\ frac {14\ mathrm {~mL}\ текст {екстракт троянди}} {200\ mathrm {~mL}\ текст {рішення}}\ раз 100 = 7,0\%\ текст {розчин троянди}\ nonumber
\ кінець {рівняння}
Двома коефіцієнтами перетворення для v/v% концентрації є:
\ begin {рівняння}\ frac {\ text {заданий мл розчиненої речовини}} {100\ mathrm {~mL}\ текст {рішення}}\ quad\ text {~mL}} {\ текст {дано}\ mathrm {~ mL}}\ nonumber
\ end {рівняння}
Який обсяг брому (Br 2) в 250 мл 4,8% в/в розчину Br 2 в чотирихлористого вуглецю?
Рішення
Дано: Концентрація 4,8% в/в брому\(=\frac{4.8 ~m L \text { bromine }}{100 ~m L \text { solution }}\), обсяг розчину = 250 мл, Бажаний: Обсяг розчиненої речовини, т. Е. мл брому.
Обчислення:\ [
250\ mathrm {~mL}\ текст {рішення}\ раз\ frac {4.8\ mathrm {~mL}\ текст {бром}} {100\ mathrm {~mL}\ текст {розчин}.} =12\ mathrm {~мл ~бром}\ текст {.}\ nonumber\]
Відсоток маси/об'єму (м/v)% концентрації
Маса/об'ємна відсоткова концентрація виражає одиниці маси розчиненої речовини в ста об'ємних одиницях розчину.
Математична форма m/v% становить:
\ begin {рівняння}
\ text {Маса/обсяг} (\%) =\ frac {\ text {маса розчиненої речовини} (g)} {\ text {обсяг розчину} (м L)}\ раз 100\ nonumber
\ end {рівняння}
Яка маса/об'єм% розчину глюкози, приготованого шляхом розчинення 50 г глюкози в достатній кількості води, щоб вийшло 1000 мл розчину?
Рішення
Дано: Розчинна речовина = 50,0 г, а Розчин = 1000 мл, Бажано: Маса/Обсяг% розчину глюкози?
Формула:\ begin {рівняння}
\ text {Маса/обсяг} (\%) =\ frac {\ text {маса розчиненої речовини} (g)} {\ text {обсяг розчину} (m L)}\ раз 100\ nonumber
\ end {рівняння}
Обчислення:\ begin {рівняння}
\ frac {\ текст {маса}} {\ текст {том}} (\%) =\ frac {50\ mathrm {~g}\ текст {глюкоза}}
Callstack:
at (Хімія/Вступний,_концептуальний_та_ЗОБ_Хімія/Вступ_до_загальної_хімії_(Malik)/05:_Рішення/5.04:_Концентрація_розчинів), /content/body/div[2]/div[3]/section[2]/div/p[5]/span, line 1, column 1
\ end {рівняння}
Два коефіцієнти перетворення з концентрації ms/v%:\ begin {рівняння}
\ frac {\ текст {дано} g\ текст {розчинений}} {100\ mathrm {~mL}\ текст {рішення}}\ quad\ text {і}\ quad\ frac {100\ mathrm {~mL}\ текст {рішення}} {\ текст {дано}\ mathrm {g}\ текст {розчинена речовина}}\ nonumber
\ end { рівняння}
Скільки грамів антибіотиків кліндаміцину в 45 мл капсули 1,0% (м/в) кліндаміцину?
Рішення
Враховується:% м/в концентрації: 1,08% м/в кліндаміцину\(=\frac{1.0 \mathrm{~g} \text { clindamycin }}{100 \mathrm{~mL} \text { solution }}\), а обсяг розчину = 45 мл, Бажано:? г кліндаміцину?
Розрахунки:\ почати {рівняння}
45\ текст {мл розчин}\ раз\ розрив {1,0\ mathrm {~g}\ текст {кліндаміцин}} {100\ mathrm {~mL}\ текст {рішення}} =4.5\ mathrm {~g}\ текст {кліндаміцин.}\ номер
\ кінець {рівняння}
Частини на мільйон (ppm) і частин на мільярд (ppb) концентрації
Частини на мільйон (проміле) - це число або співвідношення, виражене у частці мільйона (10 6).
Наприклад, 2 проміле означає\(\frac{2}{1,000,000}\) або 2:1 000 000, де 2 - частина, а 1 000 000 - загальна. Концентрація в проміле обчислюється як мільйон разів частки за загальним числом, тобто:\ begin {рівняння}
\ text {Концентрація в проміле} =\ frac {p a r t} {\ text {Total}}\ times 10^ {6}\ nonumber
\ end {рівняння}
Частини на мільярд (ppb) - це число або співвідношення, виражене у частці мільярда (10 9).
Тобто:\ begin {рівняння}
\ text {Концентрація в ppb} =\ frac {\ text {частина}} {\ text {Всього}}\ раз 10^ {9}\ nonumber
\ end {рівняння}
Як і процентна концентрація, ppm і ppb можуть бути маса/маса (м/м), об'єм/об'єм (v/v) або маса/об'єм (м/v).
Межа дії EPA для міді становить 1,3 мг/л у питній воді. Що це за межа в проміле міді м/в питній воді?
Рішення
Враховуючи: 1,3 мг міді в 1л розчину, Бажано:? проміле м/v міді у воді
Формула:\(\text { Concentration in ppm }=\frac{\operatorname{solute}(\mathrm{~g})}{\operatorname{solution}(\mathrm{~mL})} \times 10^{6}\)
Розрахунки: Спочатку перетворіть задані одиниці маси та об'єму у відповідні одиниці, які приймає формула, потім підключіть значення до формули та обчисліть.
\[\text { Solute }=1.3 \mathrm{~mg} \times \frac{1 \mathrm{~g}}{1000 \mathrm{~mg}}=0.0013 \mathrm{~g}\nonumber\]
\[\text { Solution }=1 \mathrm{~L} \times \frac{1000 \mathrm{~mL}}{1 \mathrm{~L}}=1000 \mathrm{~mL}\nonumber\]
\[\text { Concentration in ppm }=\frac{0.0013 \mathrm{~g}}{1000 \mathrm{~mL}} \times 10^{6}=1.3 \mathrm{~ppm} \text { copper } v / \mathrm{m}\nonumber\]
Межа дії EPA для свинцю становить 0,015 мг/л у питній воді. Що це за межа в ppb свинцю м/в питній воді?
Рішення
З огляду на: 0,015 мг в 1л розчину, Бажано:? ppb м/v свинцю у воді
Формула:\(\text { Concentration in ppb }=\frac{\operatorname{solute}(g)}{\operatorname{solution}(\mathrm{mL})} \times 10^{9}\)
Розрахунки: Спочатку перетворіть задані одиниці маси та об'єму у відповідні одиниці, які приймає формула, потім підключіть значення до формули та обчисліть.
\[\text { Solute }=0.015 \mathrm{~mg} \times \frac{1 \mathrm{~g}}{1000 \mathrm{~mg}}=0.000015 \mathrm{~g}\nonumber\]
\[\text { Solution }=1 \mathrm{~L} \times \frac{1000 \mathrm{~mL}}{1 \mathrm{~L}}=1000 \mathrm{~mL}\nonumber\]
\[\text { Concentration in ppb }=\frac{0.000015 \mathrm{~g}}{1000 \mathrm{~mL}} \times 10^{9}=15 \mathrm{~ppb} \text { lead } \mathrm{v} / \mathrm{m}\nonumber\]
Молярність
Молярність (М) виражає родимки розчиненої речовини в літрі розчину.
Найбільш поширеною одиницею концентрації розчину, яка використовується в хімії, є молярність (М):
\[\operatorname{Molarity}~({M})=\frac{n~(\text {moles of solute })}{V ~\text { (Litters of solution })}\nonumber\]
Яка молярність (М) розчину, приготованого шляхом розчинення 50,0 г NaOH в достатній кількості води, щоб зробити 250 мл розчину?
Рішення
Дано: Розчинена речовина = 50,0 г NaOH, Обсяг розчину = 250 мл, Бажано:? М рішення NaOH?
Формула:\(\text { Molarity }(M)=\frac{n~(\text {moles of solute })}{V~(\text {Litters of solution })}\)
Розрахунки: Спочатку перетворіть задані одиниці маси та об'єму у відповідні одиниці, які приймає формула, потім підключіть значення до формули та обчисліть.
\[\text { Solute }=50.0 \mathrm{~g} \mathrm{~NaOH} \times \frac{1 \mathrm{~mol} \mathrm{~NaOH}}{40.00 \mathrm{~g} \mathrm{~NaOH}}=1.25 \mathrm{~mol} \mathrm{~NaOH}\nonumber\]
\[\text { Solution }=250 \mathrm{~mL} \times \frac{1 \mathrm{~L}}{1000 \mathrm{~mL}}=0.250 \mathrm{~L}\nonumber\]
\[\text { Molarity }(M)=\frac{1.25 \mathrm{~mol} \mathrm{~NaOH}}{0.250 \mathrm{~L} \mathrm{~solution}}=5.00 \mathrm{~M} \mathrm{~NaOH}\nonumber\]
Два коефіцієнта перетворення від молярності такі:
\[\frac{n \text { (moles of solute) }}{V \text { (Litters of solution) }} \quad\text { and }\quad \frac{V \text { (Litters of solution) }}{n \text { (moles of solute })}\nonumber\]
Скільки послідів 0,211 М розчину HCl потрібно для забезпечення 0,400 моль HCl?
Рішення
Дано: кількість розчиненої речовини = 0,400 моль HCl, концентрація розчиненої речовини = 0,211M =\(\frac{0.211 \text { mol HCl}}{1 L \text { solution }}\)
Розрахунки:\[\text { Liters of solution needed }=0.400 \mathrm{~mol} \mathrm{~HCl} \times \frac{1 \mathrm{~L} \text { soluton }}{0.211 \mathrm{~mol} \mathrm{~HCl}}=1.90 \mathrm{~L} \text { solution }\nonumber\]
2,50 л 1,12 М розчину NaOH містить скільки родимок NaOH?
Рішення
Дано: Обсяг розчину = 2,50 л розчину, концентрація розчину =\(1.12 \mathrm{~M} \mathrm{~NaOH}=\frac{1.12 \mathrm{~mol} \mathrm{~NaOH}}{1 \mathrm{~L} \text { solution }}\), Бажана:? родимки NaOH?
Розрахунки:\[\text { Moles of } \mathrm{~NaOH} \text { in the solution }=2.50 \text { L solution } \times \frac{1.12 \mathrm{~mol} \mathrm{~NaOH}}{1 \mathrm{~L} \text { solution }}=2.80 \mathrm{~mol} \mathrm{} \mathrm{~NaOH}\nonumber\]
розведення розчинів
Розведення розчину - це додавання розчинника для зменшення концентрації розчиненої речовини в розчині.
Продукт концентрації (С) і об'єму (V) - це кількість розчиненої речовини, тобто
\ begin {рівняння}
\ text {Кількість розчиненої речовини} =C\ text {in}\ frac {\ text {кількість розчиненої речовини}} {\ text {обсяг розчину}}\ час V\ text {в обсязі розв'язку.}\ nonumber
\ end {рівняння}
Кількість розчиненої речовини не змінюється додаванням розчинника. Тому продукт концентрації і обсягу, тобто CV, який є кількістю розчиненої речовини, є постійною, т. Е.
\ begin {рівняння}
C_ {1} V_ {1} =C_ {2} V_ {2} =\ текст {кількість розчиненої речовини}\ nonumber
\ end {рівняння}
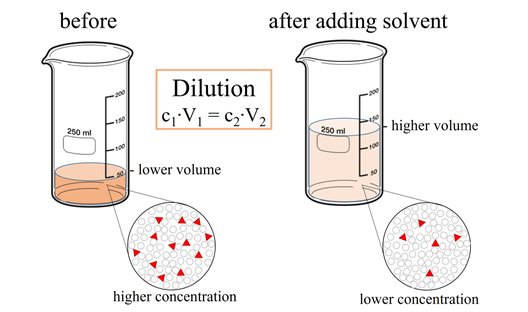
На рис. 5.4.3 показано, що якщо початкова концентрація - С 1, початковий об'єм дорівнює V 1, а після розведення кінцева концентрація - C 2, кінцевий обсяг - V 2, то C 1 V 1 = C 2 V 2 = кількість розчинений, який є постійним. Якщо відомі три з чотирьох змінних у цьому рівнянні, можна обчислити відсутню, як пояснено в наступному прикладі.
Майте на увазі, що концентрації і обсяги повинні бути в однакових одиницях по обидва боки рівняння: C 1 V 1 = C 2 V 2. Якщо вони не знаходяться в однакових одиницях, перетворіть їх в однакові одиниці, перш ніж занурити їх у формулу.
скільки об'єму 11,3 М HCl потрібно для приготування 250 мл 2,00 М HCl?
Рішення
Дано: С 1 = 11,3 М HCl, C 2 = 2,00 М HCl, V 2 = 250 мл розчину, Бажаний V 1 =?
Формула: C 1 V 1 = C 2 V 2, переставляємо його для виділення потрібного параметра:\(V_{1}=\frac{C_{2} V_{2}}{C_{1}}\)
Розрахунки:\[V_{1}=\frac{C_{2} V_{2}}{C_{1}}=\frac{2.00 \mathrm{~M~HCl} \times 250 \mathrm{~mL} \text { solution }}{11.3 \mathrm{~M} \mathrm{~HCl}}=44.2 \mathrm{~mL} \text { solution }\nonumber\]
яка молярність розчину NaOH, приготованого шляхом розведення 100 мл 0,521 М розчину NaOH до 500 мл?
Рішення
З огляду на C 1 = 0,521 М NaOH, V 1 = 100 мл розчину, V 2 = 500 мл розчину, Бажано: Концентрація кінцевого розчину C 2 =? М НаО
Формула: C 1 V 1 = C 2 V 2, переставляємо для виділення потрібного параметра:\(C_{2}=\frac{C_{1} V_{1}}{V_{2}}\)
Розрахунки:\[C_{2}=\frac{C_{1} V_{1}}{V_{2}} = \frac{0.521 \mathrm{~M~NaOH} \times 100 \mathrm{~mL} \mathrm{~NaOH}}{500 \mathrm{~mL} \mathrm{~NaOH}}=0.104 \mathrm{~M~NaOH}\nonumber\]
Допамін вводять внутрішньовенно хворому для підвищення артеріального тиску. Скільки мілілітрів (мл) 4,0% (м/в) розчину дофаміну потрібно для приготування 250 мл 0,030% (м/в) розчину?
Рішення
Дано: С 1 = 4,0% (м/в), С 2 = 0,030% (м/в), V 2 = 250 мл розчину, Бажаний V 1 =?
Формула: C 1 V 1 = C 2 V 2, переставляємо для виділення потрібного параметра:\(V_{1}=\frac{C_{2} V_{2}}{C_{1}}\)
Розрахунки:\[V_{1}=\frac{C_{2} V_{2}}{C_{1}}=\frac{0.030 \% \times 250 \mathrm{~mL} \text { solution }}{4.0 \%}=5.0 \mathrm{~mL} \text { of solution }\nonumber\]
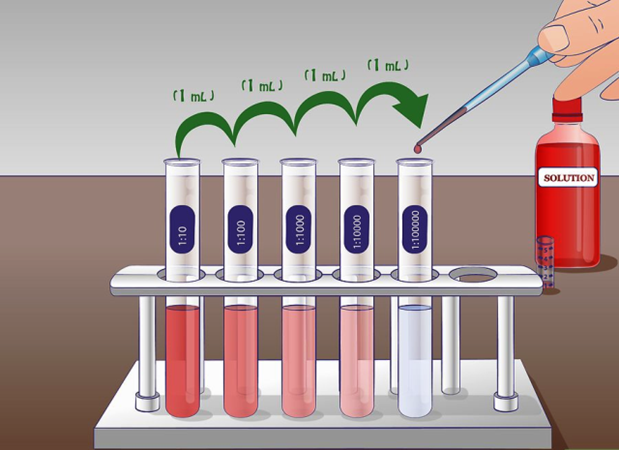
Логарифмічне розведення
Візьміть одиницю обсягу даного розчину і додайте достатню кількість розчинника, щоб збільшити обсяг розчину в 10 разів для логарифмічного розведення.
Логарифмічне розведення - це десятикратне розведення, тобто доведено наступною формулою:\[C_{2}=\frac{C_{1} V_{1}}{V_{2}}=\frac{1 \mathrm{~mL} \times C_{1}}{10 \mathrm{~mL}}=0.1 \times C_{1}\nonumber\]
Повторення вищезазначеного кроку з розведеним розчином призводить до 10x10 = 100-разового розведення, а повторення третього разу призводить до 10x10x10 = 1000-кратне розведення. Це розведення в 10 разів на кожному кроці називається логарифмічним розведенням. На рис. 5.4.4 показано, що п'ять ступенів логарифмічного розведення на 10% вихідному розчині призводять до концентрації 10 проміле в кінцевому розчині.