5.3: Електроліти
- Page ID
- 25618
Що таке електроліт?
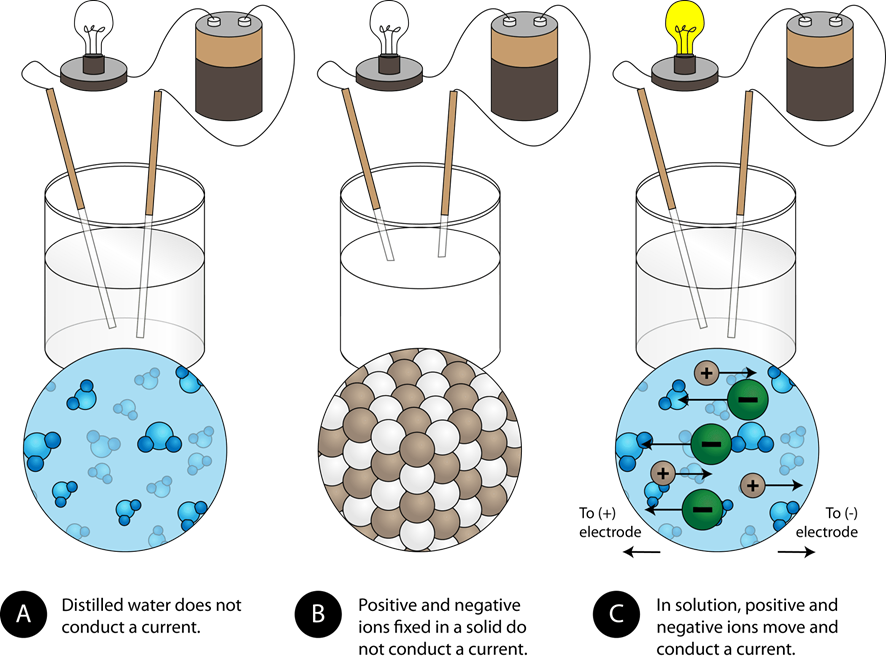
Електричний струм визначається як рух електричних зарядів. Речовини, через які може протікати електричний струм, називаються електричними провідниками, а інші - електричними непровідниками. Метали є електричними провідниками, оскільки валентні електрони атомів металів можуть переміщатися в шматку металу. Іонні сполуки складаються з катіонів і аніонів, але іони в твердому тілі не можуть пересуватися. Тому тверді іонні сполуки є електричними непровідниками. Чиста вода не має достатньої концентрації іонів в ній і є електричним непровідником. Іонні сполуки дисоціюються на іони при розчиненні у воді. Розчин іонних сполук у воді є електричним провідником, оскільки іони можуть переміщатися в розчині, як показано на рис. 5.3.1.
Речовини, які виробляють електропровідний розчин при розчиненні у воді (або в іншому полярному розчиннику), називаються електролітами.
Всі іонні сполуки, кислоти та основи виробляють іони у воді і класифікуються як електроліти.
Речовини, що виробляють електрично непровідний розчин при розчиненні у воді, називаються неелектролітами.
Молекулярні сполуки, крім кислот і підстав, такі як метанол, ацетон, цукор та глюкоза, залишаються нейтральними молекулами при розчиненні у воді. Молекулярні розчинені речовини, крім кислот і підстав, є неелектролітами.
Сильні і слабкі електроліти
Речовини, які майже 100% дисоціюють на іони при розчиненні у воді, є сильними електролітами.
- Всі іонні сполуки, які розчинні у воді, є сильними електролітами.
- Сильні кислоти є сильними електролітами.
- Сильні основи - це іонні сполуки і сильні електроліти.
Сильний електроліт не означає, що він обов'язково добре розчинний у воді. Це означає, що частина розчиненої речовини, яка розчиняється, вона також 100% дисоціює на іони у воді, наприклад, всі іонні сполуки. Розчинність Са (ОН) 2 становить всього 0,16 г Са (ОН) 2 /100 г води при 20 о С, але всі розчинені Ca (OH) 2 дисоціюють на Ca 2 + і OH - іони.
Сильними підставами є гідроксиди лужних металів, тобто LiOH, NaOH, KOH, RBoH і CSOH, і гідроксиди важких лужноземельних металів, тобто Ca (OH) 2, Sr (OH) 2 і Ba (OH) 2, які є сильними електролітами. Сильні кислоти, тобто HCl, HBr, HI, HClO 4, HNO 3 і H 2 SO 4, є молекулярними сполуками, але є сильними електролітами, оскільки вони дисоціюють майже 100% на іони при розчиненні у воді. Наприклад, HCl майже повністю дисоціює на іони при розчиненні у воді.
\ begin {рівняння}
\ математика {HCl} (\ математика {g}) +\ математика {H} _ {2}\ математика {O} (\ математика {l})\ стрілка вправо\ математика {H} _ {3}\ mathrm {O} ^ {1+} (\ mathrm {q}) +\ mathrm {Cl} ^ {1-} (\ mathrm {aq})\ числове число
\ кінець {рівняння}
Речовини, які частково дисоціюються на іони при розчиненні у воді, є слабкими електролітами. Слабкі кислоти і слабкі підстави - слабкі електроліти.
Тижневі кислоти і тижневі основи, як оцтова кислота (СН 3 СООН) і аміак (NH 3), розчинні у воді, але частково дисоціюють на іони. Наприклад, якщо 1-моль оцтової кислоти або 1-моль аміаку розчинений в 1 літрі води кімнатної температури, вони встановлюють наступну рівновагу між розчиненими молекулами і дисоційованими іонами:
\ begin {рівняння}
\ почати {вирівняний}
&\ mathrm {CH} _ {3}\ математика {COOH} (\ mathrm {l})\ stackrel {\ текст {Вода}} {\ longrightarrow}\ mathrm {CH} _ {3}\ математика {COOH} (\ mathrm {q}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {l})\ стековий {\ стрілка вправо} {\ довга ліва стрілка}\ математика {CH} _ {3}\ mathrm {COP} ^ {1-} (\ математика {q}) +\ математика {H} _ {3}\ математика {O} ^ {1+} (\ математика {aq}),\\
&\ математика {NH} _ {3} (\ mathrm {~g})\ квадратний\ штабелер {\ текст {Вода}} {\ longrightarrow}\ mathrm {NH} {3} (\ математика {q}) +\ математика {H} _ {2}\ математика {O} (\ математика {l})\ квадратний\ стекер {\ стрілка вправо} {\ longleftarrow}\ mathrm {NH} _ {4} {} ^ {1+} (\ mathrm {q}) +\ математика {OH} ^ {1-} (\ mathrm {aq}),
\ кінець {вирівняний}\ номер
\ кінець {рівняння}
де лише близько 0,4% розчинених молекул дисоціюються на іони, решта близько 99,6% молекул залишаються нейтральними. Слабкі кислоти і слабкі підстави - слабкі електроліти.
Рис. 5.3.2 ілюструє різницю між неелектролітами, сильними електролітами та слабкими електролітами.
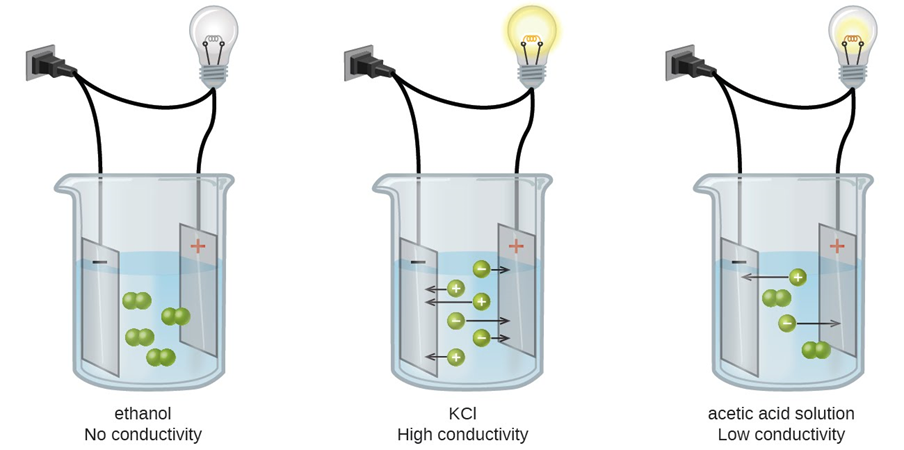
Малюнок\(\PageIndex{2}\): Ілюстрація неелектроліту, який не проводить електрику, сильного електроліту, який має високу електропровідність, і слабкого електроліту, який має низьку електропровідність. Джерело: Карішма 50/ (https; //creativecommons.org/ліцензії/по-са/4.0)
Еквівалент
Кількість молекул і атомів зазвичай вимірюється в молі. Іонні сполуки складаються з іонів, але в цілому нейтральні, оскільки заряд+ve врівноважується зарядом —ve. Тому мольне співвідношення катіонів до аніонів не завжди один до одного. Наприклад, NaCl має мольне співвідношення один до одного Na + і Cl -, а ось CaCl 2 має співвідношення один-до-два Ca 2 + і Cl -. Вводиться нова одиниця, яка називається еквівалентною (офіційно скорочено Equiv, але зазвичай скорочується як Eq), щоб розрізняти моль іона та моль заряду на іоні.
Еквівалентом є кількість речовини, необхідної для реакції з або подачі одного моля іонів водню (H +) в кислотно-лужній реакції, або реагувати з або подавати один моль електронів в окислювально-відновній реакції. Іншими словами, кількість еквівалентів даного іона в розчині дорівнює кількості молів цього іону, помноженому на його валентність.
\[1 \mathrm{~mol} \mathrm{~Na}^{+}=1 \mathrm{~Eq} \mathrm{~Na}^{+} \text {, but } \quad 1 \mathrm{~mol} \mathrm{~Ca}^{2+}=2 \mathrm{~Eq} \mathrm{~Ca}^{2+} \text {, and } 1 \mathrm{~mol} \mathrm{} \mathrm{~Al}^{3+}=3 \mathrm{~Ea} \mathrm{~Al}^{3+}\nonumber\]
Аналогічно,
\[1 \mathrm{~mol} \mathrm{~Cl}^{-}=1 \mathrm{~Eq} \mathrm{~Cl}^{-}\text{, but} \quad 1 \mathrm{~mol} \mathrm{~CO}_{3}{ }^{2-}=2 \mathrm{~Eq} \mathrm{~CO}{ }_{3}{ }^{2-}\text{ and } 1 \mathrm{~mol} \mathrm{~PO}_{4}{ }^{3-}=3 \mathrm{~Ea} \mathrm{~PO}_{4}{ }^{3-}\nonumber\]
Розчини електролітів в цілому електрично нейтральні, тобто кількість еквівалентів катіонів дорівнює числу еквівалентів аніонів в розчині.
Наприклад, якщо 1 моль NaCl розчинений у воді, в розчині знаходиться 1 екв іонів Na + і 1 Eq Cl - іонів. Якщо один моль CaCl 2 розчинений у воді, в розчині знаходиться 2 екв іонів Ca 2 + і 2 Eq Cl - іонів. Аналогічно, якщо у воді розчинено 1 моль NaCl і 1 моль AlCl 3, у воді залишається 1 екв іонів Na +, 3 Eq іонів Al 3 + і 4 Eq Cl - іони для балансування катіонів у воді.
Рівність дає два коефіцієнта перетворення. Наприклад, рівність 1 моль Ca 2 + = 2 Eq Ca 2 + дає наступні два коефіцієнта перетворення:
\[\frac{1 \operatorname{~mol~} C a^{2+}}{2 ~E q ~C a^{2+}}\nonumber\]
і
\[\frac{2 ~E a ~C a^{2+}}{1 ~m o l ~C a^{2+}}\nonumber\]
Перший коефіцієнт перетворення перетворює задану кількість в еквівалентах в молі, а другий перетворює задану кількість в молі в еквіваленти іона, як пояснюється в наступних прикладах.
а) Обчислити меК Fe 3 + в 0,0200 моль Fe 3 +? б) якщо хлорид-іон є єдиним аніоном в розчині, скільки меКв Cl - присутній в розчині?
Рішення
а) З огляду на 0,0200 моль Fe 3 +. Бажаний MEQ Fe 3 +.
Рівність: 1 моль Fe 3 + = 3 Eq Fe 3 + дає коефіцієнт перетворення\(\frac{3 ~E q ~F e^{3+}}{1 ~m o l ~F e^{3+}}\), який перетворює задану кількість в молі в Eq Fe 3 +. Інша рівність: 1 Eq Fe 3 + = 1000 мЕк Fe 3 + дає коефіцієнт перетворення\(\frac{1000 ~m E q ~F e^{3+}}{1 ~E q ~F e^{3+}}\), який перетворює еквалайзер Fe 3 + в MEQ Fe 3 +.
Розрахунки:\[0.0200 \cancel{\text { mol } ~F e^{3+}} \times \frac{3 \cancel{~E q ~F e^{3+}}}{1 \cancel{~m o l ~F e^{3+}}} \times \frac{1000 ~m E q ~F e^{3+}}{1 \cancel{~E q ~F e^{3+}}}=60 ~mE q ~F e^{3+}\nonumber\]
Інтервентний сольовий розчин містить 145 ммоль/л Na +. Скільки молів Na + знаходиться в 0,500 л розчину?
Рішення
а) Враховуючи: 145 мЕв Na +/L розчин і 0,500 л розчину, Бажано:? моль Na +
Необхідні коефіцієнти перетворення: Концентрація в mEq/L є першим фактором для перетворення L в MeQ, рівність 1 мЕк Na + = 1 ммоль Na + дає друге перетворення, необхідне для перетворення МеКв в ммоль, і рівність 1000 ммоль Na + = 1 моль Na + з урахуванням третього коефіцієнт перетворення, необхідний для перетворення MEQ в моль. Три коефіцієнти перетворення застосовуються один за одним в одному рядку в наступному розрахунку:
\[0.500 \cancel{\text { L solution }} \times \frac{145 \cancel{\mathrm{~mEq} \mathrm{~Na}}}{1 \cancel{\text {L solution }}} \times \frac{1 \cancel{\mathrm{~mmol} \mathrm{~Na}^{+}}}{1 \cancel{\mathrm{~mEq} \mathrm{~Na}^{+}}} \times \frac{1 \mathrm{~mol} \mathrm{~Na}^{+}}{1000 \cancel{\mathrm{~mmol} \mathrm{~Na}^{+}}}=0.0725 \mathrm{~mol} \mathrm{~Na}^{+}\nonumber\]
Зверніть увагу, як одиниці чисельника в одному дробі скасовуються одиницями денумератора наступного дробу, залишаючи нескасованими лише бажані одиниці, які стають одиницями числа відповіді.
Електроліти в рідинях організму
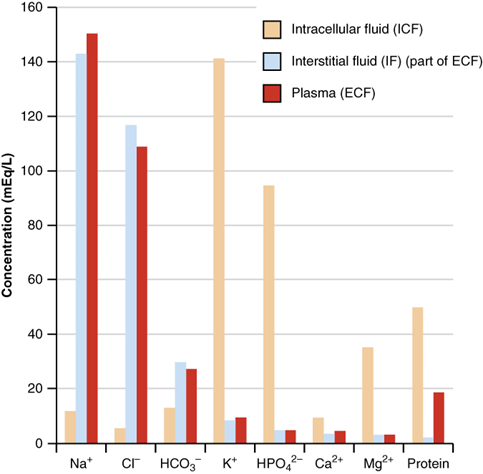
На рис. 5.3.3 показані електроліти та їх концентрації, які зазвичай зустрічаються в рідинях організму. Вони відіграють важливу роль у функціях клітин і організму. Наприклад, іони натрію регулюють вміст води і відіграють певну роль в передачі електричних імпульсів в нервовій системі. Іони калію відіграють певну роль у підтримці регулярного серцебиття, а також відіграють роль у передачі електричних імпульсів. Хлоридні іони є для врівноваження заряду. Карбонатні іони беруть участь в підтримці рН крові.
Концентрації електролітів у рідинях організму недостатньо високі, щоб їх повідомляли в моль або еквівалентних одиницях. Електроліти в рідинях організму, як правило, повідомляються в мілімоль (ммоль) або міліеквівалентних (МеКв) одиниць, де:\(1000 \mathrm{~mmol}=1 \mathrm{~mol}\) і\(1000 \mathrm{~mEq}=1 \mathrm{~Eq}\).
Загальна концентрація електролітів у внутрішньовенних рідинях, що даються пацієнтам, приблизно така ж, як і електролітів у рідинях організму. Наприклад, розчин лактату Рінгера містить близько: 130 мЕкв/л Na +, 4 мЕкв/л К +, 3 мЕкв/л Са 2 +, 109 мЕкв/л Cl -, і 28 мЕкв/л лактату -. Зверніть увагу, що загальний +ве заряд (130+4+3= 137 мЕкв/л) дорівнює загальному заряду —ве (109+28 = 137 мЕкв/л).