3.9: Внутрішньомолекулярні сили та міжмолекулярні сили
- Page ID
- 25464
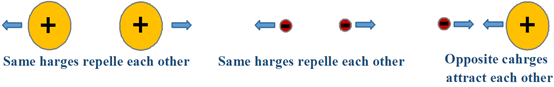
Існують електростатична взаємодія між зарядами або частковими зарядами, тобто однакові заряди притягують один одного, а протилежні заряди відштовхують один одного, як показано на рис. 3.9.1. Існують два типи електростатичних сил в з'єднаннях або молекулах, внутрішньомолекулярні сили, які існують між зв'язаними атомами з'єднання або молекула, і міжмолекулярних сил, які існують між молекулами, як описано нижче.
Внутрішньомолекулярні сили
Внутрішньомолекулярні сили - це хімічні зв'язки, що утримують атоми разом у молекулах. Три основні типи хімічних зв'язків - це металевий зв'язок, іонний зв'язок та ковалентний зв'язок.
Металевий зв'язок
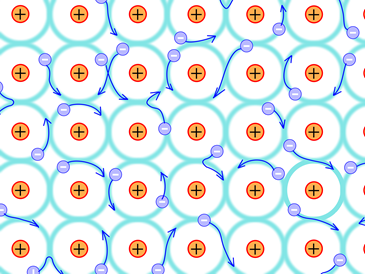
Метали існують як сукупність багатьох атомів як+іонів, розташованих у чітко визначеному тривимірному розташуванні, званому кристалічною решіткою, з деякими з найвіддаленіших електронів, що бродять навколо цілого шматка металу, утворюючи море електронів навколо атомів металу, як показано на рис. 3.9.2. Притягання між іонами +та морем вільних рухомих електронів - це металевий зв'язок, який утримує атоми разом у шматку металу. Металевий зв'язок, як правило, є найміцнішим типом хімічного зв'язку.
Іонний зв'язок
Коли різниця електронегативності між зв'язаними атомами велика, тобто більше 1,9 в більшості випадків зв'язкові електрони повністю переходять від більш електропозитивного атома до більш електронегативного атома, створюючи відповідно катіон і аніон. Відбувається електростатична взаємодія між катіоном і аніоном, тобто однакові заряди притягують один одного, а протилежні заряди відштовхують один одного, як показано на рис. 3.9.1. Катіони та аніони орієнтуються в тривимірній кристалічній решітці таким чином, що привабливі взаємодії максимізуються, а відштовхуючі взаємодії мінімізуються, як показано на рис. 3.9.3. Іонні зв'язки, як правило, слабкіші, ніж металеві зв'язки, але сильніші там інші типи зв'язків.

ковалентний зв'язок
Коли різниця електронегативності між зв'язаними атомами помірна до нуля, тобто зазвичай менше 1,9, зв'язкові електрони поділяються між зв'язаними атомами, як показано на рис. 3.9.4. Привабливою силою між електронами зв'язку і ядрами є ковалентний зв'язок, який утримує атоми разом в молекулах. Ковалентний зв'язок, як правило, слабкіше металевих та іонних зв'язків, але набагато сильніше, ніж міжмолекулярні сили.

Критерії прогнозування типу хімічного зв'язку
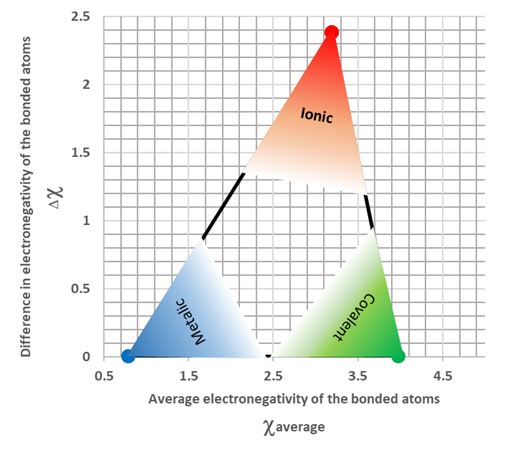
Метали, як правило, мають нижчу електронегативність, а неметали мають більш високу електронегативність. Коли різниця електронегативності між зв'язаними атомами велика, зазвичай більше 1,9, зв'язок іонна. Як правило, зв'язок між металом і неметалом є іонним. Коли різниця електронегативності низька, як правило, менше 1,9, зв'язок або металевий, або ковалентний. Неметали, як правило, утворюють ковалентний зв'язок один з одним. Неметали також мають більш високу електронегативність. Так, коли середня електронегативність зв'язаного атома висока і різниця електронегативності між ними низька, вони, як правило, утворюють ковалентний зв'язок. Метали, як правило, роблять металевий зв'язок один з одним. Метали також мають тенденцію мати нижчі значення електронегативності. Отже, коли середня електронегативність зв'язаного атома низька, а різниця електронегативності між ними також низька, вони, як правило, утворюють металевий зв'язок. Рис. 3.9.5 ілюструє критерії прогнозування типу хімічного зв'язку на основі різниці електронегативності. Майте на увазі, що немає різкої межі між металевими, іонними та ковалентними зв'язками на основі відмінностей електронегативності або середніх значень електронегативності.
Міжмолекулярні сили
Міжмолекулярні сили - це електростатичні взаємодії між молекулами. Міжмолекулярні сили зазвичай набагато слабкіше внутрішньомолекулярних сил, але все ж вони відіграють важливу роль у визначенні властивостей сполук. Основні міжмолекулярні сили включають дипольно-дипольну взаємодію, водневий зв'язок та лондонські сили дисперсії.
Дипольно-дипольні взаємодії
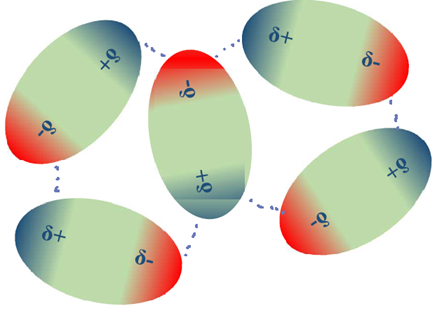
Полярні молекули мають постійні диполі, один кінець молекули частковий позитивний (Δ+), а інший - частковий негативний (δ-). Полярні молекули мають електростатичну взаємодію один з одним через свої Δ+ і δ- кінці, які називаються дипольно-дипольними взаємодіями, хоча ці взаємодії слабкіші, ніж іонні зв'язки. Полярні молекули орієнтуються таким чином, щоб максимізувати сили притягання між протилежними зарядами і мінімізувати сили відштовхування між тими ж зарядами, як показано на рис. 3.9.6.
водневі зв'язки
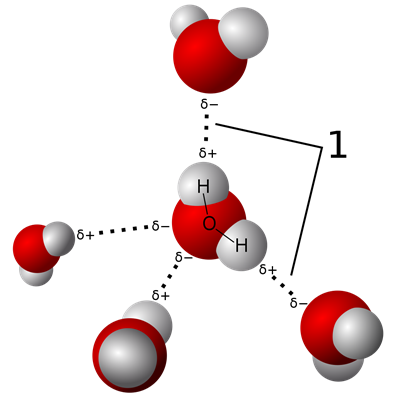
Водневий зв'язок - це дипольно-дипольна взаємодія, коли диполь є водневим зв'язком з O, N або F, наприклад, у молекулах води, як показано на рис. 3.9.7. Хоча водневий зв'язок є дипольно-дипольною взаємодією, він відрізняється від звичайних диполь-дипольних взаємодій через наступні особливості.
- Різниця електронегативності між H і O, N або F зазвичай більше, ніж інші полярні зв'язки.
- Щільність заряду на водні вище, ніж Δ+ кінців інших диполів через меншого розміру водню.
- Δ+ Водень може проникати в менш доступні простори, щоб взаємодіяти з δ- O, N або F іншої молекули через її невеликий розмір.
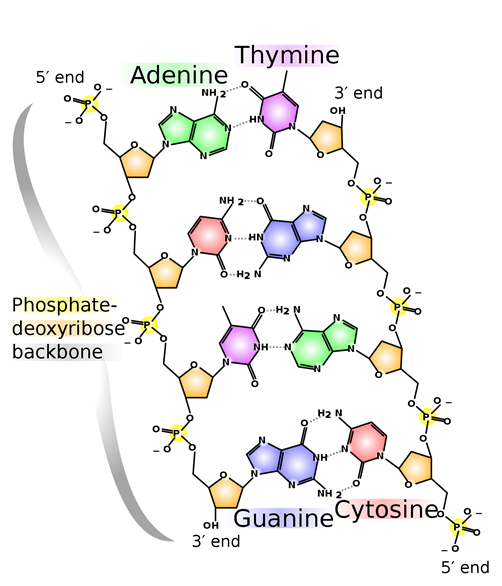
Водневий зв'язок, як правило, сильніше, ніж звичайні дипольно-дипольні взаємодії. Водневий зв'язок є найбільш поширеним і істотним міжмолекулярним взаємодією в біомолекулах. Наприклад, дві нитки молекул ДНК скріплюються разом за допомогою водневого зв'язку, як показано на рис. 3.9.8. Білки також набувають структурні особливості, необхідні для їх функцій головним чином за допомогою водневого зв'язку.
Лондон розсіювання сил
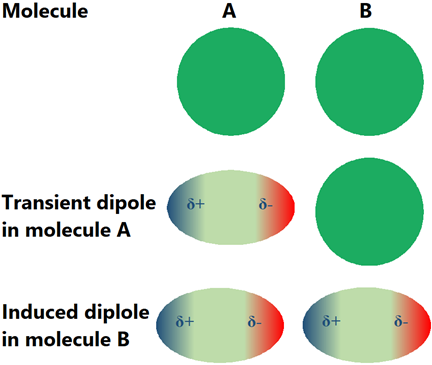
Може виявитися, що неполярні молекули не повинні мати міжмолекулярних взаємодій. Практично існують міжмолекулярні взаємодії, які називаються лондонськими силами дисперсії, у всіх молекулах, включаючи неполярні молекули. Електронна хмара навколо атомів не весь час симетрично навколо ядер. Він тимчасово гойдається в ту чи іншу сторону, генеруючи перехідний диполь. Перехідний диполь індукує диполь в сусідньому. Між сусідніми молекулами встановлюється транзиторна дипольно-індукована дипольна взаємодія, яка називається лондонською силою дисперсії або силою блукаючого Уолла, як показано на рис. 3.9.9. Хоча лондонські сили розсіювання є тимчасовими, вони продовжують з'являтися випадково розподіленими у просторі та часі. Лондонські сили дисперсії не є унікальними для неполярних молекул, вони присутні у всіх типах молекул, але це єдині внутрішньомолекулярні сили, присутні в неполярних молекулах.