3.8: Полярність молекул
- Page ID
- 25477
полярність атома
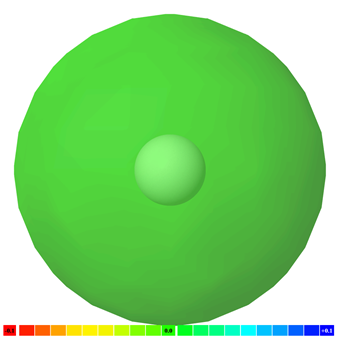
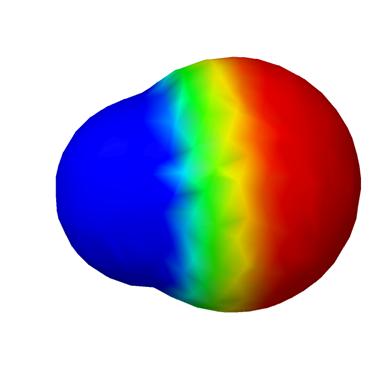
Негативний заряд електронів врівноважує позитивний заряд протонів в атомі. Електрони, симетрично розподілені навколо ядра, не залишають негативного або позитивного кінця. Атоми неполярні. Мал. 3.8.1 ілюструє полярність атома водню з колірними кодами.
Полярність ковалентного зв'язку
Коли атоми одного елемента об'єднуються, утворюючи ковалентний зв'язок, наприклад, H-H і F-F, позитивні і негативні заряди все ще симетричні, а зв'язок неполярний, тобто жоден негативний кінець не відокремлений від позитивного кінця. Однак, коли атоми різних елементів об'єднуються, утворюючи ковалентний зв'язок, тим більше електронегативний атом притягує зв'язкову електронну пару до себе сильніше, ніж інший атом. Поділ позитивних і негативних зарядів відбувається, коли електрони зміщуються більше в бік електронегативного атома. Зв'язок стає полярною з частково позитивним (Δ+) кінцем на електропозитивному атомі і частково негативним (δ-) кінцем на електронегативному атомі. Наприклад, фтор більш електронегативний, ніж водень. Отже, фтор тягне зв'язувальну електронну пару до себе в молекулі H-F, створюючи частковий негативний заряд (δ-) на фторі і частковий позитивний заряд (Δ+) на водні. H-F зв'язок полярна. Мал. 3.8.2 ілюструє полярність в H-F з колірними кодами.
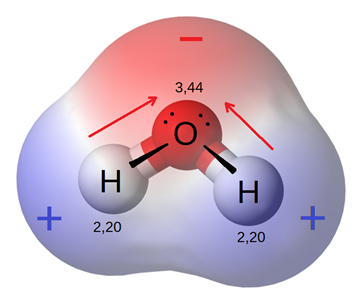
Полярність зв'язку - це вектор, який має величину і напрямок і може бути представлений стрілкою, як і інші вектори, як показано на рис. 3.8.3 для випадку молекули води.
Зв'язок класифікується як неполярний ковалентний, полярний ковалентний або іонний зв'язок на основі наступної конвенції: неполярний ковалентний, якщо електронегативна різниця зв'язкового атома менше 0,5, полярний ковалентний, якщо різниця електронегативності становить від 0,5 до 1,9, і іонний, якщо Різниця електронегативності більше 1,9.
Полярність молекули
Молекули потрапляють на наступні категорії, що стосуються молекулярної полярності.
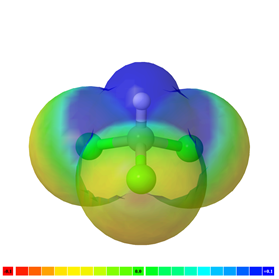
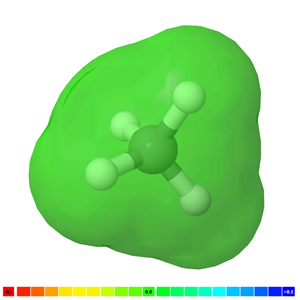
Молекула неполярна, якщо в ній немає полярного зв'язку, наприклад, H-H, F-F і CH 4 є неполярними молекулами. Рис. 3.8.4 ілюструє молекули СН 4 з електронними хмарами зеленого кольору, які представляють неполярну молекулу.
Якщо в молекулі є тільки одна полярна зв'язок, то молекула є полярною, наприклад, молекула H-F, показана на рис. 3.8.2.
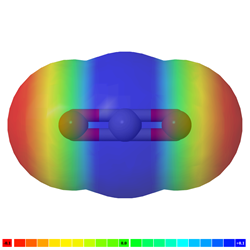
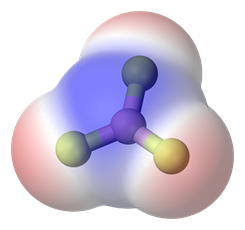
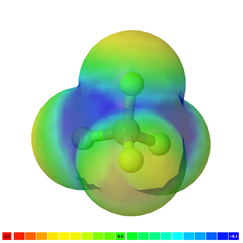
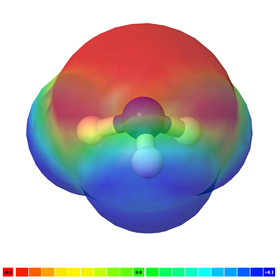
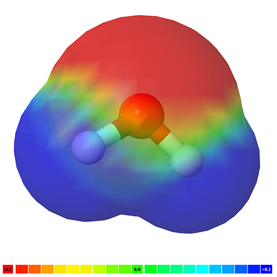
Якщо в молекулі є більше одного полярного зв'язку, молекула може бути полярною або може бути неполярною, залежно від симетрії молекули: а) Вектор полярності окремих зв'язків скасовується в симетричних молекулах, роблячи молекулу неполярною. Наприклад, симетричні молекули, такі як CO 2, BF 3 і cCl 4, є неполярними, хоча кожна зв'язок в них полярна. Рис. 3.8.5 ілюструє симетричні молекули, які мають полярні зв'язки, але полярність зв'язків скасовує один одного, роблячи молекулу неполярною. б) Якщо молекула має полярні зв'язки і вона не симетрична, вектори полярності не скасовуються, а молекула полярна. Приклади полярних молекул включають ChCl 3, NH 3 і H 2 O, як показано на рис. 3.8.6.