1.9: Тепло та зміни фізичних станів речовини
- Page ID
- 25474
Серед чотирьох фізичних станів речовини тверде тіло має найнижчу теплову енергію. Міжмолекулярні сили в твердих тілах сильні і не дають молекулам ковзати один за одного. Молекули і зв'язки в них все ще можуть мати коливальні рухи, які враховують вміст теплової енергії матеріалу.
Температура відображає вміст теплової енергії матеріалу - додавання тепла збільшує коливальні рухи, а температура збільшується. Зрештою, тверда речовина змінюється на рідину, а рідина змінюється на газову фазу, оскільки додається більше тепла, як показано на малюнку 1.9.1.
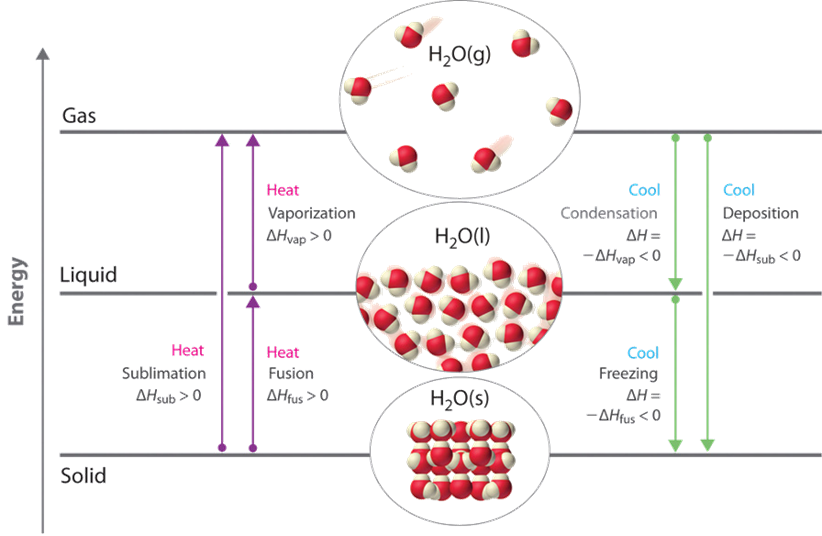
Плавлення і заморожування
Коли температура досягає температури плавлення твердого тіла при нагріванні, температура не збільшується далі, але продається поступово змінюється на рідку фазу. Тепло, додане при температурі плавлення, використовується для зміни частинок з добре розташованої форми в твердій речовині до нерегулярного розташування в рідкій фазі. Цей процес називається плавленням твердого тіла.
Енергія, необхідна для розплавлення одиниці кількості речовини, - це теплота плавлення (ΔH fus).
Теплота плавлення зазвичай виражається в одиницях джоулів на грам (\(\frac{J}{g}\)) для одиничної кількості в грамах або в джоулі на моль (\(\frac{J}{mol}\)) для одиниці кількості в молі.
Якщо тепло віддаляється від речовини при його температурі плавлення, відбувається зворотне плавлення, тобто замерзання, тобто рідина поступово переходить з рідкої на тверду фазу. Енергія, рівна теплоті плавлення, виділяється в процесі заморожування. На рис. 1.9.2 показані лід і вода при 0 о С —приклад танення і заморожування.

Випаровування і конденсація
Після плавлення додавання тепла викликає підвищення температури рідини до досягнення температури кипіння. Деякі молекули в рідині мають досить високу кінетичну енергію, щоб перетнути межу рідина-газ і стати газовою фазою. Цей процес називається пароутворенням.
Енергія, необхідна для випаровування одиниці кількості рідини, називається теплотою випаровування (ΔH вап).
Теплота пароутворення зазвичай виражається в одиницях джоулів на грам (\(\frac{J}{g}\)) для одиничної кількості в грамах або джоулів на моль (\(\frac{J}{mol}\)) для одиниці кількості в молі.
Зворотним випаровуванням називають конденсацію, яка виділяє тепло, рівне теплоті випаровування. На рис. 1.9.3 демонструється співіснування рідкого і газофазного брому при кімнатному помірному кліматі через одночасні процеси випаровування і конденсації.
Коли температура досягає температури кипіння рідини, температура не збільшується далі, але додане тепло використовується для випаровування рідини. Нагрівання підвищує температуру газової фази після того, як вся рідина змінилася на газову.

Сублімація і осадження
Тверда речовина може змінюватися безпосередньо в газову фазу, не проходячи через рідку фазу. Цей процес називається сублімацією.
Енергія, необхідна при сублімації (ΔH sub) - це додавання тепла плавлення та теплоти випаровування, тобто:
\[\Delta H_{\text {sub }}=\Delta H_{\text {fus}}+\Delta H_{\text {vap }}\nonumber\]
Зворотне сублімація називається осадженням, тобто газова фаза змінюється безпосередньо на тверду фазу. На рис. 1.8.4 показана сублімація кристалів йоду на гарячій плиті і осадження газу йоду на крижаний годинник скло.

Сублімація відповідає за сушіння білизни нижче 0 o C умов в холодних приміщеннях. Сублімація також використовується в сублімації овочів та інших продуктів харчування. Бактерії не можуть рости на сушених продуктах, оскільки їм потрібна певна волога, щоб рости. На рис. 1.9.5 показані термінології, пов'язані з фазовими змінами, описаними в попередніх пунктах.

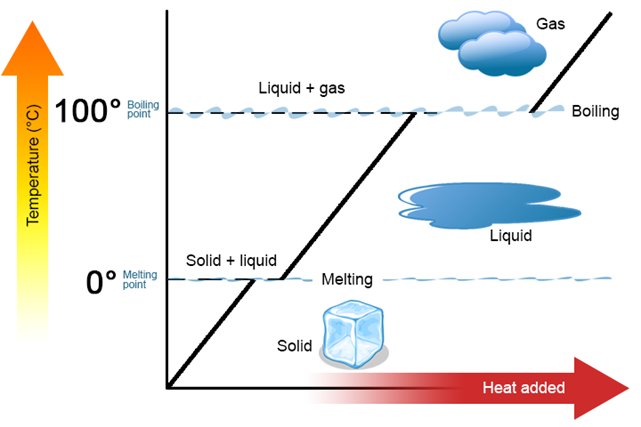
крива нагріву
Графічне представлення співвідношення доданого тепла проти зміни температури та фазових змін речовини називається кривою нагрівання.
На рис. 1.9.6 показана крива нагріву води. Крива показує спочатку нагрівання льоду, а потім співіснування твердої та рідини в точці звільнення, потім ненавидіння рідкої води, потім співіснування рідкої та газової фаз при температурі кипіння, і, нарешті, нагрівання пари - газова фаза води. Зворотна крива нагріву називається кривою охолодження.
Теплові розрахунки на кривих нагрівання або охолодження
Необхідну або виділену теплоту можна розрахувати за допомогою питомої теплоти твердої, рідкої та газової фаз речовини. Теплота плавлення потрібна в точці замерзання, а теплота випаровування потрібна при температурі кипіння речовини. Тепловий розрахунок пояснюється в наступному прикладі.
Розрахувати енергію, необхідну для нагрівання 10,0 г льоду від -20,0 o С до пари (водяної пари) при 110 о С?
Рішення
1-й крок —нагрівання льоду від -20,0 o С до температури плавлення льоду, т. Е. 0,00 о С:
м = 10,0 г, С з льоду = 2,06\(\frac{J}{g \cdot{ }^{\circ} \mathrm{C}}\), ΔT = 0,00 о С — (-20,0 о С) = 20,0 о С
\[\mathrm{q}_{1}=\mathrm{C}_{\mathrm{s}} \mathrm{m} \Delta \mathrm{T}=2.06 \frac{J}{g \cdot{ }^{\circ} \mathrm{C}}\times 10.0 \mathrm{~g} \times 20.0^{\circ} \mathrm{C}=412 \mathrm{~J}\nonumber\]
2-й етап — танення льоду, множення теплоти плавлення на кількість речовини:
м = 10,0 г, ΔН фус = 334\(\frac{J}{g}\).
\[\mathrm{q}_{2}=\Delta \mathrm{H}_{\text {fus }} \times \mathrm{m}=334\frac{J}{g}\ \times 10.0 \mathrm{~g}=3340 \mathrm{~J}\nonumber\]
3-й крок —нагрівання води від 0,00 до температури кипіння води, т. Е.
м = 10,0 г, С с рідкої води = 4,184\(\frac{J}{g \cdot{ }^{\circ} \mathrm{C}}\), ΔT = 100 о С — 0,00 о С = 100 о С
\[\mathrm{q}_{3}=\mathrm{C}_{\mathrm{s}} \mathrm{m} \Delta \mathrm{T}=4.184 \frac{J}{g \cdot{ }^{\circ} \mathrm{C}}\times 10.0 \mathrm{~g} \times 100^{\circ} \mathrm{C}=4180 \mathrm{~J}\nonumber\]
4-й етап — кип'ятіння рідкої води, помножте теплоту пароутворення на кількість речовини:
м = 10,0 г, ΔН вап = 2260\(\frac{J}{g}\)
\[\mathrm{q}_{4}=\Delta \mathrm{H}_{\text {vap }} \times \mathrm{m}=2260 \frac{J}{g}\ \times 10.0 \mathrm{~g}=22600 \mathrm{~J}\nonumber\]
5-й крок —нагрівання стебла від 100 до С до 110° С:
м = 10,0 г, С с пара = 2,00\(\frac{J}{g \cdot{ }^{\circ} \mathrm{C}}\), ΔT = 110 о С — 100 о С = 10,0 о С
\[\mathrm{q}_{5}=\mathrm{C}_{\mathrm{s}} \mathrm{m} \Delta \mathrm{T}=2.00\frac{J}{g \cdot{ }^{\circ} \mathrm{C}} \times 10.0 \mathrm{~g} \times 10.0^{\circ} \mathrm{C}=200 \mathrm{~J}\nonumber\]
Загальна необхідна теплота =\(q_{1}+q_{2}+q_{3}+q_{4}+q_{5}=412 \mathrm{~J}+3340 \mathrm{~J}+4180 \mathrm{~J}+22600 \mathrm{~J}+200 \mathrm{~J}=30700 \mathrm{~J}\)
\[30700 \mathrm{~J} \times \frac{1 \mathrm{~kJ}}{1000 \mathrm{~J}}=30.7 \mathrm{~kJ}\nonumber\]
Найбільш значна частина тепла витрачається на кип'ятіння води на пару, тобто 22,6 кДж з 30,7 кДж всього. Така ж кількість тепла виділяється при конденсації пара. Саме тому паровий опік набагато сильніше, ніж опік гарячою водою.
