14.13: Збір газу шляхом витіснення води
- Page ID
- 19714
Уявіть, що вам потрібно провести лабораторний експеримент, де утворюється водневий газ. Для того щоб розрахувати вихід газу, ви повинні знати тиск всередині трубки, де збирається газ. Але як ви можете отримати там барометр? Дуже просто—ви цього не робите. Все, що вам потрібно - це атмосферний тиск в приміщенні. Коли газ виштовхує воду, він штовхається проти атмосфери, тому тиск всередині дорівнює тиску назовні.
Збір газу шляхом витіснення води
Гази, які виробляються в лабораторних експериментах, часто збираються методом, званим витісненням води (див. Малюнок нижче). Пляшку наповнюють водою і поміщають догори дном в каструлю з водою. Реакційна колба оснащена гумовою трубкою, яка потім подається під пляшку з водою. Оскільки газ виробляється в реакційній колбі, він виходить через гумову трубку і витісняє воду в пляшці. Коли пляшка наповниться газом, її можна закрити кришкою.
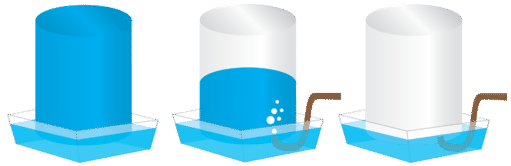
Оскільки газ збирається над водою, він не чистий, а змішується з парою від випаровування води. Закон Дальтона можна використовувати для розрахунку кількості потрібного газу шляхом віднімання внеску водяної пари:
\[\begin{array}{ll} P_\text{Total} = P_g + P_{H_2O} & P_g \: \text{is the pressure of the desired gas} \\ P_g = P_{Total} - P_{H_2O} & \end{array}\nonumber \]
Для того щоб вирішити проблему, необхідно знати тиск пари води при температурі реакції (див. Таблицю нижче). Вибіркова проблема ілюструє використання закону Далтона, коли газ збирається над водою.
| Таблиця\(\PageIndex{1}\): Тиск пари води\(\left( \text{mm} \: \ce{Hg} \right)\) при вибраних температурах\(\left( ^\text{o} \text{C} \right)\) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| \ (\ pageIndex {1}\): Тиск пари води\(\left( \text{mm} \: \ce{Hg} \right)\) при вибраних температурах\(\left( ^\text{o} \text{C} \right)\) «> 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
| \ (\ pageIndex {1}\): Тиск пари води\(\left( \text{mm} \: \ce{Hg} \right)\) при вибраних температурах\(\left( ^\text{o} \text{C} \right)\) «>4.58 | 6.54 | 9.21 | 12.79 | 17.54 | 23.76 | 31.82 | 42.18 | 55.32 | 71.88 | 92.51 | 118.04 | 149.38 |
Приклад\(\PageIndex{1}\)
Певний експеримент генерує\(2.58 \: \text{L}\) водневий газ, який збирається над водою. Температура є\(20^\text{o} \text{C}\) і атмосферний тиск є\(98.60 \: \text{kPa}\). Знайдіть обсяг, який буде займати сухий водень при STP.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- \(V_\text{Total} = 2.58 \: \text{L}\)
- \(T = 20^\text{o} \text{C} = 293 \: \text{K}\)
- \(P_\text{Total} = 98.60 \: \text{kPa} = 739.7 \: \text{mm} \: \ce{Hg}\)
Невідомий
Атмосферний тиск перетворюється з\(\text{kPa}\)\(\text{mm} \: \ce{Hg}\) в для того, щоб відповідати одиницям з таблицею. Сума тисків водню і водяної пари дорівнює атмосферному тиску. Тиск водню знаходять шляхом віднімання. Потім обсяг газу на СТП можна розрахувати, використовуючи комбінований закон газу.
Крок 2: Вирішіть.
\[P_{H_2} = P_\text{Total} - P_{H_2O} = 739.7 \: \text{mm} \: \ce{Hg} - 17.54 \: \text{mm} \: \ce{Hg} = 722.2 \: \text{mm} \: \ce{Hg}\nonumber \]
Зараз використовується комбінований закон газу, вирішуючи для\(V_2\), обсяг водню при СТП.
\[V_2 = \frac{P_1 \times V_1 \times T_2}{P_2 \times T_1} = \frac{722.2 \: \text{mm} \: \ce{Hg} \times 2.58 \: \text{L} \times 273 \: \text{K}}{760 \: \text{mm} \: \ce{Hg} \times 293 \: \text{K}} = 2.28 \: \text{L} \: \ce{H_2}\nonumber \]
Крок 3: Подумайте про свій результат.
Якби водневий газ повинен був збиратися на СТП і без присутності водяної пари, його обсяг був би\(2.28 \: \text{L}\). Це менше, ніж фактичний зібраний обсяг, оскільки деякі з них є водяною парою. Перетворення за допомогою STP корисно для цілей стехіометрії.
Резюме
- Гази, які виробляються в лабораторних експериментах, часто збираються методом, званим витісненням води.
- Тиск пари через воду в пробі можна скорегувати для того, щоб отримати справжнє значення тиску газу.