12.2: Коефіцієнти молів
- Page ID
- 18975
Для чого потрібен цей ганок?
Ви хочете додати деякі секції до ганку, як видно вище. Перед тим як відправитися в будівельний магазин за покупкою пиломатеріалів, потрібно визначитися зі складом агрегату (матеріал між двома великими стійками). Ви підраховуєте, скільки стовпів, скільки дощок, скільки рейок — тоді ви вирішуєте, скільки секцій ви хочете додати, перш ніж розрахувати кількість будівельного матеріалу, необхідного для розширення вашого ганку.
Коефіцієнти кротів
Проблеми стехіометрії можна охарактеризувати двома речами: (1) інформація, надана в проблемі, і (2) інформація, яка повинна бути вирішена, називається невідомою. Дане і невідоме можуть бути як реагентами, так і продуктами, або один може бути реагентом, а інший - продуктом. Кількість речовин може виражатися в родимках. Однак в лабораторній ситуації прийнято визначати кількість речовини, знаходячи його масу в грамах. Кількість газоподібної речовини може виражатися його обсягом. У цій концепції ми зупинимося на типі проблеми, де і дана, і невідома величини виражаються в молі.
Хімічні рівняння виражають кількість реагентів і продуктів в реакції. Коефіцієнти збалансованого рівняння можуть представляти або кількість молекул, або кількість молів кожної речовини. Виробництво аміаку\(\left( \ce{NH_3} \right)\) з азоту та водневих газів є важливою промисловою реакцією, яка називається процесом Хабера, на честь німецького хіміка Фріца Хабера.
\[\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\nonumber \]
Збалансоване рівняння можна проаналізувати кількома способами, як показано на малюнку нижче.
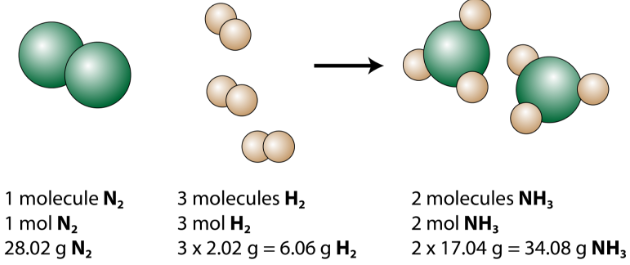
Ми бачимо, що 1 молекула азоту реагує з 3 молекулами водню, утворюючи 2 молекули аміаку. Це найменша можлива відносна кількість реагентів і продуктів. Щоб розглянути більші відносні суми, кожен коефіцієнт можна помножити на одне і те ж число. Наприклад, 10 молекул азоту вступали б у реакцію з 30 молекулами водню, утворюючи 20 молекул аміаку.
Найкорисніша кількість для підрахунку частинок - моль. Отже, якщо кожен коефіцієнт помножити на моль, збалансоване хімічне рівняння говорить нам, що 1 моль азоту реагує з 3 молями водню, утворюючи 2 молі аміаку. Це звичайний спосіб інтерпретації будь-якого збалансованого хімічного рівняння.
Нарешті, якщо кожна кількість моля перетворюється в грами за допомогою молярної маси, ми можемо побачити, що дотримується закон збереження маси. \(1 \: \ce{mol}\)азоту має масу\(28.02 \: \text{g}\), в той час як\(3 \: \text{mol}\) водню має масу\(6.06 \: \text{g}\), а\(2 \: \text{mol}\) аміаку має масу\(34.08 \: \text{g}\).
\[28.02 \: \text{g} \: \ce{N_2} + 6.06 \: \text{g} \: \ce{H_2} \rightarrow 34.08 \: \text{g} \: \ce{NH_3}\nonumber \]
Маса і кількість атомів повинні бути збережені в будь-якій хімічній реакції. Кількість молекул не обов'язково зберігається.

Мольний коефіцієнт - коефіцієнт перетворення, який пов'язує кількості в молі будь-яких двох речовин в хімічній реакції. Числа в коефіцієнті перетворення походять від коефіцієнтів збалансованого хімічного рівняння. Наступні шість мольних співвідношень можна записати для реакції утворення аміаку вище.
\[\begin{array}{ccc} \dfrac{1 \: \text{mol} \: \ce{N_2}}{3 \: \text{mol} \: \ce{H_2}} & or & \dfrac{3 \: \text{mol} \: \ce{H_2}}{1 \: \text{mol} \: \ce{N_2}} \\ \dfrac{1 \: \text{mol} \: \ce{N_2}}{2 \: \text{mol} \: \ce{NH_3}} & or & \dfrac{2 \: \text{mol} \: \ce{NH_3}}{1 \: \text{mol} \: \ce{N_2}} \\ \dfrac{3 \: \text{mol} \: \ce{H_2}}{2 \: \text{mol} \: \ce{NH_3}} & or & \dfrac{2 \: \text{mol} \: \ce{NH_3}}{3 \: \text{mol} \: \ce{H_2}} \end{array}\nonumber \]
У задачі мольного співвідношення спочатку пишеться дана речовина, виражена в родимках. Відповідний коефіцієнт перетворення вибирається для того, щоб перетворити з молів даної речовини в молі невідомого.
Приклад\(\PageIndex{1}\): Mole Ratio
Скільки утворюється моль аміаку, якщо 4,20 моля водню реагують з надлишком азоту?
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- дано: Н 2 = 4,20 моль
Невідомий
- моль NH 3
Перетворення відбувається від\(\text{mol} \: \ce{H_2}\) до\(\text{mol} \: \ce{NH_3}\). Проблема стверджує, що існує надлишок азоту, тому нам не потрібно турбуватися про будь-яке мольне співвідношення за участю\(\ce{N_2}\). Виберіть коефіцієнт перерахунку, який має\(\ce{NH_3}\) в чисельнику і\(\ce{H_2}\) в знаменник.
Крок 2: Вирішіть.
\[4.20 \: \text{mol} \: \ce{H_2} \times \dfrac{2 \: \text{mol} \: \ce{NH_3}}{3 \: \text{mol} \: \ce{H_2}} = 2.80 \: \text{mol} \: \ce{NH_3}\nonumber \]
Реакція\(4.20 \: \text{mol}\) водню з надлишком азоту виробляє\(2.80 \: \text{mol}\) аміак.
Крок 3: Подумайте про свій результат.
Результат відповідає співвідношенню водню до аміаку 3:2 з збалансованого рівняння.
Резюме
- Мольні співвідношення дозволяють порівнювати кількості будь-яких двох матеріалів у збалансованому рівнянні.
- Розрахунки можуть бути зроблені для прогнозування того, скільки продукту можна отримати з заданої кількості молів реагенту.
Рецензія
- Якщо реагенту надлишок, чому ми не турбуємось про співвідношення молів, що стосуються цього реагенту?
- Яке мольне співвідношення Н до N в молекулі аміаку?
- Формула етанолу - СН 3 СН 2 ОН. Яке мольне співвідношення Н до С в цій молекулі?
