12.7: обмежуючий реагент
- Page ID
- 18950
Хіба ви не ненавидите закінчуватися інгредієнтами для приготування їжі?
Кулінарія - прекрасний приклад побутової хімії. Для того щоб правильно слідувати рецепту, кулінару потрібно переконатися, що у нього є багато всіх необхідних інгредієнтів для того, щоб зробити свою страву. Припустимо, що ви вирішили зробити кілька млинців для великої групи людей. Рецепт на коробці вказує, що для кожної партії млинців потрібні наступні інгредієнти:
\(1\)чашка млинцевої суміші
\(\frac{3}{4}\)чашка молока
\(1\)яйце
\(1\)столова ложка рослинного масла
Тепер ви перевіряєте комору та холодильник і бачите, що у вас є такі інгредієнти:
2 коробки млинцевої суміші (8 склянок)
Половина галона молока (4 склянки)
2 яєць
Повна пляшка рослинного масла (близько 3 склянок)
Питання, яке ви повинні задати: скільки партій млинців я можу зробити? Відповідь - два. Незважаючи на те, що у вас достатньо суміші млинців, молока та олії, щоб зробити ще багато партій млинців, ви обмежені тим, що у вас є лише два яєчка. Як тільки ви зробили дві партії млинців, у вас залишиться яєць і ваша «реакція» буде повною.
обмежуючий реагент
Для хіміка збалансоване хімічне рівняння - це рецепт, якого потрібно дотримуватися. Як ви бачили раніше, процес Хабера - це реакція, в якій газ азоту поєднується з газом водню з утворенням аміаку. Збалансоване рівняння показано нижче.
\[\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\nonumber \]
Ми знаємо, що коефіцієнти збалансованого рівняння вказують на моль відношення, яке потрібно для виникнення цієї реакції. Одна родимка\(\ce{N_2}\) буде реагувати з трьома родимками\(\ce{H_2}\), щоб утворити дві родимки\(\ce{NH_3}\).
Тепер припустимо, що хімік повинен був реагувати три родимки\(\ce{N_2}\) з шістьма родимками\(\ce{H_2}\) (див. Малюнок нижче).
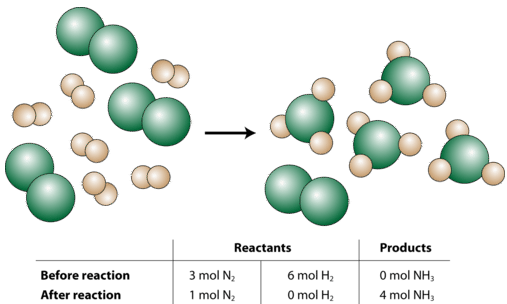
Так що ж сталося в цій реакції? Хімік почав з 3 родимок\(\ce{N_2}\). Ви можете подумати про це як 3 рази більше, ніж вимагає «рецепт» (збалансоване рівняння), оскільки коефіцієнт для 1.\(\ce{N_2}\) Однак 6 родимок, з\(\ce{H_2}\) яких почав хімік, всього в два рази більше, ніж того вимагає «рецепт», так як коефіцієнт для\(\ce{H_2}\) є 3 і\(3 \times 2 = 6\). Отже, після завершення реакції водневий газ буде повністю витрачений; тоді як залишиться 1 моль газу азоту. Нарешті, реакція дасть 4 молі,\(\ce{NH_3}\) тому що це також в два рази більше, ніж показано в збалансованому рівнянні. Загальна реакція, яка виникла на словах:
\[2 \: \text{mol} \: \ce{N_2} + 6 \: \text{mol} \: \ce{H_2} \rightarrow 4 \: \text{mol} \: \ce{NH_3}\nonumber \]
Всі суми подвоюються від вихідного збалансованого рівняння.
Граничним реагентом (або обмежуючим реагентом) є реагент, який визначає кількість продукту, який може утворитися в хімічній реакції. Реакція протікає до тих пір, поки граничний реагент не буде повністю витрачений. У нашому прикладі вище,\(\ce{H_2}\) це граничний реагент. Надлишок реагенту (або надлишок реагенту) - це реагент, який спочатку присутній у більшій кількості, ніж врешті-решт буде реагувати. Іншими словами, завжди залишається надлишок реагенту після завершення реакції. У наведеному вище прикладі\(\ce{N_2}\) це надлишок реагенту.
Резюме
- Кількість граничного реагенту визначає, скільки продукту буде утворюватися в хімічній реакції.
Рецензія
- У реакції Хабера, проілюстрованої вище, як ми знаємо, що водень є обмежуючим реагентом?
- Що робити, якщо водень залишився?
- Який матеріал був би обмежувальним, якби не залишилося водню чи азоту?
