11.3: рівняння балансування
- Page ID
- 19098
Будь-які залишки?
Коли ви готуєте їжу, досить часто є залишки, тому що ви підготували більше, ніж люди їли б за один присід. Іноді, коли ви ремонтуєте частину обладнання, ви закінчуєте тим, що називаються «кишеньковими частинами» - невеликими шматочками, які ви кладете в кишеню, тому що не впевнені, де вони належать. Хімія намагається уникати залишків і кишенькових деталей. У звичайних хімічних процесах ми не можемо створити або знищити речовину (закон збереження маси). Якщо ми почнемо з десяти атомів вуглецю, нам потрібно закінчити з десятьма атомами вуглецю. Атомна теорія Джона Далтона говорила, що хімічні реакції в основному передбачають перестановку атомів. Хімічні рівняння повинні слідувати цим принципам, щоб бути правильними.
Балансування хімічних рівнянь
Збалансоване рівняння - це хімічне рівняння, в якому маса зберігається і є рівні числа атомів кожного елемента по обидва боки рівняння. Ми можемо написати хімічне рівняння реакції вуглецю з газом водню з утворенням метану\(\left( \ce{CH_4} \right)\):
\[\begin{array}{ccccc} \ce{C} \left( s \right) & + & \ce{H_2} \left( g \right) & \rightarrow & \ce{CH_4} \left( g \right) \\ 2 \: \ce{C} \: \text{atoms} & & 2 \: \ce{H} \: \text{atoms} & & 1 \: \ce{C} \: \text{atom,} \: 4 \: \ce{H} \: \text{atoms} \end{array}\nonumber \]
Для того щоб написати правильне рівняння, необхідно спочатку написати правильне рівняння скелета з правильними хімічними формулами. Нагадаємо, що водень - це двоатомна молекула і так пишеться як\(\ce{H_2}\).
Коли ми підраховуємо кількість атомів обох елементів, показаних під рівнянням, ми бачимо, що рівняння не збалансоване. На реактивній стороні рівняння є лише 2 атоми водню, тоді як на стороні продукту є 4 атоми водню. Ми можемо збалансувати вищевказане рівняння, додавши коефіцієнт 2 перед формулою для водню.
\[\ce{C} \left( s \right) + 2 \ce{H_2} \left( g \right) \rightarrow \ce{CH_4} \left( g \right)\nonumber \]
Коефіцієнт - це невелике ціле число, розміщене перед формулою в рівнянні для того, щоб збалансувати його. 2 перед\(\ce{H_2}\) означає, що є загальна кількість\(2 \times 2 = 4\) атомів водню в якості реагентів. Візуально реакція виглядає як на малюнку нижче.
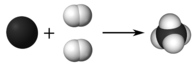
У збалансованому рівнянні є один атом вуглецю і чотири атома водню по обидва боки стрілки. Нижче наведені рекомендації щодо написання та балансування хімічних рівнянь.
- Визначте правильні хімічні формули для кожного реагенту і продукту.
- Напишіть рівняння скелета.
- Підрахуйте кількість атомів кожного елемента, який виступає як реагент і як продукт. Якщо багатоатомний іон незмінний з обох сторін рівняння, порахуйте його як одиницю.
- Збалансуйте кожен елемент по одному, розміщуючи коефіцієнти перед формулами.
- Найкраще почати з балансування елементів, які фігурують лише в одній хімічній формулі з кожного боку рівняння.
- Коефіцієнт не записується для 1.
- НІКОЛИ не змінюйте індекси в хімічній формулі - ви можете збалансувати рівняння лише за допомогою коефіцієнтів.
- Перевірте кожен атом або багатоатомний іон, щоб переконатися, що вони рівні з обох сторін рівняння.
- Переконайтеся, що всі коефіцієнти знаходяться в мінімально можливому співвідношенні. При необхідності зменшіть до найнижчого співвідношення.
Приклад\(\PageIndex{1}\): Balancing Chemical Equations
Змішують водні розчини свинцю (II) нітрату і хлориду натрію. Продукти реакції - водний розчин нітрату натрію і твердий осад хлориду свинцю (II). Напишіть збалансоване хімічне рівняння для цієї реакції.
Рішення
Крок 1: Плануйте проблему.
Виконайте кроки для написання та балансування хімічного рівняння, переліченого в тексті.
Крок 2: Вирішіть.
Напишіть рівняння скелета з правильними формулами.
\[\ce{Pb(NO_3)_2} \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{PbCl_2} \left( s \right)\nonumber \]
Підрахуйте кількість кожного атома або багатоатомного іона по обидва боки рівняння.
\[\begin{array}{ll} \textbf{Reactants} & \textbf{Products} \\ 1 \: \ce{Pb} \: \text{atom} & 1 \: \ce{Pb} \: \text{atom} \\ 2 \: \ce{NO_3^-} \: \text{ions} & 1 \: \ce{NO_3^-} \: \text{ions} \\ 1 \: \ce{Na} \: \text{atom} & 1 \: \ce{Na} \: \text{atom} \\ 1 \: \ce{Cl} \: \text{atom} & 2 \: \ce{Cl} \: \text{atoms} \end{array}\nonumber \]
Нітратні іони та атоми хлору незбалансовані. Почніть з розміщення 2 перед\(\ce{NaCl}\). Це збільшує кількість реагентів до 2\(\ce{Na}\) атомів і 2\(\ce{Cl}\) атомів. Потім помістіть 2 перед\(\ce{NaNO_3}\). В результаті виходить:
\[\ce{Pb(NO_3)_2} \left( aq \right) + 2 \ce{NaCl} \left( aq \right) \rightarrow 2 \ce{NaNO_3} \left( aq \right) + \ce{PbCl_2} \left( s \right)\nonumber \]
Новий підрахунок для кожного атома і багатоатомного іона стає:
\[\begin{array}{ll} \textbf{Reactants} & \textbf{Products} \\ 1 \: \ce{Pb} \: \text{atom} & 1 \: \ce{Pb} \: \text{atom} \\ 2 \: \ce{NO_3^-} \: \text{ions} & 2 \: \ce{NO_3^-} \: \text{ions} \\ 2 \: \ce{Na} \: \text{atom} & 2 \: \ce{Na} \: \text{atom} \\ 2 \: \ce{Cl} \: \text{atom} & 2 \: \ce{Cl} \: \text{atoms} \end{array}\nonumber \]
Крок 3: Подумайте про свій результат.
Рівняння тепер збалансоване, оскільки по обидва боки рівняння є однакові числа атомів кожного елемента.
Практика балансування хімічних рівнянь за допомогою цього моделювання:
Резюме
- Описано процес балансування хімічних рівнянь.
Рецензія
- Що таке закон збереження маси?
- Як Далтон описав процес хімічної реакції?
- Чому б нам не змінити індекси, щоб збалансувати рівняння?
