10.13: Визначення молекулярних формул
- Page ID
- 19700

Джерело: http://commons.wikimedia.org/wiki/File:D-glucose-chain-2D-Fischer.png(opens у новому вікні); http://commons.wikimedia.org/wiki/File:Ethylene-CRC-MW-3D-balls.png(opens у новому вікні)
Ліцензія: Суспільне надбання) (Право: Кредит: Користувач:глікоформ/Вікісховище; Бен Міллс (Вікімедіа: Benjah-BM27); Джерело: http://commons.wikimedia.org/wiki/File:Sucrose_3Dprojection.png(opens у новому вікні); http://commons.wikimedia.org/wiki/File:Ethylene-CRC-MW-3D-balls.png(opens у новому window); Ліцензія: суспільне надбання)
Як можна визначити відмінності між цими двома молекулами?
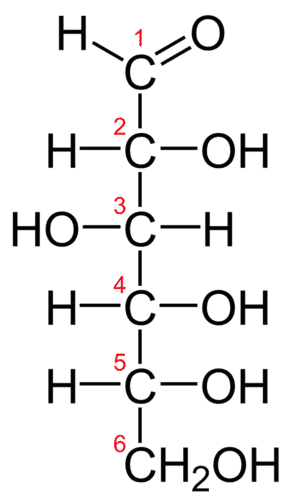
Вище ми бачимо два вуглеводи: глюкозу і сахарозу. Сахароза майже рівно вдвічі перевищує розмір глюкози, хоча їх емпіричні формули дуже схожі. Деякі люди могли відрізнити їх за смаком, але це не дуже гарна ідея, щоб ходити навколо дегустації хімікатів. Найкращий спосіб - визначити молекулярні ваги - такий підхід дозволяє легко визначити, яка сполука яка.
Молекулярні формули
Молекулярні формули дають вид і кількість атомів кожного елемента, присутнього в молекулярній сполуці. У багатьох випадках молекулярна формула така ж, як емпірична формула. Молекулярна формула метану є\(\ce{CH_4}\) і тому, що вона містить лише один атом вуглецю, це також його емпірична формула. Іноді, однак, молекулярна формула являє собою просте ціле число, кратне емпіричній формулі. Оцтова кислота - це органічна кислота, яка є основним компонентом оцту. Молекулярна формула його є\(\ce{C_2H_4O_2}\). Глюкоза - це простий цукор, який клітини використовують як первинне джерело енергії. Молекулярна формула його є\(\ce{C_6H_{12}O_6}\). Структури обох молекул показані на малюнку нижче. Вони дуже різні сполуки, але обидва мають однакову емпіричну формулу\(\ce{CH_2O}\).

Емпіричні формули можна визначити за процентним складом того чи іншого з'єднання. Для того щоб визначити його молекулярну формулу, необхідно знати молярну масу з'єднання. Хіміки використовують прилад під назвою мас-спектрометр для визначення молярної маси сполук. Для того щоб перейти від емпіричної формули до молекулярної формули, виконайте наступні дії:
- Обчисліть емпіричну формулу маси (ЕФМ), яка є просто молярною масою, представленою емпіричною формулою.
- Розділіть молярну масу з'єднання на емпіричну формулу маси. В результаті повинно вийти ціле число або дуже близьке до цілого числа.
- Помножте всі індекси в емпіричній формулі на ціле число, знайдене на кроці 2. В результаті виходить молекулярна формула.
Приклад\(\PageIndex{1}\): Determining the Molecular Formula of a Compound
Емпірична формула з'єднання бору і водню є\(\ce{BH_3}\). Його молярна маса є\(27.7 \: \text{g/mol}\). Визначте молекулярну формулу з'єднання.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- Емпірична формула\(= \ce{BH_3}\)
- Молярна маса\(= 27.7 \: \text{g/mol}\)
Невідомий
- молекулярна формула =?
Кроки, які слід виконати, викладені в тексті.
Крок 2: Розрахуйте.
\[\text{Empirical formula mass (EFM)} = 13.84 \: \text{g/mol}\nonumber \]
\[\frac{\text{molar mass}}{\text{EFM}} = \frac{17.7}{13.84} = 2\nonumber \]
\[\ce{BH_3} \times 2 = \ce{B_2H_6}\nonumber \]
Молекулярна формула з'єднання є\(\ce{B_2H_6}\).
Крок 3: Подумайте про свій результат.
Молярна маса молекулярної формули відповідає молярній масі з'єднання.
Резюме
- Описана процедура розрахунку точної молекулярної формули сполуки.
Рецензія
- У чому різниця між емпіричною формулою і молекулярною формулою?
- Крім елементного аналізу, що потрібно знати, щоб розрахувати молекулярну формулу?
- Про що говорить емпірична формула маси?