10.12: Визначення емпіричних формул
- Page ID
- 19708

Що ж відбувається на цій картині?
У перші дні хімії було мало доступних інструментів для детального вивчення сполук. Значна частина інформації щодо складу сполук надійшла від елементного аналізу неорганічних матеріалів. «Нова» область органічної хімії (вивчення вуглецевих сполук) зіткнулася з проблемою неможливості охарактеризувати сполуку повністю. Відносні кількості елементів можна було визначити, але багато з цих матеріалів мали вуглець, водень, кисень і, можливо, азот у простих співвідношеннях. Хіміки не мали можливості визначити точні кількості цих атомів, які містилися в конкретних молекулах.
Визначення емпіричних формул
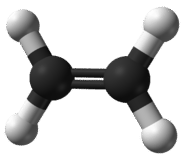
Емпірична формула - це та, яка показує найнижче співвідношення цілого числа елементів у сполуці. Оскільки структура іонних сполук являє собою розширену тривимірну мережу позитивних і негативних іонів, всі формули іонних сполук є емпіричними. Однак можна розглянути і емпіричну формулу молекулярної сполуки. Етен - невелике вуглеводневе з'єднання з формулою\(\ce{C_2H_4}\) (див. Малюнок нижче). Хоча\(\ce{C_2H_4}\) це його молекулярна формула і представляє його справжню молекулярну структуру, вона має емпіричну формулу\(\ce{CH_2}\). Найпростіше співвідношення вуглецю до водню в етені - 1:2. Існує два способи перегляду цього співвідношення. З огляду на одну молекулу етена, співвідношення становить 1 атом вуглецю на кожні 2 атома водню. З огляду на один моль етена, співвідношення становить 1 моль вуглецю на кожні 2 молі водню. Отже, індекси у формулі представляють мольне співвідношення елементів у цій формулі.
У процедурі, яка називається елементним аналізом, невідому сполуку можна проаналізувати в лабораторії, щоб визначити відсотки кожного елемента, що міститься в ньому. Ці відсотки можуть трансформуватися в моль співвідношення елементів, що призводить до емпіричної формули. Кроки, які слід вжити, викладені нижче.
- Припустимо\(100 \: \text{g}\) зразок з'єднання, щоб дані відсотки могли бути безпосередньо перетворені в грами.
- Використовуйте молярну масу кожного елемента, щоб перетворити грами кожного елемента в молі.
- Для того щоб знайти співвідношення ціле число, розділіть родимки кожного елемента на той, який з родимок з кроку 2 є найменшим.
- Якщо всі родимки в цій точці є цілими числами (або дуже близькими), емпіричну формулу можна записати з молями як індексом кожного елемента.
- У деяких випадках один або кілька родимок, розрахованих на кроці 3, не будуть цілими числами. Помножте кожну з родимок на найменше ціле число, яке перетворить кожну в ціле число. Напишіть емпіричну формулу.
Приклад\(\PageIndex{1}\): Determining the Empirical Formula of a Compound
З'єднання заліза та кисню проаналізовано та встановлено, що містить\(69.94\%\) залізо та\(30.06\%\) кисень. Знайдіть емпіричну формулу з'єднання.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- \(\%\)з\(\ce{Fe} = 69.94\%\)
- \(\%\)з\(\ce{O} = 30.06\%\)
Невідомий
- Імперіальна формула = Fe? О?
Кроки, які слід виконати, викладені в тексті.
Крок 2: Розрахуйте.
1. Припустимо\(100 \: \text{g}\) зразок.
\[69.94 \: \text{g} \: \ce{Fe}\nonumber \]
\[30.06 \: \text{g} \: \ce{O}\nonumber \]
2. Перетворити в родимки.
\[69.94 \: \text{g} \: \ce{Fe} \times \frac{1 \: \text{mol} \: \ce{Fe}}{55.85 \: \text{g} \: \ce{Fe}} = 1.252 \: \text{mol} \: \ce{Fe}\nonumber \]
\[30.06 \: \text{g} \: \ce{O} \times \frac{1 \: \text{mol} \: \ce{O}}{16.00 \: \text{g} \: \ce{O}} = 1.879 \: \text{mol} \: \ce{O}\nonumber \]
3. Розділіть обидві родимки на найменший з результатів.
\[\frac{1.252 \: \text{mol} \: \ce{Fe}}{1.252} = 1 \: \text{mol} \: \ce{Fe} \: \: \: \: \: \frac{1.879 \: \text{mol} \: \ce{O}}{1.252} = 1.501 \: \text{mol} \ce{O}\nonumber \]
4/5. Так як родимок\(\ce{O}\) ще не ціле число, обидві родимки можна помножити на 2, при цьому округляючи до цілого числа.
\[1 \: \text{mol} \: \ce{Fe} \times 2 = 2 \: \text{mol} \: \ce{Fe} \: \: \: \: \: 1.501 \: \text{mol} \: \ce{O} \times 2 = 3 \: \text{mol} \: \ce{O}\nonumber \]
Емпірична формула з'єднання є\(\ce{Fe_2O_3}\).
Крок 3: Подумайте про свій результат.
Індекси є цілими числами і являють собою моль співвідношення елементів в з'єднанні. З'єднання являє собою іонну сполуку оксиду заліза (III).
Резюме
- Описано процес розрахунку емпіричної формули для сполуки на основі процентного складу цієї сполуки.
Рецензія
- Що таке емпірична формула?
- Що вам говорить емпірична формула?
- Про що це вам не говорить?