10.6: Гіпотеза Авогадро та молярний об'єм
- Page ID
- 19707
Як аквалангісти знають, якщо у них закінчиться газ?
Знаючи, скільки газу є для занурення має вирішальне значення для виживання дайвера. Резервуар на спині водолаза оснащений манометрами, щоб вказати, скільки газу присутній і який тиск. Базові знання поведінки газу дозволяють дайверу оцінити, як довго вони можуть залишатися під водою, не розвиваючи проблем.
Гіпотеза Авогадро та молярний об'єм
Обсяг - це третій спосіб вимірювання кількості речовини, після пункту підрахунку та маси. З рідинами і твердими речовинами обсяг сильно варіюється в залежності від щільності речовини. Це пов'язано з тим, що тверді та рідкі частинки упаковані близько один до одного з дуже невеликим простором між частинками. Однак гази значною мірою складаються з порожніх просторів між фактичними частинками газу (див. Малюнок нижче).

У 1811 році Амадео Авогадро пояснив, що обсяги всіх газів можна легко визначити. Гіпотеза Авогадро стверджує, що рівні обсяги всіх газів при однаковій температурі і тиску містять однакову кількість частинок. Оскільки загальний обсяг, який займає газ, складається насамперед з порожнього простору між частинками, фактичний розмір самих частинок майже незначний. Заданий обсяг газу з дрібними легкими частинками, такими як водень\(\left( \ce{H_2} \right)\), містить таку ж кількість частинок, як і той же обсяг важкого газу з великими частинками, такими як гексафторид сірки,\(\ce{SF_6}\).
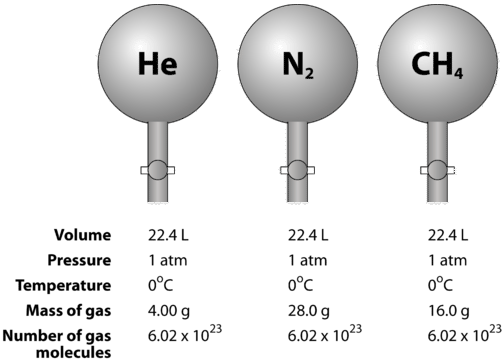
Гази стисливі, а це означає, що при впливі під високим тиском частинки змушуються ближче один до одного. Це зменшує кількість порожнього простору і зменшує обсяг газу. На обсяг газу також впливає температура. Коли газ нагрівається, його молекули рухаються швидше, а газ розширюється. Через зміну обсягу газу через зміни тиску та температури порівняння обсягів газу повинно проводитися при стандартній температурі та тиску. Стандартна температура і тиск (STP) визначається як\(0^\text{o} \text{C}\)\(\left( 273.15 \: \text{K} \right)\) і\(1 \: \text{atm}\) тиск. Молярний об'єм газу - це обсяг одного моля газу при STP. При СТП один моль (\( 6.02 \times 10^{23}\)представницькі частинки) будь-якого газу займає обсяг\(22.4 \: \text{L}\) (малюнок нижче).

На малюнку нижче показано, як можна побачити молярний об'єм при порівнянні різних газів. Зразки гелію\(\left( \ce{He} \right)\)\(\left( \ce{N_2} \right)\), азоту та метану\(\left( \ce{CH_4} \right)\) знаходяться на STP. Кожен містить 1 моль або\(6.02 \times 10^{23}\) частинки. Однак маса кожного газу різна і відповідає молярній масі цього газу:\(4.00 \: \text{g/mol}\) for\(\ce{He}\),\(28.0 \: \text{g/mol}\) for\(\ce{N_2}\), і\(16.0 \: \text{g/mol}\) for\(\ce{CH_4}\).
Резюме
- Рівні обсяги газів при однакових умовах містять однакову кількість частинок.
- Стандартна температура і тиск скорочено (STP).
- Стандартна температура становить 0° C (273,15 K), а стандартний тиск - 1 атм.
- При СТП один моль будь-якого газу займає обсяг 22,4 л
Рецензія
- Ємність заповнена газом, що ми знаємо про простір, який насправді займає газ?
- Навіщо нам робити всі наші порівняння при однаковій температурі і тиску?
- При стандартній температурі і тиску 1 моль газу завжди дорівнює скільки літрів?
