9.24: Сигма і Пі облігації
Як ви думаєте, скільки людей вичавлено на цій вулиці?
Наш розум може обробляти два електрони, що взаємодіють один з одним у сфері простору. Але потім ми починаємо ставити подвійні облігації і потрійні облігації. Те, як ми малюємо ці зв'язки на папері, говорить про те, що ми стискаємо більше електронів у той самий простір, і це не працює. Електрони не люблять, щоб їх штовхали разом (тим більше, що всі вони мають негативні заряди, які відштовхують один одного). Тому нам потрібна більш складна картина, яка працює для всіх цих електронів.
Сигма і Пі облігації
Модель гібридизації допомагає пояснити молекули з подвійними або потрійними зв'язками (див. Малюнок нижче). Етен\left( \ce{C_2H_4} \right) містить подвійний ковалентний зв'язок між двома атомами вуглецю та поодинокі зв'язки між атомами вуглецю та атомами водню. Вся молекула плоска.
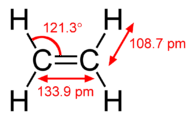
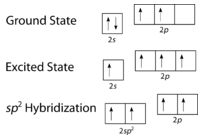
Як видно на малюнку нижче, геометрія електронного домену навколо кожного вуглецю незалежно є тригональною плоскою. Це відповідаєsp^2 гібридизації. Раніше ми бачили, як вуглець піддаєтьсяsp^3 гібридизації в\ce{CH_4} молекулі, тому просування електронів однакове для етена, але гібридизація відбувається лише між єдиноюs орбітою та двома з трьохp орбіталів. Це породжує набір з трьохsp^2 гібридів разом з негібридизованою2p_z орбіталлю. Кожен містить один електрон і таким чином здатний утворювати ковалентний зв'язок.
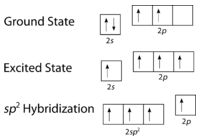
Триsp^2 гібридні орбіталі лежать в одній площині, тоді як негібридизована2p_z орбітальна орієнтована перпендикулярно цій площині. \ce{C_2H_4}Зв'язка пояснюється наступним чином: один з трьохsp^2 гібридів утворює зв'язок шляхом перекриття з ідентичною гібридною орбіталлю на іншому атомі вуглецю. Решта дві гібридні орбіталі утворюють зв'язки шляхом перекриття з1s орбіталлю атома водню. Нарешті,2p_z орбіталі на кожному атомі вуглецю утворюють інший зв'язок, перекриваючи один з одним збоку.
Необхідно розрізняти два типи ковалентних зв'язків в\ce{C_2H_4} молекулі. Сигма-зв'язок (\sigmaзв'язок) - це зв'язок, утворений перекриттям орбіталів наскрізним способом, при цьому електронна щільність зосереджена між ядрами атомів зв'язку. Пі зв'язок (\piзв'язок) - це зв'язок, утворений перекриттям орбіталів пліч-о-пліч з електронною щільністю, зосередженою вище і нижче площини ядер атомів зв'язку. На малюнку нижче показані два типи склеювання в\ce{C_2H_4}. sp^2Гібридні орбіталі фіолетові, аp_z орбітальні - блакитні. З кожного атома вуглецю утворюються три сигма-зв'язки в цілому шість сигма-зв'язків в молекулі. Пі зв'язок - це «друга» зв'язок подвійних зв'язків між атомами вуглецю і показана у вигляді подовженої зеленої частки, яка простягається як над, так і під площиною молекули. Ця площина містить шість атомів і всі сигма-зв'язки.
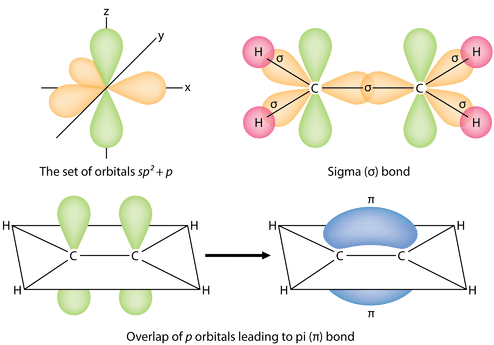
У звичайній електронно-точковій структурі Льюїса подвійний зв'язок показаний у вигляді подвійного тире між атомами, як в\ce{C=C}. Важливо усвідомити, однак, що дві зв'язки різні: одна є сигма-зв'язком, а інша - зв'язком пі.
Етин\left( \ce{C_2H_2} \right) - лінійна молекула з потрійним зв'язком між двома атомами вуглецю (див. Малюнок нижче). Таким чином, гібридизація єsp.
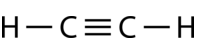
Просування електрона в атомі вуглецю відбувається таким же чином. Однак гібридизація тепер включає лише2s орбітальну та2p_x орбітальну, залишаючи2p_y і2p_z орбіталі негібридизованими.
spГібридні орбіталі утворюють сигма-зв'язок між собою, а також сигма-зв'язки з атомами водню. Обидваp_y іp_z орбіталі на кожному атомі вуглецю утворюють pi зв'язки між собою. Як і у випадку з етином, ці збоку в бік перекриття знаходяться вище і нижче площини молекули. Орієнтація двох pi зв'язків полягає в тому, що вони перпендикулярні один одному (див. Малюнок нижче). Один pi зв'язок знаходиться вище і нижче лінії молекули, як показано, в той час як інший знаходиться перед і позаду сторінки.
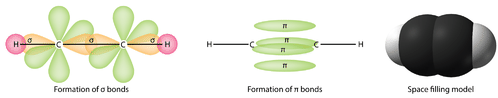
Взагалі поодинокі зв'язки між атомами завжди є сигма-зв'язками. Подвійні облігації складаються з однієї сигми та однієї пі зв'язку. Потрійні облігації складаються з однієї сигма-зв'язку та двох облігацій пі.
Резюме
- Сигматичні зв'язки утворюються між двома атомами.
- Пі зв'язки утворюються з p орбітального перекриття.
Рецензія
- Що таке гібридизація навколо кожного вуглецю в етені?
- Які два типи облігацій в C = C?
- Яка форма молекули етена?
- Як орієнтовані етинові пі зв'язки по відношенню один до одного?
