9.21: Теорія валентних зв'язків
- Page ID
- 19130
Що буде далі?
Ми бачили, що стара ідея «риб'ячий гачок» атомів, які так сподобалися Демокріту, просто не працює. Електрони не мають маленьких гачків на них, але вони є основою для з'єднання атомів з утворенням молекул. Ви навчилися писати електронно-точкові структури Льюїса для молекул і прогнозувати їх форму за допомогою теорії VSEPR. Тепер настав час застосувати ці здібності, щоб зрозуміти, як поводяться електрони на своїх атомних орбіталах, коли утворюється ковалентний зв'язок.
Теорія валентних зв'язків
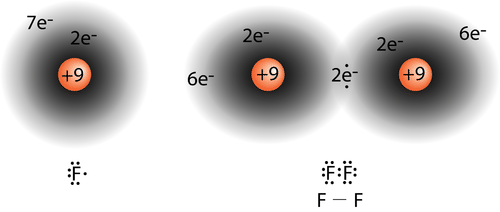
Ви дізналися, що ковалентний зв'язок утворюється, коли електронні хмари двох атомів перекривають один одного. У простій\(\ce{H_2}\) молекулі єдиний електрон у кожному атомі притягується до ядра іншого атома в молекулі, коли атоми зближуються. Оптимальна відстань, рівна довжині зв'язку, в кінцевому підсумку досягається, а потенційна енергія досягає мінімуму. Між двома атомами водню утворилася стабільна одиночна ковалентна зв'язок. Інші ковалентні зв'язки утворюються так само, як і непарні електрони, коли два атома «збігаються», утворюючи зв'язок. В атомі фтору в одній з\(2p\) орбіталей є непарний електрон. Коли\(\ce{F_2}\) молекула утворюється,\(2p\) орбіталі кожного з двох атомів перекриваються, утворюючи\(\ce{F-F}\) ковалентний зв'язок. Орбіталі, що перекриваються, не обов'язково повинні бути одного типу. У молекулі\(\ce{HF}\),\(1s\) орбіталь атома водню перекривається з\(2p\) орбітою\(2p\) орбіти атома фтору (див. Малюнок нижче).
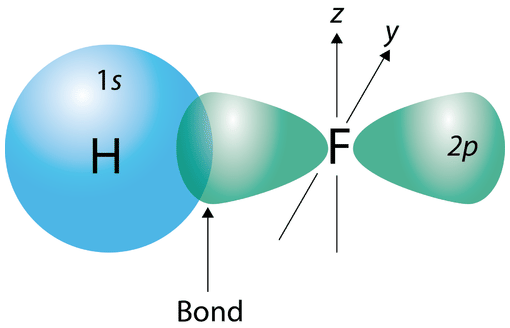
По суті, будь-яка ковалентна зв'язок виникає в результаті перекриття атомних орбіталей. Ця ідея лежить в основі квантової механічної теорії, яка називається теорією валентних зв'язків (VB). У теорії валентних зв'язків передбачається, що електрони в молекулі займають атомні орбіталі окремих атомів, і зв'язок виникає внаслідок перекриття цих орбіталів.
Резюме
- Електрони займають атомні орбіталі.
- Ковалентні зв'язки виникають внаслідок перекриття атомних орбіталей.
Рецензія
- Де знаходяться електрони відповідно до теорії валентних зв'язків?
- Як утворюються ковалентні зв'язки?
- Чи повинні орбіталі двох електронів, що беруть участь у зв'язку, повинні бути однаковими?