9.22: Гібридні орбіталі - sp³
Ви впізнаєте цю рослину?
Якби ми гуляли по пляжу, рослини, показані вище, виглядали б зовсім інакше. Вони були б короткими і стирчать з піску. Коли ми бачимо їх таким чином, ми можемо не відразу визнати їх пляжними рослинами. Часто нам потрібно по-різному дивитися на навколишній світ, щоб краще зрозуміти речі.
Гібридні орбіталі - sp 3
Схема зв'язку, описана теорією валентних зв'язків, повинна враховувати молекулярні геометрії, як передбачено теорією VSEPR. Для цього ми повинні ввести поняття гібридних орбіталів.
sp3гібридизація
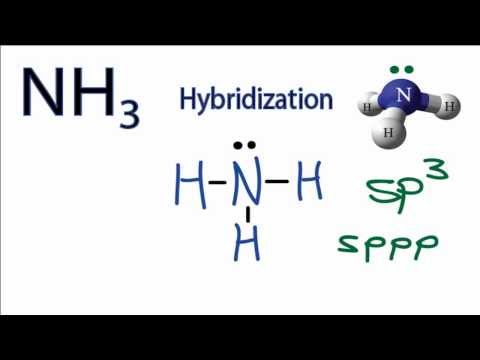
На жаль, перекриття існуючих атомних орбіталів (sтощо) недостатньо для пояснення деяких спостережуваних склеювальних та молекулярних геометрій.p Розглянемо елемент вуглецю і(CH4) молекулу метану. Атом вуглецю має електронну конфігурацію1s22s22p2, тобто він має два непарні електрони на своїх2p орбіталах, як показано на малюнку нижче.
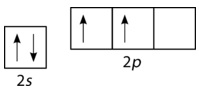
Згідно з описом теорії валентних зв'язків до цих пір, очікується, що вуглець утворює лише дві зв'язки, відповідні двом його непарним електронам. Однак метан - звичайна і стабільна молекула, з чотирма еквівалентнимиC−H зв'язками. Для обліку цього один з2s електронів просувається на порожню2p орбіту (див. Малюнок нижче).
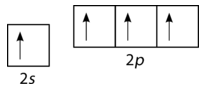
Тепер можливі чотири облігації. Просування електрона «обходиться» невеликою кількістю енергії, але нагадаємо, що процес утворення зв'язків супроводжується зниженням енергії. Дві додаткові зв'язки, які тепер можуть бути сформовані, призводять до меншої загальної енергії і, отже, більшої стійкості доCH4 молекули. Вуглець зазвичай утворює чотири зв'язку в більшості своїх сполук.
Кількість зв'язків тепер правильна, але геометрія неправильна. Триp орбіталі (pxpy,, іpz) орієнтовані90o відносно один одного. Однак, як видно з теорії VSEPR,H−C−H спостережуваний кут зв'язку вCH4 тетраедричній молекулі насправді109.5o. Тому молекула метану не може бути адекватно представлена простим перекриттям2s і2p орбіталів вуглецю1s орбіталями кожного атома водню.
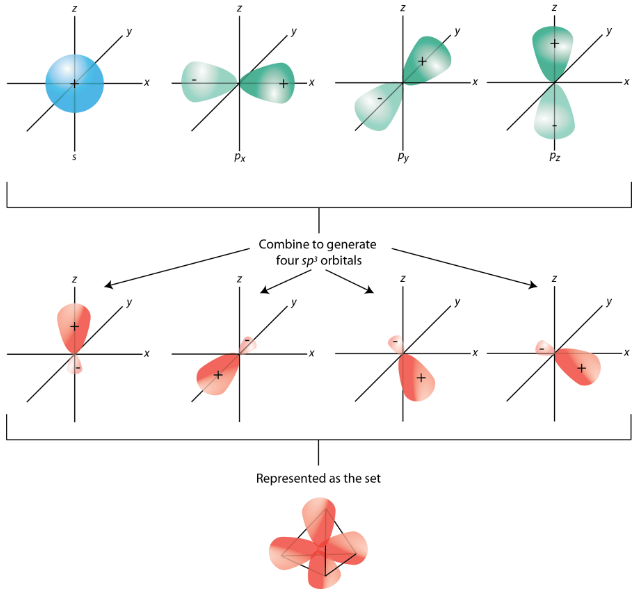
Щоб пояснити зв'язок в метані, необхідно ввести поняття гібридизації і гібридних атомних орбіталів. Гібридизація - це змішування атомних орбіталів в атомі для отримання набору гібридних орбіталів. Коли відбувається гібридизація, вона повинна робити це в результаті змішування нееквівалентних орбіталів. Іншими словами,s іp орбіталі можуть гібридизувати, алеp орбіталі не можуть гібридизувати з іншимиp орбіталями. Гібридні орбіталі - це атомні орбіталі, отримані, коли дві або більше нееквівалентні орбіталі з одного атома об'єднуються в процесі підготовки до утворення зв'язків. У поточному випадку вуглецю одиночна2s орбітальна гібридизується з трьома2p орбіталями, утворюючи набір з чотирьох гібридних орбіталів, званихsp3 гібридами (див. Малюнок нижче).
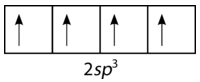
Всіsp3 гібриди еквівалентні один одному. Просторово гібридні орбіталі вказують на чотири кути тетраедра (див. Малюнок нижче).
Резюме
- Електрони гібридизуються з метою утворення ковалентних зв'язків.
- Нееквівалентні орбіталі змішуються, утворюючи гібридні орбіталі.
Рецензія
- Чому очікується, що вуглець утворює лише дві ковалентні зв'язки?
- Скільки ковалентних зв'язків насправді утворює вуглець?
- Що повинно статися, щоб вуглець утворив чотири зв'язки?