9.9: Ковалентне зв'язування в багатоатомних іоні
- Page ID
- 19124
Як ми розширюємо основні принципи?
Перед Верховним судом США стоїть незавидне завдання визначити, що диктує закон. Ця відповідальність може стати серйозним викликом, коли немає чіткого принципу, або коли вони стикаються з ситуацією, яка раніше не зустрічалася. Хімія стикається з тією ж проблемою в розширенні основних понять, щоб відповідати новій ситуації. Малювання структур Льюїса для багатоатомних іонів використовує той же підхід, але трохи підлаштовує процес, щоб відповідати дещо іншому набору обставин.
Багатоатомні іони
Нагадаємо, що багатоатомний іон - це група атомів, ковалентно пов'язаних між собою, і які несуть загальний електричний заряд. Іон амонію утворюється\(\ce{NH_4^+}\), коли іон водню\(\left( \ce{H^+} \right)\) приєднується до єдиної пари\(\left( \ce{NH_3} \right)\) молекули аміаку в координатно-ковалентному зв'язку.
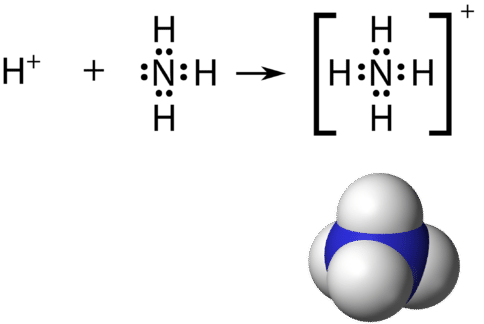
При малюванні структури Льюїса багатоатомного іона заряд іона відбивається в кількості сумарних валентних електронів в структурі. У випадку з іоном амонію:
\(1 \: \ce{N}\)атомні\(= 5\) валентні електрони
\(4 \: \ce{H}\)атоми\(= 4 \times 1 = 4\) валентних електронів
відняти 1 електрон для\(1+\) заряду іона
всього 8 валентних електронів в іоні
Структура Льюїса багатоатомного іона прийнято ставити у великий набір дужок, при цьому заряд іона у вигляді верхнього індексу поза дужками.
Приклад\(\PageIndex{1}\)
Намалюйте електронну точкову структуру Льюїса для сульфатного іона.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
Молекулярна формула сульфат-іона:\( \ce{SO_4^{2-}}\)
\(1 \: \ce{S}\)атомні\(= 6\) валентні електрони
\(4 \: \ce{O}\)атоми\(= 4 \times 6 = 24\) валентних електронів
додати 2 електрона для\(2-\) заряду іона
= всього 32 валентних електронів
Менш електронегативним атомом сірки є центральним атомом в структурі. Помістіть атоми кисню навколо атома сірки, кожен з яких має єдиний ковалентний зв'язок. Розподіліть поодинокі пари на кожен атом кисню, щоб задовольнити правило октета. Підрахуйте загальну кількість атомів. Якщо електронів в структурі занадто багато, зробіть множинні зв'язки між\(\ce{S}\) і\(\ce{O}\).
Крок 2: Вирішіть.
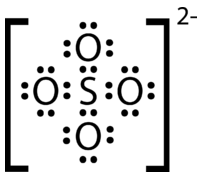
Крок 3: Подумайте про свій результат.
Структура Льюїса для сульфатного іона складається з центрального атома сірки з чотирма одиночними зв'язками з атомами кисню. Це дає очікувану загальну кількість 32 електронів. Оскільки атом сірки почався з шести валентних електронів, дві\(\ce{S-O}\) зв'язки є координатними ковалентними.
Резюме
- Структури Льюїса для багатоатомних іонів дотримуються тих же правил, що і для інших ковалентних сполук.
Рецензія
- Які дві характеристики багатоатомних іонів?
- Який атом стає центральним атомом в структурі?
- Де знаходиться заряд на іоні, розміщений в точковій діаграмі Льюїса?