9.4: Формування енергії та ковалентних зв'язків
- Page ID
- 19163
Чому BeCl 2 і LicL зв'язуються по-різному?
Ми дізналися, що галогенідні солі елементів групи 1 зазвичай є іонними сполуками. Ми очікували б\(\ce{LiCl}\) існувати як\(\ce{Li^+}\) катіони та\(\ce{Cl^-}\) аніони (і це відбувається). Однак, якщо ми перемістимо один стовпець вправо, сусідський берилій літію утворює інший тип зв'язку взагалі. Цей зв'язок складається з спільних електронів між\(\ce{Cl}\) атомами\(\ce{Be}\) і, а не електростатичного тяжіння серед іонів.
Формування енергії та ковалентних зв'язків
Молекулярні сполуки - це ті, які приймають форму окремої молекули. Молекулярні сполуки, як правило, складаються з двох або більше неметалевих атомів. Знайомі приклади включають воду\(\left( \ce{H_2O} \right)\), вуглекислий газ\(\left( \ce{CO_2} \right)\) та аміак\(\left( \ce{NH_3} \right)\). Нагадаємо, що молекулярна формула показує кількість кожного атома, що зустрічається в молекулі цієї сполуки. Одна молекула води містить два атоми водню і один атом кисню. Водень\(\left( \ce{H_2} \right)\) є прикладом елемента, який існує природним шляхом у вигляді двоатомної молекули. Двоатомна молекула - це молекула, що містить два атоми.
Більшість атомів досягають меншої потенційної енергії, коли вони пов'язані з іншими атомами, ніж коли вони відокремлені. Розглянемо два ізольованих атома водню, які розділені досить великою відстанню, щоб запобігти будь-якій взаємодії між ними. На цій відстані потенційна енергія системи вважається рівною нулю (див. Малюнок нижче).
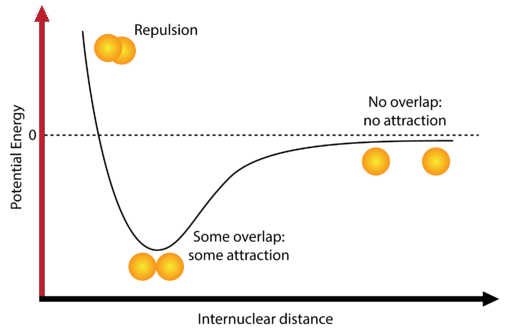
Коли атоми наближаються один до одного, їх електронні хмари поступово починають перекриватися. Зараз є кілька взаємодій, які починають відбуватися. Один полягає в тому, що поодинокі електрони, якими володіє кожен атом водню, починають відштовхувати один одного. Ця сила відштовхування, як правило, змушує потенційну енергію системи збільшуватися. Однак електрон кожного атома починає притягуватися до ядра іншого атома. Ця приваблива сила прагне змусити потенційну енергію системи зменшуватися.
Коли атоми спочатку починають взаємодіяти, сила притягання сильніша за силу відштовхування, і тому потенційна енергія системи зменшується, як видно на діаграмі. Пам'ятайте, що нижча потенційна енергія підвищує стійкість системи. Коли два атоми водню рухаються все ближче і ближче один до одного, потенційна енергія знаходиться в найнижчій можливій точці. Якщо атоми водню рухаються ближче один до одного, третя взаємодія починає домінувати, і це сила відштовхування між двома позитивно зарядженими ядрами. Ця сила відштовхування дуже сильна, що видно по різкому підйому енергії в крайньому лівому куті діаграми.
Точка, в якій потенційна енергія досягла свого мінімуму, являє собою ідеальну відстань між атомами водню для стабільного хімічного зв'язку. Цей тип хімічного зв'язку називається ковалентним зв'язком. Ковалентний зв'язок - це зв'язок, в якій два атома поділяють одну або кілька пар електронів. Одиночні електрони від кожного з двох атомів водню поділяються, коли атоми об'єднуються, утворюючи молекулу водню\(\left( \ce{H_2} \right)\).
Резюме
- Ковалентні зв'язки утворюються, коли атоми поділяють електрони між собою.
Рецензія
- Що таке двоатомна молекула?
- Що робить нижча потенційна енергія для системи?
- Яка ідеальна відстань для двох атомів?