7.12: Кислоти - іменування та формули
- Page ID
- 19612
Як проходить перевірку золота?
Точковий тест на золото використовується десятиліттями. Зразок спочатку обробляють азотною кислотою. Інші метали можуть вступати в реакцію або розчинятися в цій кислоті, але золото не буде. Потім пробу додають в суміш азотної кислоти і соляної кислоти. Золото буде тільки розчинятися в цій суміші. Термін «кислотний тест» виник у Каліфорнійської золотої лихоманки в кінці 1840-х років, коли ця комбінація використовувалася для перевірки на наявність справжнього золота. З тих пір це означає «перевірені та затверджені» у ряді галузей.
Кислоти
Кислоту можна визначити декількома способами. Найбільш простим визначенням є те, що кислота - це молекулярна сполука, яка містить один або кілька атомів водню і виробляє іони водню\(\left( \ce{H^+} \right)\) при розчиненні у воді.

Це інший тип з'єднання, ніж інші, які ми бачили досі. Кислоти є молекулярними, а це означає, що в чистому стані вони є окремими молекулами і не приймають розширені тривимірні структури іонних сполук, як\(\ce{NaCl}\). Однак при розчиненні цих молекул у воді хімічний зв'язок між атомом водню і рештою молекули розривається, залишаючи позитивно заряджений іон водню і аніон. Це можна символізувати в хімічному рівнянні:
\[\ce{HCl} \rightarrow \ce{H^+} + \ce{Cl^-}\nonumber \]
Оскільки кислоти виробляють\(\ce{H^+}\) катіони при розчиненні у воді, то кислоти спочатку записано у формулі неорганічної кислоти.\(\ce{H}\) Залишок кислоти (крім\(\ce{H}\)) є аніоном після розчинення кислоти. Органічні кислоти також є важливим класом сполук, але тут обговорюватися не буде. Бінарна кислота - це кислота, яка складається з водню і одного іншого елемента. Найбільш поширені бінарні кислоти містять галоген. Оксокислота - це кислота, яка складається з водню, кисню і третього елемента. Третій елемент, як правило, неметалевий.
Неймінг кислот
Оскільки всі кислоти містять водень, назва кислоти заснована на аніоні, який йде разом з нею. Ці аніони можуть бути як одноатомними, так і багатоатомними. Назва всіх одноатомних іонів закінчується на -ide. Більшість багатоатомних іонів закінчуються або -ate, або -ite, хоча є кілька винятків, таких як іон ціаніду\(\left( \ce{CN^-} \right)\). Саме суфікс аніона визначає, як називається кислота, як показано в правилах і таблиці нижче.
| Аніонний суфікс | Приклад | Назва кислоти | Приклад |
|---|---|---|---|
| -язь | хлорид\(\left( \ce{Cl^-} \right)\) | гідро_____ic кислота | соляна кислота\(\left( \ce{HCl} \right)\) |
| -їли | сульфат\(\left( \ce{SO_4^{2-}} \right)\) | ______ic кислота | сірчана кислота\(\left( \ce{H_2SO_4} \right)\) |
| -Іте | нітрит\(\left( \ce{NO_2^-} \right)\) | ____ous кислота | азотна кислота\(\left( \ce{HNO_2} \right)\) |
Три різні суфікси, які можливі для аніонів, призводять до трьох правил:
- Коли аніон закінчується на -ide, назва кислоти починається з приставки hydro-. Корінь назви аніона йде в бланку (хлор для хлориду), за ним йде суфікс -ic. \(\ce{HCl}\)є соляною кислотою, оскільки\(\ce{Cl^-}\) є хлорид-іон. \(\ce{HCN}\)це синильна кислота, оскільки\(\ce{CN^-}\) є іоном ціаніду.
- Коли аніон закінчується на -їли, назва кислоти - корінь аніона, за яким слідує суфікс -ic. Приставки немає. \(\ce{H_2SO_4}\)це сірчана кислота (не сірчана), оскільки\(\ce{SO_4^{2-}}\) є сульфатним іоном.
- Коли аніон закінчується на -ite, назва кислоти - корінь аніону, за яким слідує суфікс -ous. Знову ж таки, приставки немає. \(\ce{HNO_2}\)це азотна кислота, тому що\(\ce{NO_2^-}\) це нітрит-іон.
Зверніть увагу, як корінь для сірковмісної оксокислоти сірка- замість просто сульф-. Те ж саме стосується фосфорсодержащей оксокислоти. Корінь люмінофор- замість просто фосф-.
Багато продуктів і напоїв містять лимонну кислоту. Оцет - це розведений розчин оцтової кислоти. Автомобільні акумулятори містять сірчану кислоту, яка допомагає у вивільненні електронів для створення електрики.
Написання формул для кислот
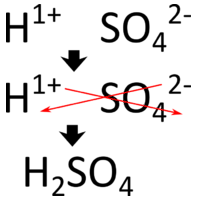
Як і інші сполуки, які ми вивчили, кислоти електрично нейтральні. Тому заряд аніонної частини формули повинен бути точно збалансований\(\ce{H^+}\) іонами. Так як\(\ce{H^+}\) іони несуть один позитивний заряд, то кількість\(\ce{H^+}\) іонів у формулі дорівнює кількості негативного заряду на аніоні. Два приклади з таблиці вище ілюструють цей момент. Хлоридний іон несе\(1-\) заряд, тому в формулі кислоти потрібен тільки один\(\ce{H}\)\(\left( \ce{HCl} \right)\). Сульфат-іон несе\(2-\) заряд, тому в формулі кислоти потрібні два\(\ce{H}\) з\(\left( \ce{H_2SO_4} \right)\). Ще один спосіб написати правильну формулу - використовувати перехресний метод, показаний нижче для сірчаної кислоти.
Резюме
- Кислоти - молекулярні сполуки, які виділяють іони водню
- Бінарна кислота складається з водню і одного іншого елемента.
- Оксокислоти містять водень, кисень і ще один елемент.
- Назва кислоти заснована на аніоні, прикріпленому до водню.
- Написання формул для кислот слідує тим же правилам, що і для бінарних іонних сполук.
Рецензія
- Визначте «кислота».
- Що таке бінарна кислота?
- Що таке оксокислота?
- Назвіть такі кислоти:
- Н 2 ТАК 4
- HCN
- HCl
- Н 3 ПОЗ 4
- Напишіть формули для наступних кислот:
- бромна кислота
- хлористої кислоти
- азотна кислота