5.13: Орбіталі
- Page ID
- 19412
Як же так, що стільки літаків здатні літати, не набігаючись один на одного?
Шляхи польоту комерційного авіалайнера ретельно регламентується Федеральним управлінням авіації. Кожен літак повинен підтримувати відстань в п'ять миль від іншого літака, що летить на тій же висоті, і бути 2,000 футів вище і нижче іншого літака (1000 футів, якщо висота менше 29 000 футів). Отже, кожен літак має лише певні позиції, які дозволяється підтримувати під час польоту. Квантова механіка демонструє, що електрони мають подібні обмеження на їх розташування.
Орбіталі
Ми можемо застосувати наші знання квантових чисел для опису розташування електронів для даного атома. Ми робимо це з тим, що називається електронними конфігураціями. Вони фактично є картою електронів для даного атома. Ми дивимося на чотири квантові числа для даного електрона, а потім привласнюємо цей електрон до певної орбіталі.
\(s\)Орбіталі
Для будь-якого значення\(n\), значення\(l=0\) місць, що електрон в \(s\)орбіталі. Ця орбітальна має сферичну форму:

\(p\)Орбіталі
З наведеної нижче таблиці видно, що можливі три орбіталі, коли\(l=1\). Вони позначаються як \(p\)орбіталі і мають форму гантелей. Кожна з\(p\) орбіталей має різну орієнтацію в тривимірному просторі.

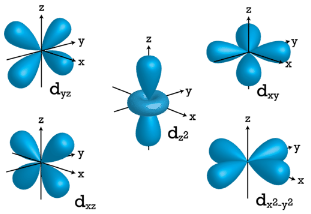
\(d\)Орбіталі
Коли\(l=2\),\(m_l\) значення можуть бути\(-2, \: -1, \: 0, \: +1, \: +2\) в цілому п'ять \(d\)орбіталей. Зверніть увагу, що всі п'ять орбіталей мають специфічні тривимірні орієнтації.
\(f\)Орбіталі
Найскладнішим набором орбіталей є \(f\)орбіталі. Коли\(l=3\),\(m_l\) значення можуть бути\(-3, \: -2, \: -1, \: 0, \: +1, \: +2, \: +3\) для загальної кількості семи різних орбітальних форм. Знову ж таки, зверніть увагу на конкретні орієнтації різних\(f\) орбіталів.

| Основне квантове число\(\left( n \right)\) | Допустимі підрівні | Кількість орбіталей на підрівні | Кількість орбіталей на основний енергетичний рівень | Кількість електронів на підрівні | Кількість електронів на рівні основної енергії |
|---|---|---|---|---|---|
| \ (\ ліворуч (n\ праворуч)\)» style="вертикальне вирівнювання: middle; "> 1 | \(s\) | 1 | 1 | 2 | 2 |
| \ (\ left (n\ right)\)» rowspan = "2" style="вертикальне вирівнювання: середина; "> 2 | \(s\) | 1 | 4 | 2 | 8 |
| \(p\) | 3 | 6 | |||
| \ (\ left (n\ right)\)» rowspan = "3" style="вертикальне вирівнювання: середина; "> 3 | \(s\) | 1 | 9 | 2 | 18 |
| \(p\) | 3 | 6 | |||
| \(d\) | 5 | 10 | |||
| \ (\ ліворуч (n\ праворуч)\)» rowspan = "4" style="вертикальне вирівнювання: середина; "> 4 | \(s\) | 1 | 16 | 2 | 32 |
| \(p\) | 3 | 6 | |||
| \(d\) | 5 | 10 | |||
| \(f\) | 7 | 14 |
Резюме
- Існує чотири різних класи електронних орбіталей.
- Електронні орбіталі визначаються значенням квантового числа моменту моменту\(l\).
Рецензія
- Що таке електронна конфігурація?
- Скільки електронів в\(n=1\) орбіталі?
- Яка загальна кількість електронів в\(p\) орбіталі?
- Скільки електронів потрібно, щоб повністю заповнити\(d\) орбіталь?