5.7: Спектральні лінії атомного водню
- Page ID
- 19423
Чи можете ви полагодити двигун автомобіля?
Хоча рідше в цей день і вік, був час, коли багато людей могли працювати на власних автомобілі, якщо виникла проблема. Сьогодні двигуни комп'ютеризовані і вимагають спеціалізованої підготовки та інструментів для того, щоб бути закріпленими. Коли люди робили власний ремонт, іноді це був процес проб і помилок. Можливо, свічки запалювання потрібно замінити. Ні, це не вирішило проблему повністю, але це був початок у правильному напрямку. Наука діє так само. Теорія, яка розробляється, може працювати деякий час, але тоді є дані, які теорія не може пояснити. Це означає, що настав час для більш нової та інклюзивної теорії.
Спектральні лінії водню
Модель Бора пояснює спектральні лінії атомного спектра викидів водню. Поки електрон атома залишається в наземному стані, його енергія незмінна. Коли атом поглинає один або кілька квантів енергії, електрон рухається з орбіти наземного стану на орбіту збудженого стану, яка знаходиться далі. Рівні енергії позначаються за допомогою змінної\(n\). Наземний стан - це\(n=1\), перший збуджений\(n=2\) стан і так далі. Енергія, яку отримує атом, дорівнює різниці енергії між двома енергетичними рівнями. Коли атом розслабляється назад до нижчого енергетичного стану, він вивільняє енергію, яка знову дорівнює різниці в енергії двох орбіт (див. Нижче).

Зміна енергії\(\Delta E\), потім перекладається на світло певної частоти, що випромінюється відповідно до рівняння\(E = h \nu\). Нагадаємо, що атомний спектр випромінювання водню мав спектральні лінії, що складаються з чотирьох різних частот. Це пояснюється в моделі Бора усвідомленням того, що електронні орбіти не однаково розташовані. Оскільки енергія збільшується все далі і далі від ядра, відстань між рівнями стає все менше і менше.
Виходячи з довжин хвиль спектральних ліній, Бор зміг обчислити енергії, які матиме електрон водню в кожному з дозволених енергетичних рівнів. Потім він математично показав, які переходи енергетичного рівня відповідають спектральним лініям в спектрі атомного випромінювання (див. Нижче).
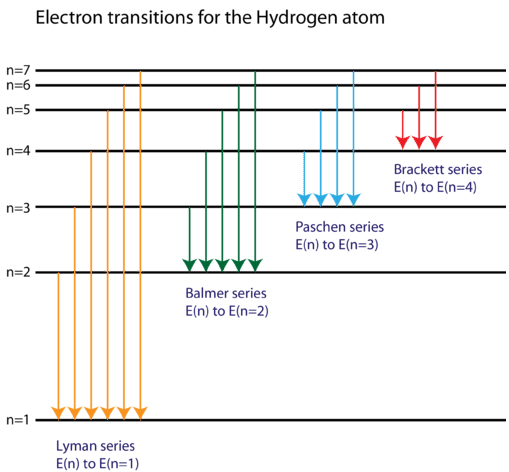
Він виявив, що чотири видимі спектральні лінії відповідають переходам від вищих енергетичних рівнів до другого енергетичного рівня\(\left( n=2 \right)\). Це називається серією Balmer. Переходи, що закінчуються в наземному стані,\(\left( n=1 \right)\) називаються рядами Лимана, але виділяються енергії настільки великі, що спектральні лінії все знаходяться в ультрафіолетовій області спектра. Переходи, які називаються серіями Пашена та серіями Брекетта, призводять до спектральних ліній в інфрачервоній області, оскільки енергії занадто малі.
Модель Бора мала величезний успіх у поясненні спектра атома водню. На жаль, коли математика моделі застосовувалася до атомів з більш ніж одним електроном, вона не змогла правильно передбачити частоти спектральних ліній. Хоча модель Бора представляла собою великий прогрес в атомній моделі, і концепція електронних переходів між енергетичними рівнями є дійсною, необхідні були вдосконалення для того, щоб повністю зрозуміти всі атоми та їх хімічну поведінку.
Резюме
- Емісійні лінії для водню відповідають енергетичним змінам, пов'язаним з електронними переходами.
- Модель Бора працює тільки для атома водню.
Рецензія
- Що відбувається, коли атом водню поглинає один або кілька квантів енергії?
- Як ми виявляємо зміну енергії?
- Які електронні переходи представлені лініями ряду Пашена?
- Чи працює модель Бора для атомів, відмінних від водню?