3.3: Електричні властивості чистої води
- Page ID
- 18115
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \) \( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)\(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\) \(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\)
Електричні властивості чистої води
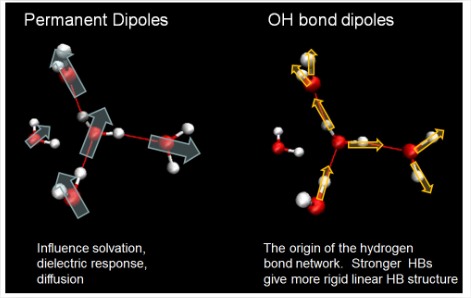
Рух диполів води направляє практично все, що відбувається в рідині. Два важливих внеску:
- Постійний дипольний момент молекули лежить уздовж осі симетрії.
- Індуковані дипольні моменти (поляризація) уздовж водневих зв'язків. Зміцнення водневого зв'язку збільшується\(r_{OH}\) і зменшується\(R_{OO}\), що збільшує дипольний момент. Дипольний момент на молекулу змінюється від 1,7 до 3,0 D, переходячи від газової фази до рідкої.
Вододіелектрична реакція
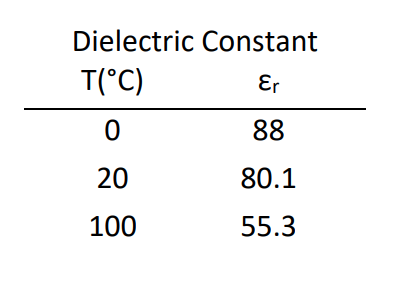
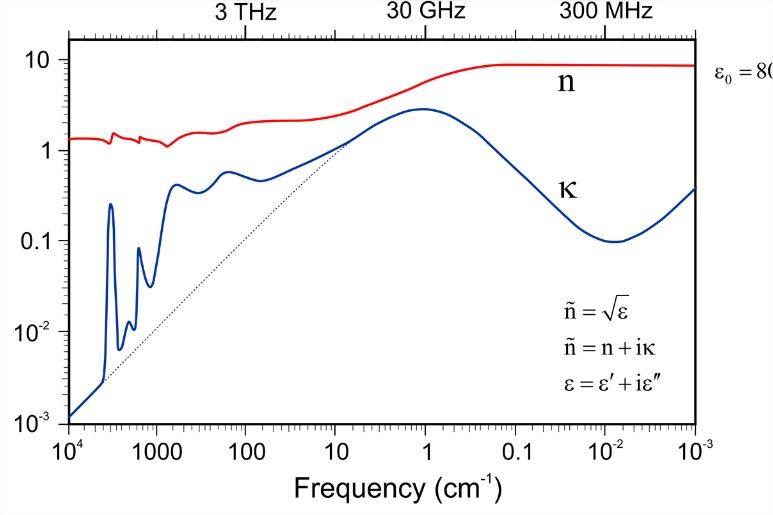
Чиста вода є сильним діелектричним середовищем, що означає, що електростатичні сили великої дальності, що діють між двома зарядами у воді, різко зменшуються. Статична діелектрична проникність\(\varepsilon = 80\), також відома як відносна проникність\(\varepsilon_r = \varepsilon /\varepsilon_0\). Діелектрична характеристика сильно залежить від частоти та температури. Рух водних зарядів закодований в складній діелектричній\(\varepsilon\) проникності () або показнику заломлення (\(\tilde{n}\)).
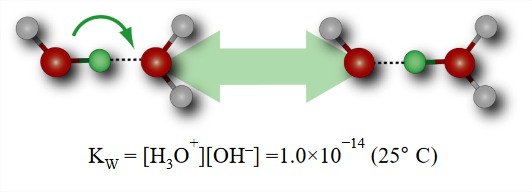
Автоіонізація води та рН
- Протони та гідроксид регулюють хімію кислотної основи.
- Будь-яка молекула води в основній масі живе близько 10 годин до дисоціації.
- У літрі молекула води дисоціює кожні 30 мікросекунд.
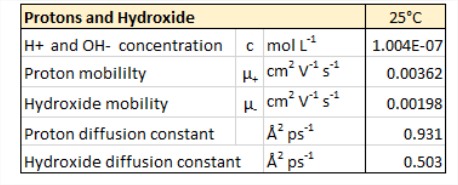
Протони у воді
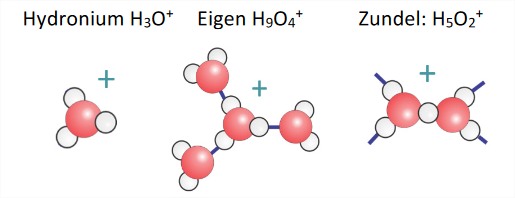
- Структура\(H^+\) у воді та ступінь делокалізації надлишкового заряду досі не вирішені. Він пов'язаний досить сильно, щоб описати як ковалентно взаємодіючий, але його еволюція часу настільки швидка (<1 пс), що важко визначити структуру.
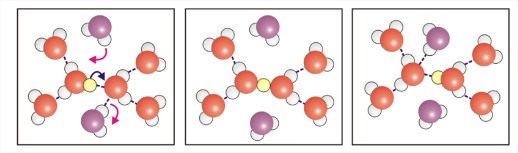
- Набагато більша рухливість, ніж очікувалося при дифузії катіону аналогічного розміру.
- Пояснюється Гроттусом механізм перенесення протона в сусідні молекули води.
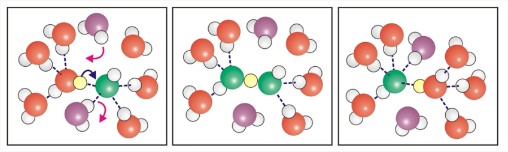
- ОН — також дуже рухливий і діє як протонний акцептор від води.
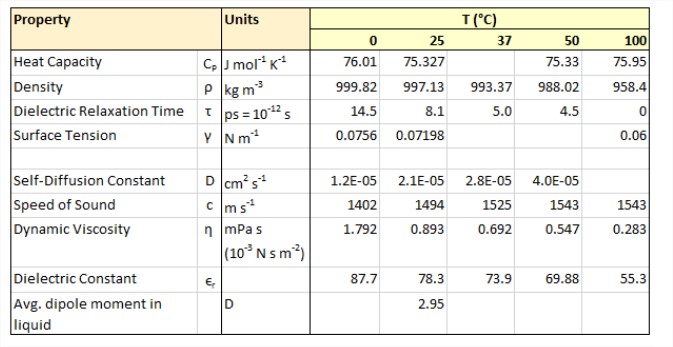
Фізичні властивості води