1.4: Введення в атомно-абсорбційну спектроско
- Page ID
- 18812
Короткий огляд атомно-абсорбційної спектроскопії
Історія атомно-абсорбційної спектроскопії
Найдавніша спектроскопія була вперше описана Маркусом Марком фон Кронландом в 1648 році шляхом аналізу сонячного світла, яке проходить через краплі води і, таким чином, створюючи веселку. Подальший аналіз сонячного світла Вільямом Хайдом Волластоном (рис.\(\PageIndex{1}\)) призвів до відкриття чорних ліній в спектрі, що в 1820 році сер Девід Брюстер (рис.\(\PageIndex{2}\)) пояснив як поглинання світла в атмосфері сонця.


Роберт Бунсен (рис.\(\PageIndex{3}\)) і Густав Кірхгофф (рис.\(\PageIndex{4}\)) вивчили натрієвий спектр і прийшли до висновку, що кожен елемент має свій унікальний спектр, який можна використовувати для ідентифікації елементів в паровій фазі. Кірхофф також пояснив це явище тим, що якщо матеріал може випромінювати випромінювання певної довжини хвилі, він також може поглинати випромінювання цієї довжини хвилі. Хоча Бунсен і Кірхофф зробили великий крок у визначенні техніки атомно-абсорбційної спектроскопії (ААС), вона не була широко використана як аналітична техніка, за винятком галузі астрономії через багато практичних труднощів.



У 1953 році Алан Уолш (рис.\(\PageIndex{5}\)) різко вдосконалив методи ААС. Він виступав за AAS багатьом виробникам приладів, але безрезультатно. Хоча він вдосконалив методи, він не показав, як це може бути корисно в будь-яких додатках. У 1957 році він виявив використання для AAS, що переконало виробляє ринок перших комерційних спектрометрів AAS. З того часу популярність ААС коливалася, оскільки інші аналітичні методи та вдосконалення методів здійснюються.
Теорія атомно-абсорбційної спектро
Для того, щоб зрозуміти, як працює атомно-абсорбційна спектроскопія, необхідна певна довідкова інформація. Атомна теорія почалася з Джона Далтона (рис.\(\PageIndex{6}\)) в 18 столітті, коли він запропонував концепцію атомів, що всі атоми елемента ідентичні, і що атоми різних елементів можуть об'єднуватися, утворюючи молекули. У 1913 році Нільс Бор (рис.\(\PageIndex{7}\)) здійснив революцію в атомній теорії, запропонувавши квантові числа, позитивно заряджене ядро та електрони, що обертаються навколо ядра, у тому, що стало відомим як модель Бора атома. Незабаром після цього Луї ДеБроль (рис.\(\PageIndex{8}\)) запропонував квантовану енергію електронів, що є надзвичайно важливим поняттям в ААС. Вольфганг Паулі (Рисунок\(\PageIndex{9}\)) потім розробив теорію ДеБроля, заявивши, що жодні два електрони не можуть розділяти однакові чотири квантові числа. Ці знакові відкриття в атомній теорії необхідні для розуміння механізму ААС.




Атоми мають валентні електрони, які є найвіддаленішими електронами атома. Атоми можуть збуджуватися при опроміненні, що створює спектр поглинання. Коли атом збуджується, валентний електрон рухається вгору на енергетичний рівень. Енергії різних стаціонарних станів або обмежених орбіт можуть бути визначені цими лініями випромінювання. Потім резонансна лінія визначається як питоме випромінювання, поглинене для досягнення збудженого стану.
Рівняння Максвелла-Больцмана дає кількість електронів в будь-якій заданій орбіталі. Він пов'язує розподіл з тепловою температурою системи (на відміну від електронної температури, коливальної температури або температури обертання). Планк запропонував випромінювання випромінюваної енергії в дискретних пакетах (квантах),
\[ E= h \nu \nonumber \]
які можуть бути пов'язані з рівнянням Ейнштейна
\[ E=mc^2 \label{eq:mc2} \]
Як атомно-емісійна, так і атомно-абсорбційна спектроскопія може бути використана для Атомно-емісійна спектроскопія вимірює інтенсивність світла, випромінюваного збудженими атомами, в той час як атомна абсорбційна спектроскопія вимірює світло, поглинене атомним Це світло, як правило, знаходиться у видимій або ультрафіолетовій області електромагнітного спектра. Потім відсоток порівнюється з калібрувальною кривою для визначення кількості матеріалу у зразку. Енергія системи може бути використана для знаходження частоти випромінювання, а отже і довжини хвилі за допомогою комбінації рівнянь\ ref {eq:mc2} і\ ref {eq:ncl}.
\[ \nu = c/\lambda \label{eq:ncl} \]
Оскільки енергетичні рівні квантовані, допускаються лише певні довжини хвиль, і кожен атом має унікальний спектр. Існує безліч змінних, які можуть вплинути на систему. Наприклад, якщо зразок змінити таким чином, що збільшує популяцію атомів, відбудеться збільшення як емісії, так і поглинання і навпаки. Існують також змінні, які впливають на відношення збуджених до незбуджених атомів, таких як підвищення температури пари.
Застосування атомної абсорбційної спектроскопії
Існує багато застосувань атомно-абсорбційної спектроскопії (ААС) через її специфіку. Їх можна розділити на широкі категорії біологічного аналізу, екологічного та морського аналізу та геологічного аналізу.
Біологічний аналіз
Біологічні зразки можуть включати як зразки тканин людини, так і зразки харчових продуктів. У зразках тканин людини ААС може використовуватися для визначення кількості різних рівнів металів та інших електролітів у зразках тканин. Ці зразки тканин можуть бути багато речей, включаючи, але не обмежуючись, кров, кістковий мозок, сечу, волосся та нігті. Підготовка проби залежить від зразка. Це надзвичайно важливо в тому, що багато елементів токсичні в певних концентраціях в організмі, і ААС може аналізувати, в яких концентраціях вони присутні. Деякі приклади мікроелементів, на які аналізуються зразки, - це миш'як, ртуть та свинець.
Прикладом застосування ААС до тканини людини є вимірювання електролітів натрію і калію в плазмі. Це вимірювання важливо, оскільки значення можуть свідчити про різні захворювання, коли вони виходять за межі норми. Типовим методом, який використовується для цього аналізу, є розведення 1:50 в хлориді стронцію (\(\ce{SrCl2}\)) за допомогою повітряно-водневого полум'я. Натрій виявляється на його вторинній лінії (330.2 нм), оскільки виявлення на першій лінії вимагатиме подальшого розведення зразка через інтенсивність сигналу. Причина, по якій використовується хлорид стронцію, полягає в тому, що він зменшує іонізацію іонів калію та натрію, усуваючи при цьому втручання фосфатів та кальцію.
У харчовій промисловості ААС забезпечує аналіз овочів, продуктів тваринного походження та кормів для тварин. Ці види аналізів є одними з найстаріших застосувань ААС. Важливим фактором, який потрібно враховувати при аналізі їжі, є відбір проб. Зразок повинен бути точним відображенням того, що аналізується. Через це він повинен бути однорідним, і багатьом часто потрібно, щоб було запущено кілька зразків. Проби їжі найчастіше проводять для того, щоб визначити кількість мінералів та мікроелементів, щоб споживачі знали, чи споживають вони достатню кількість. Зразки також аналізуються для визначення важких металів, які можуть завдати шкоди споживачам.
Екологічний та морський аналіз
Екологічний та морський аналіз, як правило, відноситься до аналізу води різних типів. Аналіз води включає багато речей, починаючи від питної води до стічних вод до морської води. На відміну від біологічних проб, підготовка проб води регулюється скоріше законами, ніж самим зразком. Аналіти, які можна виміряти, також сильно різняться і часто можуть включати свинець, мідь, нікель та ртуть.
Прикладом аналізу води є аналіз вилуговування свинцю і цинку з олов'яно-свинцевого припою в воду. Припій - це те, що пов'язує стики мідних труб. У цьому конкретному експерименті було проаналізовано м'яку воду, кислу воду та хлоровану воду. Підготовка зразків полягала в тому, щоб піддавати різні зразки води мідним пластинам з припоєм протягом різних інтервалів часу. Потім зразки були проаналізовані на мідь і цинк з повітряно-ацетиленовим полум'ям ААС. Була використана дейтерієва лампа. Для зразків, які мали рівень міді нижче 100 мкг/л, метод був змінений на електротермічну ААС графітової печі через його більш високу чутливість.
Геологічний аналіз
Геологічний аналіз охоплює як запаси корисних копалин, так і екологічні дослідження. При пошуку запасів корисних копалин метод ААС повинен бути дешевим, швидким та універсальним, оскільки більшість перспектив в кінцевому підсумку не мають економічного використання. При вивченні гірських порід підготовка може включати кислотні перетравлення або вилуговування. Якщо в зразку потрібно проаналізувати вміст кремнію, кислотне перетравлення не є підходящим методом підготовки.
Прикладом може служити аналіз озерних і річкових відкладень на свинець і кадмій. Оскільки цей експеримент передбачає твердий зразок, потрібна більша підготовка, ніж для інших прикладів. Осад спочатку висушували, потім подрібнювали в порошок, а потім розкладали в бомбі з азотною кислотою (\(\ce{HNO3}\)) і хлорною кислотою (\(\ce{HClO4}\)). Підготовлено стандарти свинцю і кадмію. Сульфат амонію (\(\ce{[NH4][SO4]}\)]) та фосфат амонію (\(\ce{[NH4][3PO4]}\)]) були додані до зразків для виправлення перешкод, спричинених натрієм та калієм, які присутні у зразку. Потім стандарти та зразки були проаналізовані за допомогою електротермічного ААС.
Контрольно-вимірювальні прилади
Атомайзер
Для того щоб проба була проаналізована, його попередньо потрібно розпорошити. Це надзвичайно важливий крок в ААС, оскільки він визначає чутливість читання. Найефективніші атомайзери створюють велику кількість однорідних вільних атомів. Існує багато видів атомайзерів, але зазвичай використовуються лише два: полум'яні та електротермічні атомайзери.
Розпилювач полум'я
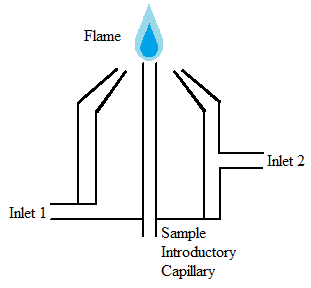
Полум'я атомайзери (Рисунок\(\PageIndex{10}\)) широко використовуються з безлічі причин, включаючи їх простоту, низьку вартість, і довгий проміжок часу, що вони були використані. Розпилювачі полум'я приймають аерозоль з небулайзера в полум'я, яке має достатньо енергії як для випаровування, так і для розпилення зразка. Коли це відбувається, зразок висушується, випаровується, розпилюється і іонізується. У межах цієї категорії атомайзерів існує безліч підкатегорій, що визначаються хімічним складом полум'я. Склад полум'я часто визначається на підставі аналізованого зразка. Саме полум'я повинно відповідати декільком вимогам, включаючи достатню енергію, велику довжину, нетурбулентний і безпечний.
Електротермічний розпилювач
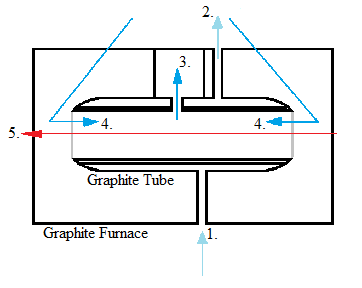
Хоча електротермічні атомайзери були розроблені до розпилювачів полум'я, вони не стали популярними до недавнього часу завдяки поліпшенню рівня виявлення. Вони використовують графітові трубки, які підвищують температуру поетапно. Електротермічне розпилення спочатку висушує зразок і випаровує значну частину розчинника та домішок, потім розпилює зразок, а потім піднімає його до надзвичайно високої температури для очищення графітової трубки. Деякі вимоги до цієї форми розпилення - здатність підтримувати постійну температуру під час розпилення, мати швидке розпилення, утримувати великий обсяг розчину, випромінювати мінімальне випромінювання. Електротермічне розпилення набагато менш суворе, ніж метод розпилення полум'я.
Джерело випромінювання
Потім джерело випромінювання опромінює розпилений зразок. Зразок поглинає частину випромінювання, а решта проходить через спектрометр до детектора. Джерела випромінювання можна розділити на дві великі категорії: лінійні джерела та джерела континууму. Лінійні джерела збуджують аналіт і таким чином випромінюють власний лінійний спектр. Лампи з порожнистим катодом і безелектродні розрядні лампи є найбільш часто використовуваними прикладами лінійних джерел. З іншого боку, джерела континууму мають випромінювання, яке поширюється на більш широкий діапазон довжин хвиль. Ці джерела зазвичай використовуються лише для корекції фону. Для цієї мети часто використовуються дейтерієві лампи і галогенні лампи.
Спектрометр
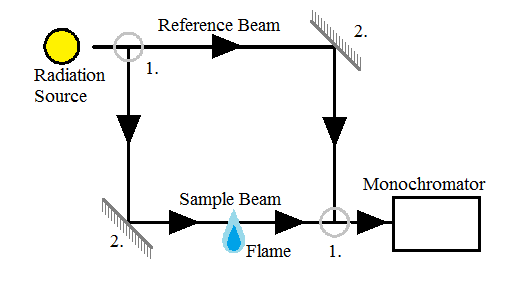
Спектрометри використовуються для поділу різних довжин хвиль світла перед тим, як вони перейдуть на детектор. Спектрометр, що використовується в ААС, може бути як однопроменевим, так і двопроменевим. Однопроменеві спектрометри вимагають лише випромінювання, яке проходить безпосередньо через розпилений зразок, тоді як двопроменеві спектрометри (рис.\(\PageIndex{12}\)), як мається на увазі з назви, вимагають двох пучків світла; той, який проходить безпосередньо через зразок, і той, який взагалі не проходить через зразок. (Вставити діаграми) Однопроменеві спектрометри мають менше оптичних компонентів і тому зазнають менших втрат випромінювання. Двопроменеві монохроматори мають більше оптичних компонентів, але вони також більш стабільні з часом, оскільки можуть легше компенсувати зміни.
Отримання вимірювань
підготовка зразків
Підготовка зразків надзвичайно різноманітна через діапазон зразків, які можна проаналізувати. Незалежно від типу зразка, слід зробити певні міркування. До них відносяться лабораторне середовище, посудина, що утримує зразок, зберігання зразка та попередня обробка зразка.
Підготовка зразків починається з того, щоб мати чисте середовище для роботи. ААС часто використовується для вимірювання мікроелементів, і в цьому випадку забруднення може призвести до серйозної помилки. Можливе обладнання включає ламінарні витяжки, чисті приміщення та закриті чисті ємності для транспортування зразка. Зразок не тільки повинен зберігатися в чистоті, він також повинен бути збережений з точки зору рН, складових та будь-яких інших властивостей, які можуть змінити вміст.
Коли мікроелементи зберігаються, матеріал стінок судин може адсорбувати частину аналіту, що призводить до поганих результатів. Для виправлення цього в якості матеріалу для зберігання часто використовують перфтороалкоксиполімери (ПФА), кремнезем, склоподібний вуглець та інші матеріали з інертними поверхнями. Підкислення розчину соляною або азотною кислотою також може допомогти запобігти прилипання іонів до стінок судини, конкуруючи за простір. Судини також повинні містити мінімальну площу поверхні, щоб мінімізувати можливі місця адсорбції.
Попередня обробка зразка залежить від характеру зразка. Див. таблицю\(\PageIndex{1}\) для зразків методів попередньої обробки.
| Зразок | Приклади | Метод попередньої обробки |
|---|---|---|
| водні розчини | Вода, напої, сеча, кров | Травлення, якщо присутні перешкоди, що викликають замісники |
| Підвіси | Вода, напої, сеча, кров | Тверді речовини повинні бути або видалені шляхом фільтрації, центрифугування або травлення, і тоді можна дотримуватися методів водних розчинів |
| Органічні рідини | Паливо, масла | Або пряме вимірювання за допомогою ААС, або розведення органічним матеріалом з подальшим вимірюванням за допомогою ААС, стандарти повинні містити аналіт у тій же формі, що і зразок |
| Тверді речовини | Продукти харчування, гірські породи | Травлення з подальшим електротермічним ААС |
Калібрувальна крива
Для того щоб визначити концентрацію аналіту в розчині, можуть бути використані калібрувальні криві. Використовуючи стандарти, можна створити графік концентрації проти поглинання. Три загальні методи, що використовуються для виготовлення калібрувальних кривих, - це стандартна техніка калібрування, техніка брекетування та техніка додавання аналітів.
Стандартна техніка калібрування
Цей прийом є одночасно найпростішим і найбільш часто використовуваним. Концентрація зразка виявляється шляхом порівняння його поглинання або інтегрованого поглинання з кривою концентрації стандартів проти поглинань або інтегрованих поглинань стандартів. Для того, щоб цей метод був застосований, повинні бути дотримані наступні умови:
- І стандарти, і зразок повинні мати однакову поведінку при розпиленні. Якщо їх немає, матрицю стандартів слід змінити відповідно до матриці зразка.
- Похибка вимірювання поглинання повинна бути меншою, ніж при підготовці стандартів.
- Зразки повинні бути однорідними.
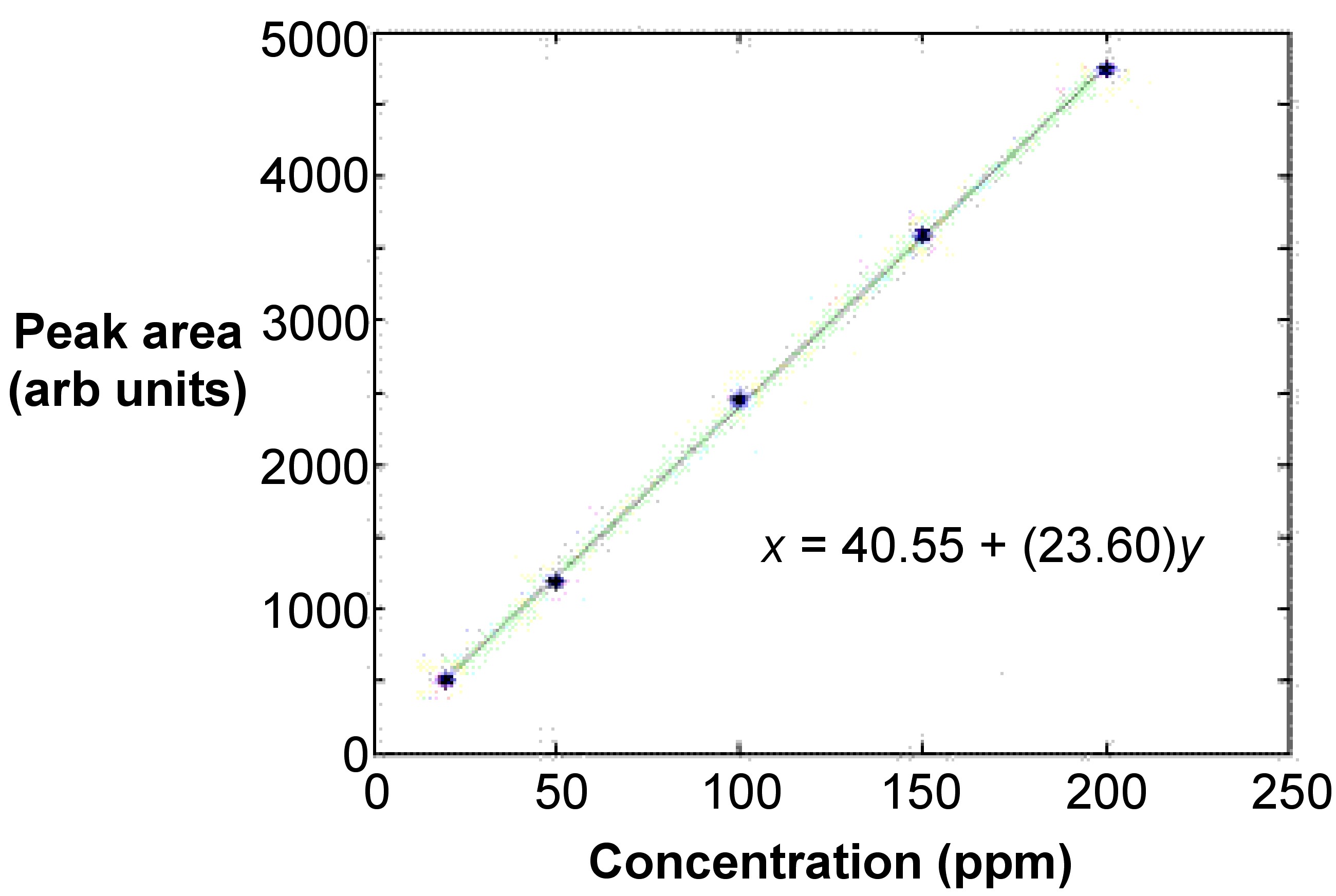
Крива, як правило, лінійна і включає щонайменше п'ять точок з п'яти стандартів, які знаходяться на рівновіддалених концентраціях один від одного (рис.\(\PageIndex{13}\)). Це гарантує, що посадка прийнятна. Найменше означає обчислення квадратів використовується для лінійного підгонки лінії. У більшості випадків крива лінійна лише до значень поглинання від 0,5 до 0,8. Значення поглинання стандартів повинні мати значення поглинання порожнього відніманого.
Техніка брекетінгу
Техніка брекетінгу є варіацією стандартної техніки калібрування. У цьому методі необхідні тільки два стандарти з концентраціями\(c_1\) і\(c_2\). Вони дуже близько встановлюють приблизне значення концентрації зразка. Застосування рівняння\ ref {bracketing} визначає значення для зразка, де\(c_x\) і\(A_x\) є концентрацією і адсорбцією невідомого,\(A_1\) і\(A_2\) є адсорбенцією для\(c_1\) і\(c_2\), відповідно.
\[ c _ { x } = \frac { \left( A _ { x } - A _ { 1 } \right) \left( c _ { 1 } - c _ { 2 } \right) } { A _ { 2 } - A _ { 1 } } + c _ { 1 } \label{bracketing } \]
Цей метод дуже корисний, коли концентрація аналіту у зразку знаходиться поза лінійною частиною калібрувальної кривої, оскільки дужка настільки мала, що частина використовуваної кривої може бути зображена як лінійна. Хоча цей метод можна точно використовувати для нелінійних кривих, чим далі крива від лінійної, тим більшою буде похибка. Щоб зменшити цю похибку, стандарти повинні дуже тісно скоротити зразок.
Техніка додавання аналітів
Техніка додавання аналітів часто використовується, коли очікується, що супутні в зразку створять багато перешкод, а склад зразка невідомий. Попередні два методи вимагають, щоб стандарти мали подібну матрицю до матриці зразка, але це неможливо, коли матриця невідома. Щоб компенсувати це, методика додавання аналітів використовує аліквоту самого зразка в якості матриці. Потім аліквоти шипами з різною кількістю аналіту. Ця методика повинна використовуватися тільки в межах лінійного діапазону поглинань.
Вимірювання перешкод
Перешкоди спричинені забрудненнями всередині зразка, які поглинають на тій же довжині хвилі, що і аналіт, і, таким чином, можуть спричинити неточні вимірювання. Виправлення можуть бути зроблені за допомогою різних методів, таких як фонова корекція, додавання хімічних добавок або додавання аналіту.
| Тип перешкод | Причина перешкод | Результат | Приклад | коригувальні заходи |
|---|---|---|---|---|
| Перекриття атомних ліній | Спектральний профіль двох елементів знаходиться в межах 0,01 нм один від одного | Вище експериментальне значення поглинання, ніж реальне значення | Дуже рідко, єдиною правдоподібною проблемою є мідь (324,754 нм) та європій (324,753 нм) | Зазвичай не зустрічається в практичних ситуаціях, тому не існує встановленого методу корекції |
| Молекулярна смуга і перекриття ліній | Спектральний профіль елемента перекривається молекулярною смугою | Вище експериментальне значення поглинання, ніж реальне значення | Гідроксид кальцію та барій при 553,6 нм у повітряно-ацетиленовому полум'ї | Корекція фону |
| Іонізація (парофазне або катіонне підвищення) | атоми іонізуються при температурі полум'я/печі, що зменшує кількість вільних атомів | Менше експериментальне значення поглинання, ніж реальне значення | Проблеми зазвичай виникають з цезієм, калієм та натрієм | Додайте придушувач іонізації (або буфер) як до зразка, так і до стандартів |
| Світло розсіювання | Тверді частинки розсіюють пучок світла, знижуючи інтенсивність пучка, що надходить в монохроматор. | Вище експериментальне значення поглинання, ніж реальне значення | Висока кількість зразків з багатьма вогнетривкими елементами, найвища при довжині хвиль УФ (додайте конкретний приклад) | Модифікація матриці та/або корекція фону |
| Хімічна | Хімічна речовина, що аналізується, міститься в складі сполуки в аналіті, яка не розпилюється | Менше експериментальне значення поглинання, ніж реальне значення | Іони кальцію та фосфату утворюють фосфат кальцію, який потім перетворюється на пірофосфат кальцію, який стабільний при сильному нагріванні. | Збільште температуру полум'я, якщо використовується полум'я ААС, використовуйте вивільняючу хімічну речовину або стандартне доповнення для електротермічного ААС |
| Фізичні | Якщо фізичні властивості зразка та стандарти різні, атомізація може вплинути, впливаючи, таким чином, на кількість популяції вільних атомів | Може змінюватися в будь-якому напрямку залежно від умов | Різниця в'язкості, різниці поверхневого натягу тощо | Змініть стандарти, щоб мати подібні фізичні властивості до зразків |
| Воліталізація | При електротермічному розпиленні перешкоди виникатимуть, якщо швидкість випаровування для зразка не така, як для стандарту, що часто викликано важкою матрицею | Може змінюватися в будь-якому напрямку залежно від умов | Хлориди дуже летючі, тому їх потрібно перетворити в менш летючу форму. Часто це робиться шляхом додавання нітрату або сульфату. Цинк і свинець також дуже проблемні | Змінити матрицю стандартним додаванням, або вибірково випаровувати компоненти матриці |
Бібліографія
- Ебон Л., Фішер і С.Дж. Хілл, Вступ до аналітичної атомної спектрометрії, під ред. Еванс Еванс, Уайлі, Нью-Йорк (1998).
- Б.Вельц і М. Сперлінг, атомно-абсорбційна спектрометрія, 3-е видання, Вілі-ВЧ, Нью-Йорк (1999).
- Робінсон Дж., Атомна спектроскопія, 2-е изд. Марсель Деккер, Інк., Нью-Йорк (1996).
- Субраманян К.С., Водні рез., 1995, 29, 1827.
- Саката і О.Шимода, Водні рез., 1982, 16, 231.
- Ван Лун, Аналітична атомно-абсорбційна спектроскопія Вибрані методи, Академічна преса, Нью-Йорк (1980).
