1.1: Емпіричні зв'язки та специфіка методів розрахунку, що використовуються для розв'язання неізотермічних кінетичних задач
- Page ID
- 17528
Розв'язування кінетичної задачі складається з декількох етапів. На першому кроці розв'язується обернена кінетична задача шляхом оцінки параметрів Арреніуса. Однак рішення вимагає проведення ряду експериментів з різними швидкостями нагріву і визначення оптимальних умов експерименту:
\[\ce{A_{s} -> B_{s} + C_{g}} \label{1.1}\]
де A s - вихідний порошкоподібний твердий реагент, що утворює плоский шар, B s - твердий продукт реакції, розташований на зернятках вихідного реагенту, а C g - газоподібний продукт реакції, що виділяється в навколишнє середовище. Цей процес називають квазіодностадійним, тому що реакції типу Equation\ ref {1.1} мають щонайменше три стадії і включають в себе хімічну реакцію, тепло- і масообмін. Однак, залежно від умов експерименту, один з етапів може бути обмежуючим. У нашому випадку ми вважаємо, що хімічна реакція є етапом обмеження швидкості. Припустимо, що залежність цього процесу від часу і температури - це одномодова термоаналітична крива.
Для такого процесу зміна швидкості реакції в залежності від температури можна описати наступним чином:
\[-\frac{d \alpha}{d t}=A e^{\frac{-E}{R T}} f(\alpha) \label{1.2}\]
де A і E - параметри Арренія, T - температура, а f (α) - деяка функція перетворення реакції, що характеризує її механізм.
Перетворення\(\alpha\), згідно з Equation\ ref {1.1}, визначається як частка вихідного реагенту A s, який відреагував за часом t i і змінюється від 0 до 1. Варто відзначити, що перетворення\(\alpha\) можна обчислити як за даними ТГ і ДСК, так і за даними диференціальної термогравіметрії (ДТГ).
Так звані неізотермічні кінетичні методи широко використовуються завдяки очевидній простоті обробки експериментальних даних за формальною кінетичною моделлю, описаною Equation\ ref {1.2}. Рівняння\ ref {1.2} характеризує єдину криву вимірювання.
Що стосується експериментальних даних ТА, кінетична модель може бути представлена в наступному вигляді:
\[-\frac{\mathrm{d} \alpha}{\mathrm{d} T_{T=T_{i}}}=\frac{A}{\beta_{i}} \exp \left(-\frac{E}{R T}\right) \alpha_{i}^{m}\left(1-\alpha_{i}\right)^{n} \label{1.3}\]
де (1 - α i) - експериментально виміряна ступінь незавершеності реакції, T i - поточна температура в кельвінів (К),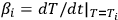 - миттєва швидкість нагріву (в нашому експерименті β i = β = постійна), А - преекспоненціальний коефіцієнт, Е - енергія активації, m і n - параметр кінетичного рівняння [1].
- миттєва швидкість нагріву (в нашому експерименті β i = β = постійна), А - преекспоненціальний коефіцієнт, Е - енергія активації, m і n - параметр кінетичного рівняння [1].
Рівняння\ ref {1.3} легко лінеаризується:
\[\ln \left(-\frac{\mathrm{d} \alpha}{\mathrm{d} T}_{T=T_{i}}\right)=\ln \left(\frac{A}{\beta_{i}}\right)-\frac{E}{R T_{i}}+m \cdot \ln \alpha_{i}+n \cdot \ln \left(1-\alpha_{i}\right) \label{1.4}\]
тобто зводиться до лінійної задачі найменших квадратів.
Задача про найменші квадрати для Equation\ ref {1.4} зводиться до розв'язання наступного набору рівнянь:
\[C \vec{x}=\vec{b} \label{1.5}\]
де C - матриця коефіцієнтів рівняння\ ref {1.4} (C i1 = 1/β i, C i2 = -1/ T i, C i3 = lnα i, C i4 = ln (1-α)), і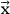 вектор шуканих параметрів. Оскільки експериментальні дані є випадковими числами, вони визначаються з певною похибкою.
вектор шуканих параметрів. Оскільки експериментальні дані є випадковими числами, вони визначаються з певною похибкою.
Розв'язування задачі в Equation\ ref {1.5} пов'язане з певними труднощами.
Значення 1/ Т змінюється незначно в температурному діапазоні реакції, тому перший і другий стовпці матриці С практично ідентичні (аж до постійного множника), і в результаті матриця С майже вироджується. Детальний опис цієї проблеми можна знайти в. Для мінімізації невизначеності слід провести кілька експериментів з різною швидкістю нагріву та розрахувати кінетичні параметри, використовуючи всі експериментальні дані.
Наведені вище аргументи говорять лише про те, що розрахунок параметрів Арреніуса за допомогою однієї термоаналітичної кривої невірний. Програмне забезпечення Netzsch Termokinetics використовує інший підхід, коли параметри Arrhenius оцінюються за допомогою безмодельних методів розрахунку відповідно до серії експериментів при різних швидкостях нагріву (див. Нижче).
Розв'язана таким чином обернена кінетична задача не гарантує адекватного опису експериментальних даних. Для перевірки адекватності рішення необхідно вирішити пряму задачу, тобто інтегрувати Equation\ ref {1.3} і порівняти розрахункові та експериментальні залежності у всьому діапазоні швидкостей нагріву. Ця процедура була реалізована в пакетах програм NETZSCH Termokinetics, Peak Separation та Thermal Simulation за допомогою NETZSCH. Ці програми та їх застосування докладно розглянуті нижче.
Спільна обробка експериментальних результатів, отриманих при різних швидкостях нагріву, обумовлює необхідність сталості механізму того чи іншого процесу, тобто сталості функції типу f (α) при різних швидкостях нагріву. Чи виконується ця умова, можна перевірити афінним перетворенням експериментальних кривих, тобто за допомогою зменшених координат. Для цього слід вибрати змінні на абсцисі і ординаті, щоб кожна з них змінювалася незалежно від розглянутого процесу. Крім того, бажано, щоб співвідношення між вибраними змінними і експериментальними значеннями було простим. Цим вимогам відповідають зменшені координати. Знижена величина визначається як відношення деякої змінної експериментальної величини до іншої експериментальної величини такої ж природи. В якості однієї зі змінних використовується перетворення α, яке визначається як частка початкової кількості реагенту, що перетворився в даний момент часу. У гетерогенній кінетиці ця змінна - це, як правило, перетворення вихідного твердого реагенту.
Якщо необхідно відобразити залежність між перетворенням і часом або температурою в термоаналітичному експерименті (при різних швидкостях нагріву), то в якості ординати використовується α і зменшена величина, що дорівнює відношенню поточного часу t або температури T відповідному цьому часу часу t α * потрібно для досягнення потрібного перетворення. Наприклад, якщо обраний час або температура, необхідні для досягнення 50 або 90% перетворення (α * = 0,5 або 0,9), зменшені кількості становитимуть т/т 0,5 (T/T 0,5) або т/т 0,9 (T/T 0,9).
Вищевказаний формалізм відноситься до хімічної стадії гетерогенного процесу [4,5]. Однак слід враховувати, що в загальному випадку неоднорідний процес може включати тепло- і масообміну, тобто процес ніколи не може бути строго одноетапним. Багатоступінчастий характер процесу значно ускладнює вирішення кінетичної задачі. У цьому випадку слід розв'язати набір не менше трьох диференціальних рівнянь з частинними похідними, що часто робить задачу нерозв'язною. У той же час можна знайти експериментальні умови, при яких одна з стадій, найчастіше, хімічна стадія, була б стадією, що обмежує швидкість процесу. Такі експериментальні умови виявляються в спеціальному кінетичному експерименті.
