3.2: Хімічна іонізація
- Page ID
- 26293
Хімічна іонізація (1, 2)
Хімічна іонізація (CI) - це техніка м'якої іонізації, яка виробляє іони з невеликою надлишковою енергією. В результаті в масовому спектрі спостерігається менша фрагментація. Оскільки це збільшує велику кількість молекулярного іона, техніка є безкоштовною до 70 еВ EI. КІ часто використовується для перевірки молекулярної маси невідомого. Для експериментів CI потрібні лише незначні модифікації області джерела EI.
При хімічній іонізації джерело укладено в невелику комірку з отворами для електронного пучка, газу реагенту і зразка. Газ-реагент додається в цю комірку при тиску приблизно 10 Па (0,1 торр). Це вище тиску 10 -3 Па (10 -5 торр), характерного для джерела мас-спектрометра. При 1 0 -3 Па середній вільний шлях між зіткненнями становить приблизно 2 метри, а реакції іонно-молекули малоймовірні. Однак у джерелі СІ середній вільний шлях між зіткненнями становить лише 10 -4 метри, а молекули аналіту зазнають багатьох зіткнень з газом-реагентом. Газ реагенту в джерелі СІ іонізується електронним пучком для отримання хмари іонів. Газові іони реагенту в цій хмарі реагують і виробляють іони аддукту, як\(\mathrm{CH}_{5}^{+}\) (рис.\(\PageIndex{1}\)), які є чудовими донорами протонів.
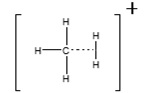
Коли молекули аналіту вводяться в область джерела з цією хмарою іонів, іони газу реагенту здають протон молекулі аналіту і виробляють іони аддукту, [M+H] +. Енергетика переносу протонів контролюється за допомогою різних реагентних газів. Найбільш поширеними реагентними газами є метан, ізобутан і аміак. Метан є найсильнішим донором протонів, який зазвичай використовується із спорідненістю протонів (ПА) 5,7 еВ. Для більш м'якої іонізації часто використовують ізобутан (ПА 8,5 еВ) і аміак (ПА 9,0 еВ). Кислотна основа хімії корисна для опису цих хімічних реакцій іонізації. Газ реагенту повинен бути досить сильною кислотою Brønsted, щоб перенести протон в аналіт. Фрагментація мінімізується в КІ за рахунок зменшення кількості надлишкової енергії, що виробляється реакцією. Оскільки іон аддукту має мало надлишкової енергії і є відносно стабільним, CI дуже корисний для визначення молекулярної маси. Деякі типові реакції в джерелі СІ показані на рис\(\PageIndex{2}\).
\[\begin{gathered} \mathrm{CH}_{4}+\mathrm{e}^{-} → \mathrm{CH}_{4}^{+} + 2 \mathrm{e}^{-} \end{gathered} \nonumber \]
Б) Реакція газових іонів реагентів з утворенням аддуктів:
\[\begin{gathered} \mathrm{CH}_{4}^{+}+\mathrm{CH}_{4} → \mathrm{CH}_{3} + \mathrm{CH}_{5}^{+} \\ \mathrm{OR} \\ \mathrm{CH}_{4}^{+} → \mathrm{CH}_{3}^{+} + \mathrm{H} \\ \mathrm{CH}_{3}^{+}+\mathrm{CH}_{4} → \mathrm{C}_{2} \mathrm{H}_{5}^{+}+\mathrm{H}_{2} \end{gathered} \nonumber \]
C) Реакція газових іонів реагентів з молекулами аналіту:
\[\begin{gathered} \mathrm{CH}_{5}^{+}+\mathrm{M} → \mathrm{CH}_{4} + \mathrm{MH}^{+} \\ \mathrm{C}_{2} \mathrm{H}_{5}^{+}+\mathrm{M} → \mathrm{C}_{2} \mathrm{H}_{4}+\mathrm{MH}^{+} \\ \mathrm{CH}_{3}^{+}+\mathrm{M} → \mathrm{CH}_{4} + (\mathrm{M-H})^{+} \end{gathered} \nonumber \]
Посилання
- Мансон, Б. анал. Хім. 1977, 49, 772А-778А.
- Мансон, Б.; Філд, Ф. Хім. Соц., 1966, 88, 2621-2630.