3.1: Іонізація електронів
- Page ID
- 26270
Іонізація електронами
Електронна іонізація (EI) є найбільш поширеним методом іонізації, що використовується для мас-спектрометрії. * EI добре працює для багатьох молекул газової фази, але він має деякі обмеження. Хоча масові спектри дуже відтворюються і широко використовуються для спектральних бібліотек, ЕІ викликає велику фрагментацію, так що молекулярний іон не спостерігається для багатьох сполук. Фрагментація корисна тим, що надає структурну інформацію для інтерпретації невідомих спектрів. Шаблони фрагментації більш детально розглянуті в розділі «Інтерпретація».
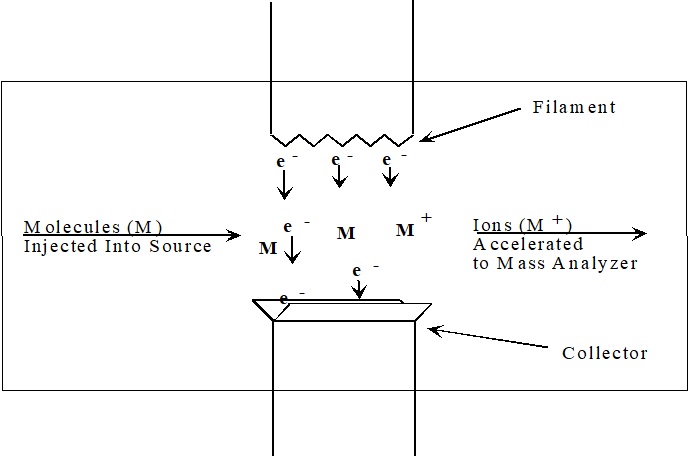
Малюнок\(\PageIndex{1}\): Джерело іонізації електронів
Електрони, що використовуються для іонізації, виробляються шляхом пропускання струму через дротяну нитку (рис.\(\PageIndex{1}\)). Кількість струму контролює кількість електронів, що випромінюються ниткою розжарювання. Електричне поле прискорює ці електрони по всій області джерела, утворюючи пучок електронів високої енергії. Коли молекула аналіту проходить через цей електронний пучок, електрон валентної оболонки може бути видалений з молекули для отримання іона.
Іонізація не відбувається шляхом захоплення електронів, що сильно залежить від молекулярної структури. Натомість EI виробляє позитивні іони, збиваючи валентний електрон з молекули аналіту (рис.\(\PageIndex{2}\)). Коли електрон проходить близько до молекули, негативний заряд електрона відштовхує і спотворює електронну хмару, що оточує молекулу. Це спотворення передає кінетичну енергію від швидко рухається електрона до електронної хмари молекули. Якщо процес передасть достатню кількість енергії, молекула викине валентний електрон і утворює радикальний катіон M •+.
Оскільки іонізація виробляється одним електроном, який прискорюється до 70 В, це прийнято називати 70 еВ ЕІ. ** Цього достатньо енергії, щоб викликати велику фрагментацію, і на цьому рівні невеликі зміни енергії електронів суттєво не впливають на фрагментаційні структури. Кількість енергії, що передається під час цього процесу, залежить від того, наскільки швидко рухається електрон і наскільки близько він проходить до молекули. У більшості 70 еВ EI експериментів приблизно 1400 кДж (15 еВ) енергії передається в процесі іонізації. Існує, однак, розподіл енергії і до деяких молекул передається цілих 2800 кДж (30 еВ). Оскільки для іонізації більшості органічних сполук потрібно приблизно 960 кДж/моль (10 еВ) енергії, а типова енергія хімічного зв'язку становить 290 кДж/моль (3 еВ), велика фрагментація часто спостерігається в масових спектрах 70 еВ EI. Розподіл енергії, що передається під час іонізації, і велика кількість шляхів фрагментації призводить до отримання різноманітних продуктів для даного аналіту. Інші електронні напруги можуть бути використані для зміни величини фрагментації, що утворюється під час іонізації. Для більшості органічних сполук порогова енергія для ЕІ становить близько 20 еВ.
Оскільки масовий спектр виробляється шляхом іонізації багатьох молекул, спектр є розподілом можливих іонів продукту. Інтактні молекулярні іони спостерігаються з іонів, що виробляються з невеликою надлишком енергії. Інші молекулярні іони утворюються з більшою енергією і піддаються фрагментації в області джерела. Велика кількість одержуваних фрагментів, часто званих іонами продуктів, визначається кінетикою шляхів фрагментації і енергією іонізації. Зміна енергії іонізації змінює спостережуваний розподіл іонів фрагмента. Цей розподіл надає структурну інформацію для інтерпретації масових спектрів і детально розглядається в розділі про інтерпретацію.
* Деякі старі літератури будуть називати EI як вплив електронів, але цей термін не вважається точним. Електронна іонізація - це прийнятий в даний час термін.
** Одиницею СІ для енергії є Джоуль. Енергетика хімічних реакцій зазвичай виражається в кілоджоулі на моль. У багатьох експериментах з газовою фазою (як мас-спектрометрія) моль не є зручною одиницею. Електронвольт часто використовується як одиниця енергії для одиночних молекул або атомів. 1 еВ = 1,60217733 (49) х 10 -19 Дж. Так що: 1 еВ (на молекулу або атом) = 96,4152206 кДж/моль.