10.6: Фотолюмінесцентна спектроскопія
- Page ID
- 24979
Фотолюмінесценція ділиться на дві категорії: флуоресценція і фосфоресценція. Пара електронів, які займають однаковий електронний стан заземлення, мають протилежні спини і перебувають у стані синглетного спина (Рисунок Template:index a).
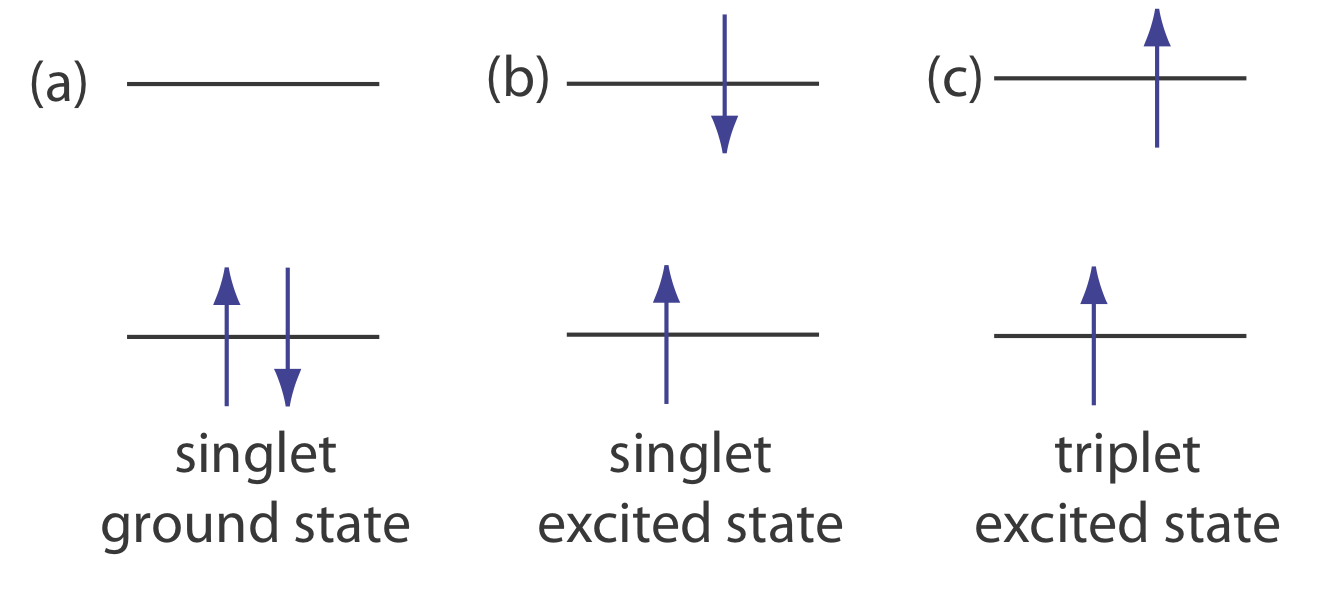
Коли аналіт поглинає ультрафіолет або видимий фотон, один з його валентних електронів переходить з основного стану в збуджений стан зі збереженням спіна електрона (рис. Template:index b). Випромінювання фотона з синглетного збудженого стану до синглетного стану землі - або між будь-якими двома рівнями енергії з однаковим спіном - називається флуоресценцією. Імовірність флуоресценції дуже висока і середній час життя електрона в збудженому стані становить лише 10 —5 —10 —8 с. флуоресценція, отже, швидко розпадається після видалення джерела збудження.
У деяких випадках електрон у синглетному збудженому стані перетворюється на триплетний збуджений стан (рис. Template:index c), в якому його спін більше не парний з основним станом. Емісія між триплетним збудженим станом і синглетним станом землі - або між будь-якими двома енергетичними рівнями, які відрізняються у відповідних спінових станах - називається фосфоресценцією. Оскільки середній термін служби фосфоресценції коливається в межах 10-4 —10 4 с, фосфоресценція може тривати протягом деякого часу після видалення джерела збудження.
Використання молекулярної флуоресценції для якісного аналізу та напівкількісного аналізу датується початком-серединою 1800-х років, з більш точними кількісними методами, що з'явилися в 1920-х роках. Прилади для флуоресцентної спектроскопії з використанням фільтра або монохроматора для вибору довжини хвилі з'явилися, відповідно, в 1930-х і 1950-х роках. Хоча відкриття фосфоресценції передувало флуоресценції майже 200 років, якісне та кількісне застосування молекулярної фосфоресценції не приділяло великої уваги лише після розробки приладів флуоресценції.
Як і слід було очікувати, стійкість довгоживучої фосфоресценції зробила її більш помітною.
Спектри флуоресценції та фосфоресценції
Щоб оцінити походження флуоресценції та фосфоресценції, ми повинні розглянути, що відбувається з молекулою після поглинання фотона. Припустимо, що спочатку молекула займає найнижчий коливальний енергетичний рівень свого електронного стану землі, який є синглетним станом з позначкою S 0 на рисунку Template:index. Поглинання фотона збуджує молекулу до одного з декількох коливальних енергетичних рівнів в першому збудженому електронному стані, S 1, або другому електронному збудженому стані, S 2, обидва з яких є синглетними станами. Релаксація до стану землі відбувається цілим рядом механізмів, деякі з яких призводять до випромінювання фотона, а інші, що відбуваються без випромінювання фотона. Ці механізми релаксації показані на рисунку Template:index. Найбільш вірогідний шлях розслаблення від будь-якого збудженого стану - це той, який має найкоротший термін життя.

Безрадіаційна дезактивація
Коли молекула розслабляється, не випромінюючи фотон, ми називаємо процес безрадіаційної дезактивацією. Одним із прикладів безрадіаційної деактивації є вібраційна релаксація, при якій молекула в збудженому коливальному енергетичному рівні втрачає енергію, переходячи на більш низький рівень вібраційної енергії в тому ж електронному стані. Вібраційна релаксація дуже швидка, із середнім терміном життя <10 —12 с Оскільки вібраційна релаксація настільки ефективна, молекула в одному з вищих коливальних енергетичних рівнів збудженого стану швидко повертається до найнижчого коливального енергетичного рівня збудженого стану.
Іншою формою безрадіаційної деактивації є внутрішнє перетворення, при якому молекула в грунті коливального рівня збудженого стану переходить безпосередньо в більш високий коливальний енергетичний рівень нижчого енергетичного електронного стану того ж спінового стану. Шляхом поєднання внутрішніх перетворень і коливальних розслаблень молекула в збудженому електронному стані може повернутися в наземний електронний стан, не випромінюючи фотона. Споріднена форма безрадіаційної дезактивації - це зовнішнє перетворення, при якому надлишкова енергія передається розчиннику або іншому компоненту матриці зразка.
Давайте використаємо Figure Template:index, щоб проілюструвати, як молекула може розслабитися до основного стану без випромінювання фотона. Припустимо, наша молекула знаходиться в найвищому коливальному енергетичному рівні другого електронного збудженого стану. Після того, як ряд коливальних релаксацій доводить молекулу до найнижчого коливального енергетичного рівня S 2, вона піддається внутрішньому перетворенню в більш високий коливальний енергетичний рівень першого збудженого електронного стану. Вібраційні релаксації доводять молекулу до найнижчого коливального енергетичного рівня S 1. Після внутрішнього перетворення в більш високий коливальний енергетичний рівень основного стану молекула продовжує піддаватися коливальній релаксації, поки не досягне найнижчого коливального енергетичного рівня S 0.
Кінцевою формою безрадіаційної деактивації є міжсистемний перетин, при якому молекула в землі коливального енергетичного рівня збудженого електронного стану переходить в один з вищих коливальних енергетичних рівнів нижчого енергетичного електронного стану з іншим спіновим станом. Наприклад, міжсистемний перетин показано на малюнку Template:index між синглетним збудженим станом S 1 та триплетним збудженим станом T 1.
Релаксація флуоресценцією
Флуоресценція виникає, коли молекула в збудженому стані найнижчий рівень вібраційної енергії повертається до нижчого енергетичного електронного стану, випромінюючи фотон. Оскільки молекули повертаються до свого основного стану найшвидшим механізмом, флуоресценція спостерігається лише в тому випадку, якщо вона є більш ефективним засобом релаксації, ніж поєднання внутрішніх перетворень і вібраційних релаксацій.
Кількісним вираженням ефективності флуоресценції є флуоресцентний квантовий вихід\(\Phi_f\), який є часткою збуджених молекул стану, які повертаються до основного стану шляхом флуоресценції. Флуоресцентні квантові виходи варіюються від 1, коли кожна молекула в збудженому стані піддається флуоресценції, до 0, коли флуоресценція не відбувається.
Інтенсивність флуоресценції, I f, пропорційна кількості випромінювання, поглиненого зразком, P 0 - P T, і флуоресцентному квантовому виходу
\[I_{f}=k \Phi_{f}\left(P_{0}-P_{\mathrm{T}}\right) \label{10.1}\]
де k - константа, яка становить ефективність збору та виявлення флуоресцентного випромінювання. З закону Пива ми знаємо, що
\[\frac{P_{\mathrm{T}}}{P_{0}}=10^{-\varepsilon b C} \label{10.2}\]
де С - концентрація флуоресцентних видів. Розв'язування рівняння\ ref {10.2} для P T і підстановка в рівняння\ ref {10.1} дає, після спрощення
\[I_{f}=k \Phi_{f} P_{0}\left(1-10^{-\varepsilon b C}\right) \label{10.3}\]
При\(\varepsilon bC\) < 0,01, що часто буває, коли концентрація аналіта мала, Equation\ ref {10.3} спрощує
\[I_{f}=2.303 k \Phi_{f} \varepsilon b C P_{0}=k^{\prime} P_{0} \label{10.4}\]
де k ′ — сукупність констант. Інтенсивність флуоресценції, отже, збільшується зі збільшенням квантової ефективності, падаючої потужності джерела та молярної поглинання та концентрації флуоресцентних видів.
Флуоресценція, як правило, спостерігається, коли найнижче поглинання енергії молекули є\(\pi \rightarrow \pi^*\) переходом, хоча деякі\(n \rightarrow \pi^*\) переходи показують слабку флуоресценцію. Багато незаміщені, негетероциклічні ароматичні сполуки мають сприятливий квантовий вихід флуоресценції, хоча заміни на ароматичному кільці можуть впливати\(\Phi_f\) значно. Наприклад, присутність групи відведення електронів, такої як —NO 2, зменшується\(\Phi_f\), при додаванні електронної донорської групи, такої як —OH, збільшується\(\Phi_f\). Флуоресценція також збільшується для ароматичних кільцевих систем та ароматичних молекул з жорсткими площинними структурами. Рисунок Template:index показує флуоресценцію хініну під УФ-лампою.

На флуоресцентний квантовий вихід молекули також впливають зовнішні змінні, такі як температура та розчинник. Підвищення температури, як правило, зменшується,\(\Phi_f\) оскільки частіші зіткнення між молекулою і розчинником збільшує зовнішню конверсію. Зниження в'язкості розчинника зменшується з аналогічних\(\Phi_f\) причин. Для аналіту з кислотними або основними функціональними групами зміна рН може змінити структуру аналіта та його флуоресцентні властивості.
Як показано на малюнку Template:index, флуоресценція може повернути молекулу до будь-якого з декількох коливальних енергетичних рівнів в наземному електронному стані. Таким чином, флуоресценція виникає в діапазоні довжин хвиль. Оскільки зміна енергії для флуоресцентного випромінювання, як правило, менше, ніж для поглинання, спектр флуоресценції молекули зміщується на більш високі довжини хвиль, ніж спектр її поглинання.
Релаксація фосфоресценцією
Молекула в триплетному електронному збудженому стані найнижчий рівень вібраційної енергії зазвичай розслабляється до основного стану шляхом міжсистемного перетину до синглетного стану або зовнішнім перетворенням. Фосфоресценція виникає, коли молекула розслабляється, випромінюючи фотон. Як показано на малюнку Template:index, фосфоресценція відбувається в діапазоні довжин хвиль, всі з яких мають менші енергії, ніж смуга поглинання молекули. Інтенсивність фосфоресценції задається рівнянням\(I_p\), подібним до Equation\ ref {10.4} для флуоресценції
де\(\Phi_p\) - фосфоресцентний квантовий вихід.
Фосфоресценція найбільш сприятлива для молекул з\(n \rightarrow \pi^*\) переходами, які мають більшу ймовірність міжсистемного перетину, ніж\(\pi \rightarrow \pi^*\) переходи. Наприклад, фосфоресценція спостерігається з ароматичними молекулами, які містять карбонільні групи або гетероатоми. Ароматичні сполуки, які містять атоми галогенідів, також мають більш високу ефективність для фосфоресценції. В цілому збільшення фосфоресценції відповідає зниженню флуоресценції.
Оскільки середній термін служби фосфоресценції може бути досить довгим, починаючи від 10 —4 —10 4 с, квантовий вихід фосфоресценції зазвичай досить малий. Поліпшення\(\Phi_p\) реалізується за рахунок зниження ефективності зовнішнього перетворення. Це досягається декількома способами, включаючи зниження температури, використання більш в'язкого розчинника, осадження зразка на тверду підкладку або захоплення молекули в розчині. На малюнку Template:index показано приклад фосфоресценції.

Збудження проти спектрів випромінювання
Спектри фотолюмінесценції реєструються шляхом вимірювання інтенсивності випромінюваного випромінювання в залежності від довжини хвилі збудження або довжини хвилі випромінювання. Спектр збудження отримують шляхом моніторингу випромінювання на фіксованій довжині хвилі при зміні довжини хвилі збудження. При корекції варіацій інтенсивності джерела та відгуку детектора спектр збудження зразка майже ідентичний спектру поглинання. Спектр збудження забезпечує зручний засіб для вибору найкращої довжини хвилі збудження для кількісного або якісного аналізу.
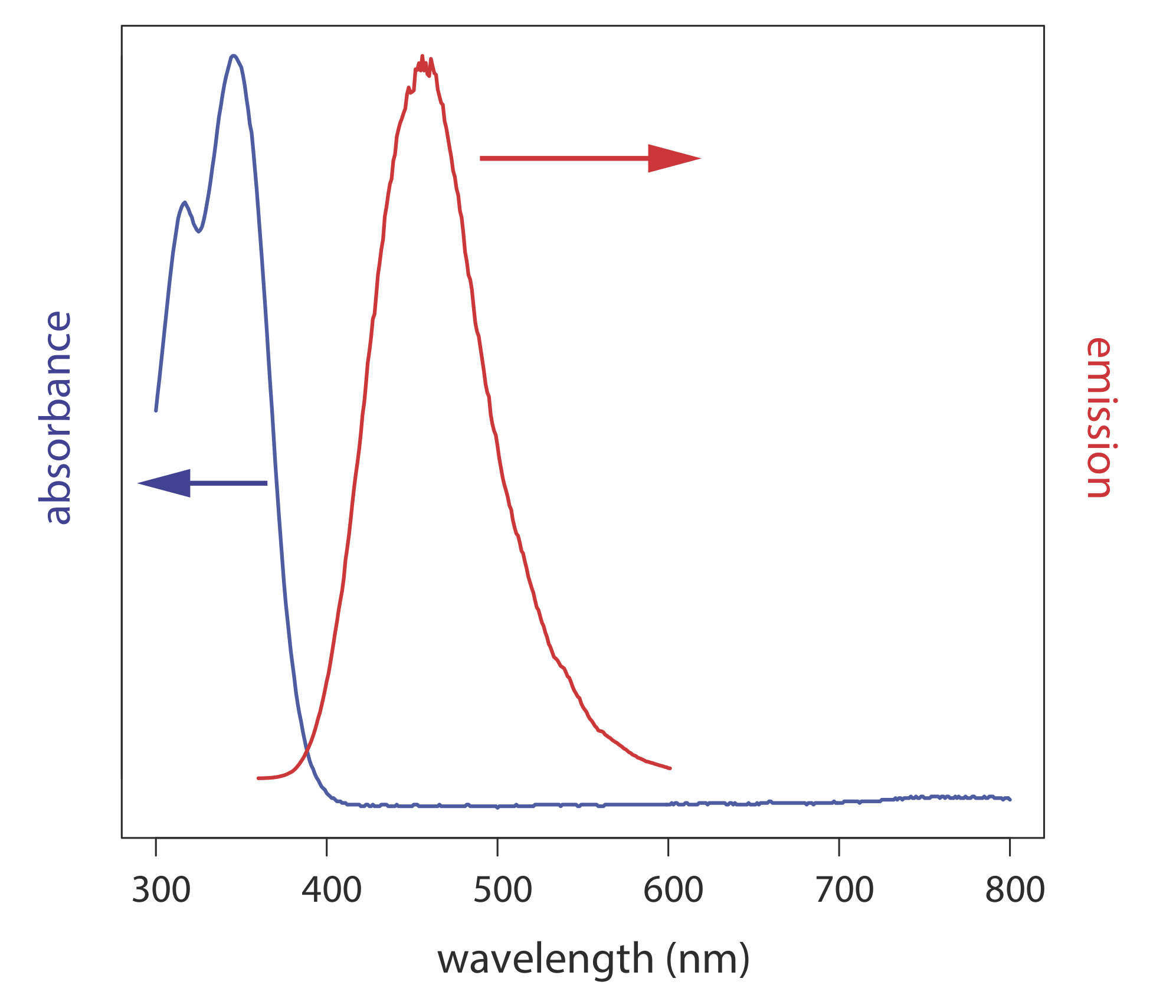
У спектрі випромінювання фіксована довжина хвилі використовується для збудження зразка, а інтенсивність випромінюваного випромінювання контролюється як функція довжини хвилі. Хоча молекула має єдиний спектр збудження, вона має два спектри випромінювання, один для флуоресценції та один для фосфоресценції. Рисунок Template:index показує спектр поглинання УФ та спектр випромінювання УФ-флуоресценції для хініну.
Контрольно-вимірювальні прилади
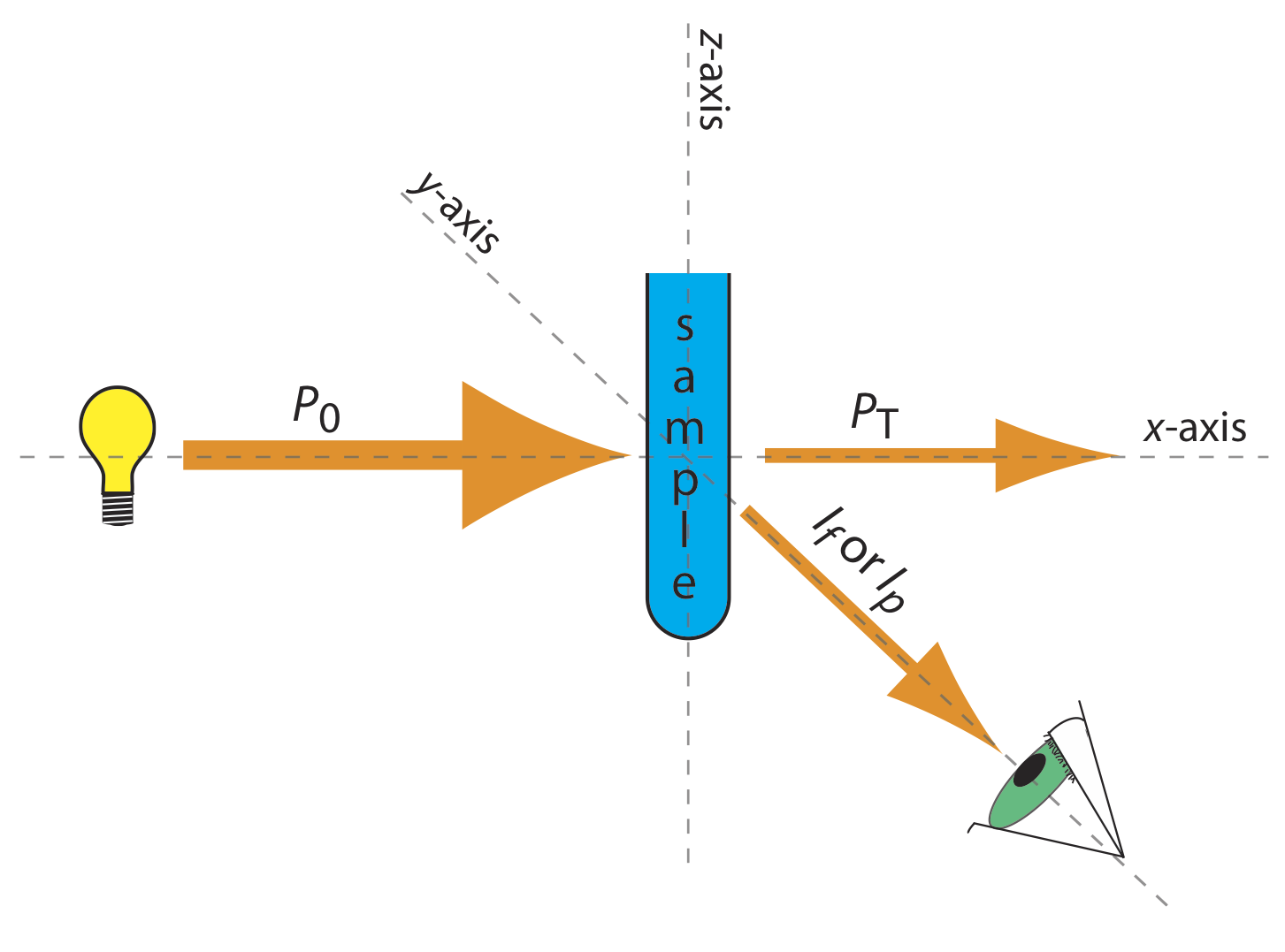
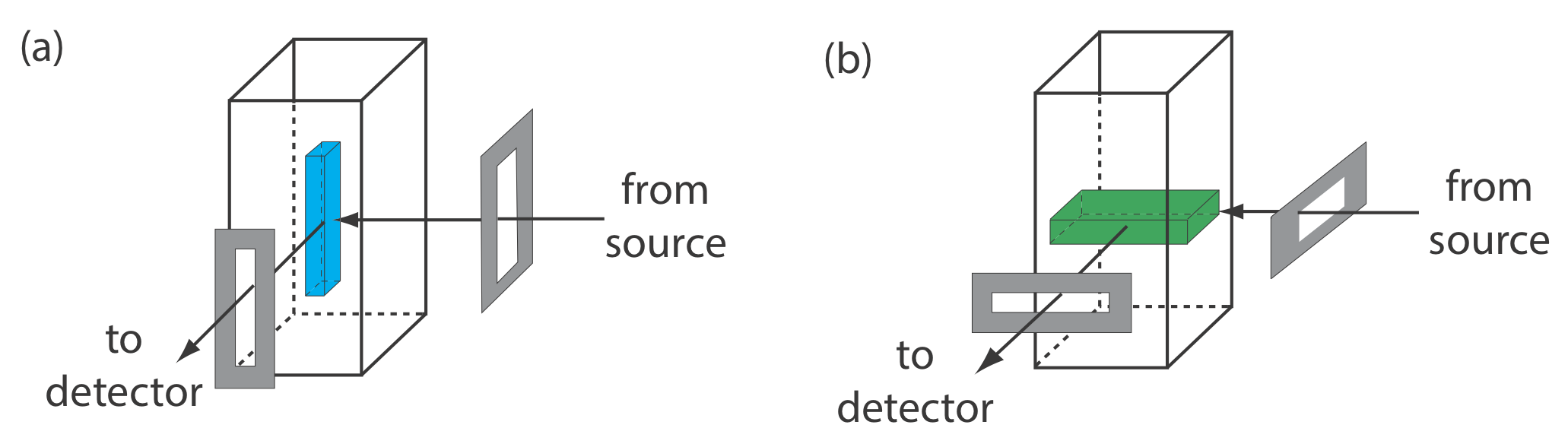
Основні прилади для моніторингу флуоресценції та фосфоресценції - джерела випромінювання, засоби вибору вузької смуги випромінювання та детектора - такі ж, як і для абсорбційної спектроскопії. Унікальні вимоги флуоресценції та фосфоресценції, однак, вимагають деяких модифікацій конструкцій приладів, зазначених раніше на малюнку 10.3.1 (фільтруючий фотометр), рисунок 10.3.2 (однопроменевий спектрофотометр), рисунок 10.3.3 (двопроменевий спектрофотометр) та Малюнок 10.3.4 (спектрометр діодного масиву). Найголовніша відмінність полягає в тому, що датчик не можна розміщувати безпосередньо навпроти джерела. Рисунок Template:index показує, чому це так. Якщо розмістити детектор вздовж осі джерела, він отримує як передане джерело випромінювання, P T, так і люмінесцентне, I f, або фосфоресцентне, I p, випромінювання. Замість цього обертаємо директора і ставимо його на 90 о до джерела.
Прилади для вимірювання флуоресценції
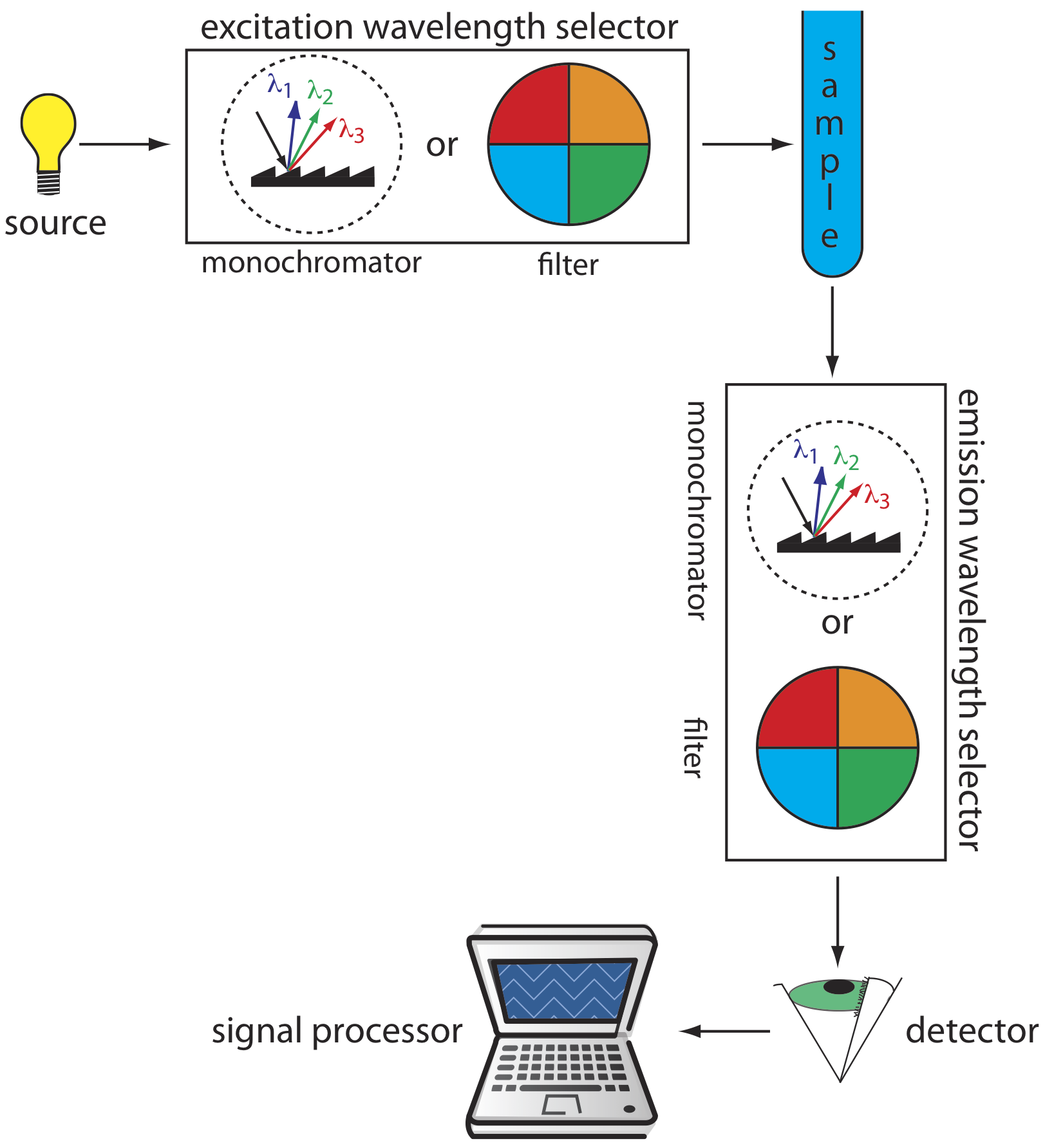
Рисунок Template:index показує базову конструкцію приладу для вимірювання флуоресценції, який включає два селектори довжини хвилі, один для вибору довжини хвилі збудження джерела і один для вибору довжини хвилі випромінювання аналіта. У флуориметрі довжини хвиль збудження та випромінювання вибираються за допомогою фільтрів поглинання або перешкод. Джерелом збудження для флуориметра зазвичай є парова лампа низького тиску Hg, яка забезпечує інтенсивні емісійні лінії, розподілені по всій ультрафіолетовій і видимій області. Коли монохроматор використовується для вибору довжини хвиль збудження та випромінювання, прилад називається спектрофлюорометром. З монохроматором джерелом збудження зазвичай є дугова лампа високого тиску Xe, яка має безперервний спектр випромінювання. Або інструментальна конструкція підходить для кількісної роботи, хоча тільки спектрофлюометр може реєструвати збудження або спектр випромінювання.
Парова лампа Hg має емісійні лінії на 254, 312, 365, 405, 436, 546, 577, 691 і 773 нм.
Клітини зразка для молекулярної флуоресценції аналогічні таким для молекулярного поглинання (див. Рис. Дистанційне зондування за допомогою волоконно-оптичного зонда (див. Рис. 10.3.7) можливо за допомогою флуориметра або спектрофлюометра. Аналіт, який є флуоресцентним, контролюється безпосередньо. Для аналіту, який не є флуоресцентним, відповідна молекула флуоресцентного зонда включена в наконечник волоконно-оптичного зонда. Реакція аналіта з молекулою зонда призводить до збільшення або зменшення флуоресценції.
Прилади для вимірювання фосфоресценції
Прилад для молекулярної фосфоресценції повинен розрізняти фосфоресценцію та флуоресценцію. Оскільки термін служби флуоресценції коротший, ніж для фосфоресценції, дискримінація досягається шляхом включення затримки між збудженням зразка та вимірюванням фосфоресцентного випромінювання. Рисунок Template:index показує, як два позафазові подрібнювачі дозволяють нам блокувати флуоресцентне випромінювання від досягнення детектора, коли зразок збуджується, і запобігати виникненню флуоресценції джерела випромінювання, коли ми вимірюємо фосфоресцентне випромінювання.
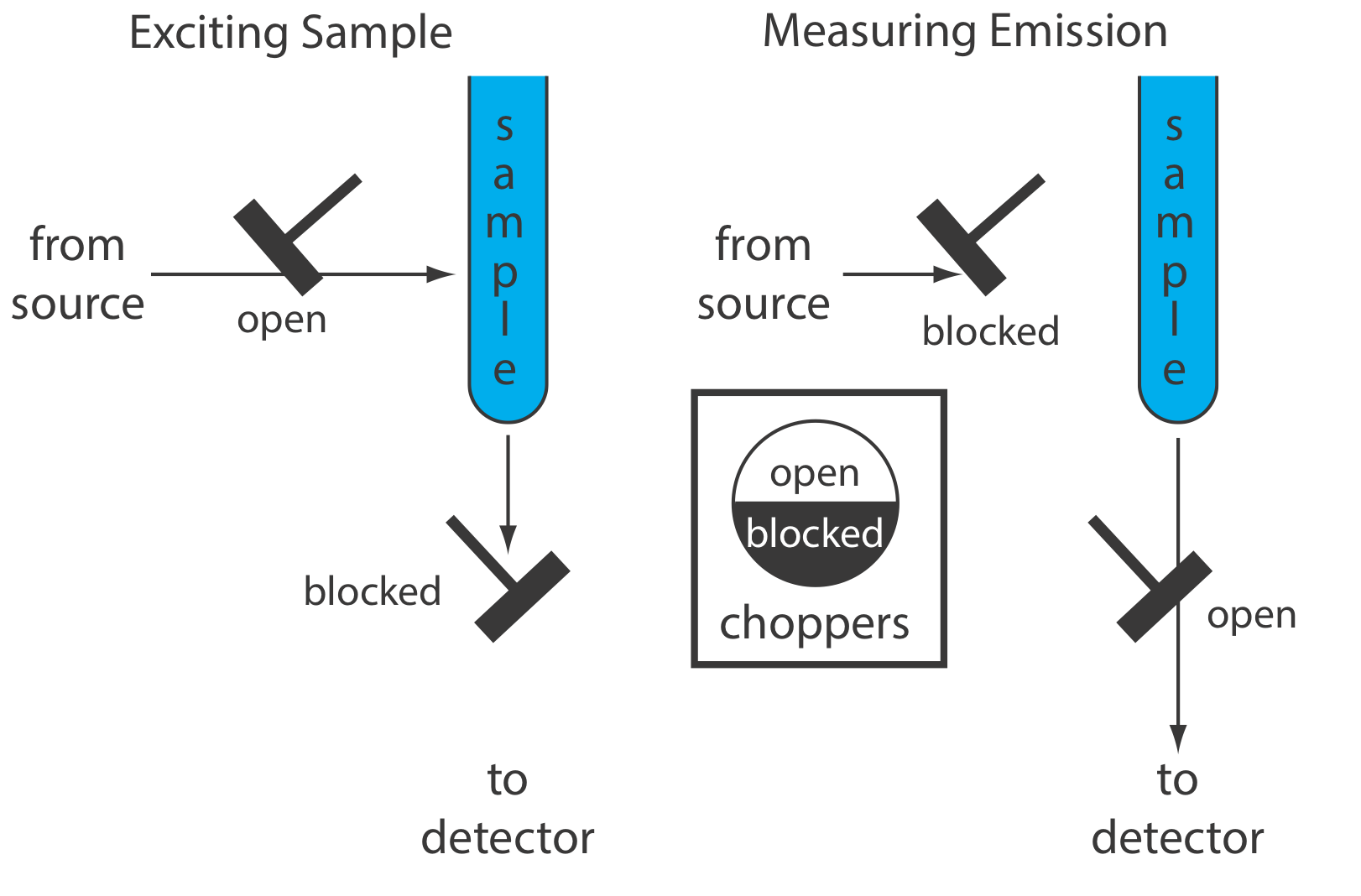
Оскільки фосфоресценція - це такий повільний процес, ми повинні запобігти розслабленню збудженого стану зовнішнім перетворенням. Одним із способів цього є розчинення зразка у відповідному органічному розчиннику, як правило, суміші етанолу, ізопентану та діетилового ефіру. Отриманий розчин заморожують при температурах Liquid-N 2 з утворенням оптично прозорого твердого речовини. Тверда матриця мінімізує зовнішнє перетворення через зіткнення між аналітом і розчинником. Зовнішнє перетворення також зводиться до мінімуму шляхом іммобілізації зразка на твердій підкладці, що робить можливими вимірювання кімнатної температури. Один підхід полягає в тому, щоб помістити краплю розчину, який містить аналіт на невеликий диск фільтрувального паперу. Після висихання зразка під тепловою лампою зразок поміщають в спектрофлюометр для аналізу. Інші тверді субстрати включають силікагель, оксид алюмінію, ацетат натрію та сахарозу. Такий підхід особливо корисний для аналізу тонкошарових хроматографічних пластин.
Кількісні програми
Молекулярна флуоресценція і, в меншій мірі, фосфоресценція використовуються для прямого або непрямого кількісного аналізу аналітів в різних матрицях. Прямий кількісний аналіз можливий, коли флуоресцентний або фосфоресцентний квантовий вихід аналіта сприятливий. Якщо аналіт не є флуоресцентним або фосфоресцирующим, або якщо квантовий вихід несприятливий, то непрямий аналіз може бути здійсненним. Одним із підходів є реакція аналіту з реагентом для утворення продукту, який є флуоресцентним або фосфоресцирующим. Інший підхід полягає у вимірюванні зменшення флуоресценції або фосфорів, коли аналіт додається до розчину, який містить флуоресцентну або фосфоресцентну молекулу зонда. Зниження емісії спостерігається, коли реакція між аналітом і молекулою зонда посилює безрадіаційну дезактивацію або призводить до невипромінюючого продукту. У цьому розділі розглянуто застосування флуоресценції та фосфоресценції до неорганічних та органічних аналітів.
неорганічні аналіти
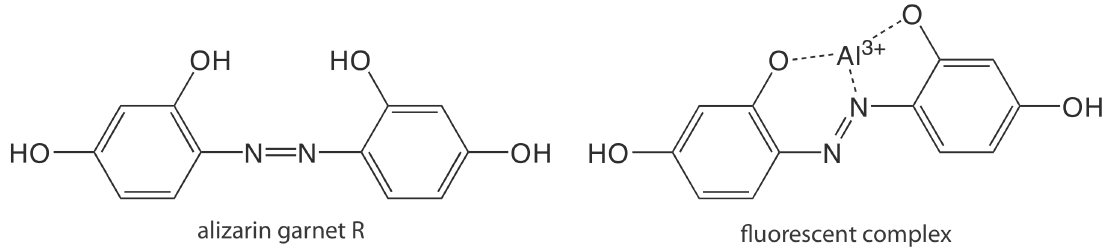
За винятком декількох іонів металів, особливо\(\text{UO}_2^+\), більшість неорганічних іонів недостатньо флуоресцентні для прямого аналізу. Багато іони металів визначаються опосередковано шляхом взаємодії з органічним лігандом з утворенням флуоресцентного або, рідше, фосфоресцентного комплексу метал-ліганд. Одним із прикладів є реакція Al 3 + з натрієвою сіллю 2, 4, 3′-тригідроксиазобензен-5′-сульфонової кислоти - також відомої як алізарин гранат R - який утворює флуоресцентний комплекс метал-ліганд (Рисунок Template:index). Аналіз проводиться з використанням довжини хвилі збудження 470 нм, при цьому флуоресценція контролюється при 500 нм. У таблиці Template:index наведено додаткові приклади хелатних реагентів, які утворюють флуоресцентні комплекси метал-ліганд з іонами металів. Кілька неорганічних неметалів визначаються їх здатністю знижувати або гасити флуоресценцію іншого виду. Одним із прикладів є аналіз для F - на основі його здатності гасити флуоресценцію комплексу граната Al 3 + -алізарину.
| хелатуючий агент | іони металів |
|---|---|
|
8-гідроксихінолін |
Al 3 +, Be 2+, Zn 2 +, Li +, Mg 2 + (та інші) |
|
флавональний |
Зр 2 +, Сн 4 + |
| бензоїн | \(\text{B}_4\text{O}_6^{2-}\), Зн 2 + |
| \(2^{\prime},3^{\prime},4^{\prime},5,7-\text{pentahydroxylflavone}\) | Бути 2+ |
|
2- (о -гідроксифеніл) бензоксазол |
Кд 2 + |
Органічні аналіти
Як зазначалося раніше, органічні сполуки, які містять ароматичні кільця, як правило, є флуоресцентними, а ароматичні гетероцикли часто є фосфоресцентними. У таблиці Template:index наведено приклади кількох важливих біохімічних, фармацевтичних та екологічних сполук, які кількісно аналізуються за допомогою флуориметрії або фосфориметрії. Якщо органічний аналіт не є природним флуоресцентним або фосфоресцентним, можливо, його можна включити в хімічну реакцію, яка виробляє флуоресцентний або фосфоресцентний продукт. Наприклад, фермент креатинфосфокінази визначається шляхом його використання для каталізації утворення креатину з фосфокреатину. Реакція креатину з нінгідрином виробляє флуоресцентний продукт невідомої структури.
| клас | сполуки (F = флуоресценція, P = фосфоресценція) |
|---|---|
| ароматичні амінокислоти |
фенілаланін (F) тирозин (F) триптофан (F, P) |
|
вітаміни |
вітамін А (F) вітамін В2 (F) вітамін В6 (F) вітамін В12 (F) вітамін Е (F) фолієва кислота (F) |
|
катехоламіни |
дофамін (F) норадреналін (F) |
|
фармацевтика і лікарські засоби |
хінін (F) саліцилова кислота (F, P) морфін (F) барбітурати (F) ЛСД (Ф) кодеїн (P) кофеїн (P) сульфаніламід (Р) |
|
забруднювачі навколишнього середовища |
пірен (F) бензо [а] пірен (F) органотіофосфорні пестициди (F) карбаматні інсектициди (F) ДДТ (Р) |
Стандартизація методу
З Equation\ ref {10.4} і Equation\ ref {10.5} ми знаємо, що інтенсивність флуоресценції або фосфоресценції є лінійною функцією концентрації аналіта за умови, що поглинання зразка вихідного випромінювання (\(A = \varepsilon bC\)) менше приблизно 0,01. Калібрувальні криві часто є лінійними на чотири-шість порядків величини для флуоресценції та понад два-чотири порядки для фосфоресценції. Для більш високих концентрацій аналіту калібрувальна крива стає нелінійною, оскільки припущення, що призвели до Equation\ ref {10.4} та Equation\ ref {10.5}, більше не застосовуються. Нелінійність може спостерігатися при менших концентраціях аналітних флуоресцентних або фосфоресцентних забруднень. Як обговорювалося раніше, квантова ефективність чутлива до температури та матриці зразків, обидві з яких повинні бути контрольовані при використанні зовнішніх стандартів. Крім того, інтенсивність випромінювання залежить від молярної поглинання фотолюмінесцентного виду, чутливого до матриці зразка.
Представницький метод 10.6.1: Визначення хініну в сечі
Найкращий спосіб оцінити теоретичні та практичні деталі, розглянуті в цьому розділі, - це уважно вивчити типовий аналітичний метод. Хоча кожен метод унікальний, наступний опис визначення хініну в сечі дає повчальний приклад типової процедури. Опис тут засновано на Муле, С.Дж.; Хушині, П.Л. анал. Хім. 1971, 43, 708—711, і О'Рейлі, Дж. Е.; Дж. Едук. 1975, 52, 610-612. Рисунок Template:index показує флуоресценцію хініну в тонізуючій воді.
Опис методу
Хінін - алкалоїд, який використовується для лікування малярії. Являє собою сильно флуоресцентне з'єднання в розведених розчинами H 2 SO 4 (\(\Phi_f = 0.55\)). Спектр збудження хініну має смуги поглинання на 250 нм і 350 нм, а його спектр випромінювання має єдину смугу випромінювання при 450 нм. Хінін швидко виводиться з організму з сечею і визначається шляхом вимірювання його флуоресценції після його вилучення з зразка сечі.
Порядок дій
Перенесіть 2,00-мл зразка сечі в 15-мл пробірку і використовуйте 3,7 М NaOH, щоб відрегулювати його рН до 9 і 10. Додайте 4 мл суміші хлороформу та ізопропанолу 3:1 (в/в) і струсіть вміст пробірки протягом однієї хвилини. Дозвольте органічному та водному (сечі) шарам відокремити та перенести органічну фазу в чисту пробірку. Додайте 2,00 мл 0,05 M H 2 SO 4 до органічної фази і струсіть вміст протягом однієї хвилини. Дозвольте органічному та водному шарам відокремити та перенести водну фазу в клітинку зразка. Виміряйте флуоресцентне випромінювання при 450 нм, використовуючи довжину хвилі збудження 350 нм. Визначають концентрацію хініну в пробі сечі за допомогою набору зовнішніх норм в 0,05 М Н 2 SO 4, приготованого з 100,0 проміле розчину хініну в 0,05 M H 2 SO 4. В якості заготовки використовуйте дистильовану воду.
Питання
1. Хлорид-іон гасить інтенсивність флуоресцентного випромінювання хініну. Наприклад, за наявності 100 ppm NaCl (61 ppm Cl —) інтенсивність викиду хініну становить лише 83% від інтенсивності його емісії за відсутності хлориду. Наявність 1000 ppm NaCl (610 ppm Cl —) додатково знижує флуоресцентну емісію хініну до менш ніж 30% інтенсивності його емісії за відсутності хлориду. Концентрація хлориду в сечі зазвичай коливається в межах 4600—6700 ppm Cl —. Поясніть, як ця процедура запобігає втручанню хлориду.
У процедурі використовується два вилучення. У першому з цих екстракцій хінін відокремлюють від сечі шляхом екстракції його в суміш хлороформу і ізопропанолу, залишаючи іон хлориду позаду в вихідному зразку.
2. Зразки сечі можуть містити невелику кількість інших флуоресцентних сполук, які будуть заважати аналізу, якщо їх проводити через два екстракції. Поясніть, як можна змінити процедуру, щоб врахувати це?
Одним із підходів є підготовка заготовки, яка використовує зразок сечі, який, як відомо, не містить хініну. Віднімання флуоресцентного сигналу бланка з виміряної флуоресценції із зразків сечі коригує інтерференційні сполуки.
Флуоресцентне випромінювання для хініну при 450 нм може бути індуковано за допомогою частоти збудження 250 нм або 350 нм. Флуоресцентна квантова ефективність однакова для будь-якої довжини хвилі збудження. Спектр поглинання хініну показує,\(\varepsilon_{250}\) що більше, ніж\(\varepsilon_{350}\). Враховуючи, що хінін має більш сильне поглинання при 250 нм, поясніть, чому його інтенсивність флуоресцентного випромінювання більша при використанні 350 нм в якості довжини хвилі збудження.
З Рівняння\ ref {10.4} ми знаємо, що I f є функцією наступних членів: k\(\Phi_f\),, P 0\(\varepsilon\),, b і C. Ми знаємо\(\Phi_f\), що b і C однакові для обох довжин хвиль збудження, і\(\varepsilon\) це більше для довжини хвилі 250 нм; отже, ми можемо ігнорувати ці терміни. Більша інтенсивність випромінювання при використанні довжини хвилі збудження 350 нм повинна бути обумовлена більшим значенням для Р 0 або k. Насправді P 0 при 350 нм для дугової лампи високого тиску Xe становить близько 170% від цього при 250 нм. Крім того, чутливість типового фотомультиплікатора детектора (що сприяє значенню k) при 350 нм становить близько 140% від такої при 250 нм.
Для оцінки методу, описаного в репрезентативному методі 10.6.1, підготовлено та проаналізовано ряд зовнішнього стандарту, надаючи результати, наведені в наступній таблиці. Всі флуоресцентні інтенсивності коригуються за допомогою заготовки, приготовленої з зразка сечі без хініну. Флуоресцентні інтенсивності нормалізуються шляхом встановлення I f для найвищого стандарту концентрації до 100.
| [хінін] (мкг/мл) | I ф |
|---|---|
| 1.00 | 10.11 |
| 3.00 | 30.20 |
| 5.00 | 49.84 |
| 7.00 | 69.89 |
| 10.00 | 100.0 |
Після прийому 10,0 мг хініну волонтер надає зразок сечі через 24 години. Аналіз зразка сечі дає відносну інтенсивність викиду 28,16. Повідомте про концентрацію хініну в зразку в мг/л і відсоток відновлення для прийнятого хініну.
Рішення
Лінійна регресія відносної інтенсивності випромінювання в порівнянні з концентрацією хініну в стандартах дає калібрувальну криву, наведену нижче, і наступне калібрувальне рівняння.
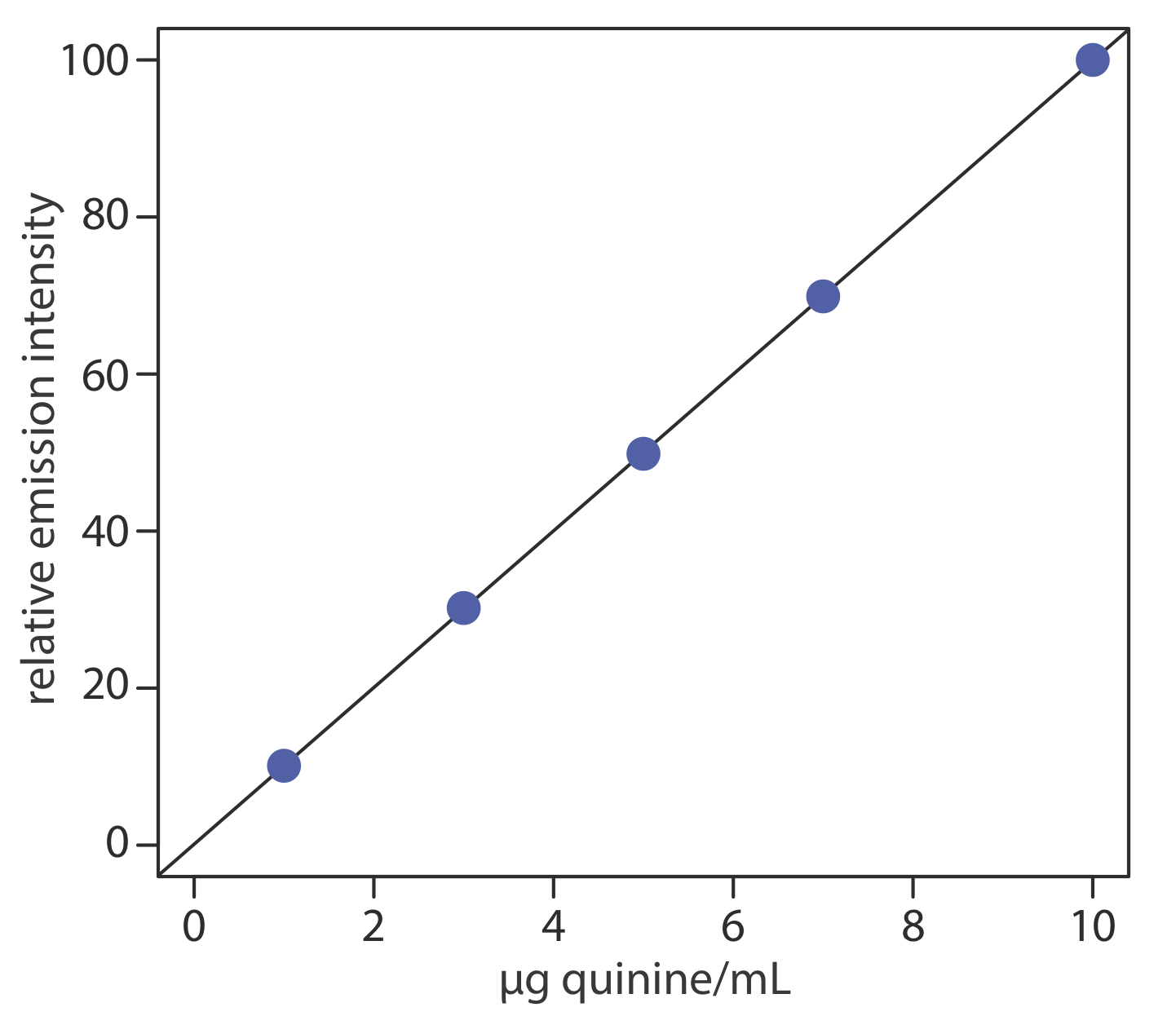
\[I_{f}=0.122+9.978 \times \frac{\mathrm{g} \text { quinine }}{\mathrm{mL}} \nonumber\]
Підстановка відносної інтенсивності випромінювання зразка в калібрувальне рівняння дає концентрацію хініну як 2,81 мкг/мл. Оскільки обсяг взятої сечі, 2,00 мл, такий же, як об'єм 0,05 M H 2 SO 4, який використовується для вилучення хініну, концентрація хініну в сечі також становить 2,81 мкг/мл. Відновлення проковтнутого хініну є
\[\frac{\frac{2.81 \ \mu \mathrm{g} \text { quinine }}{\mathrm{mL} \text { urine }} \times 2.00 \ \mathrm{mL} \text { urine } \times \frac{1 \mathrm{mg}}{1000 \ \mu \mathrm{g}}} {10.0 \ \mathrm{mg} \text { quinine ingested }} \times 100=0.0562 \% \nonumber\]
Для повного виведення з організму хініну може знадобитися 10-11 днів, тому не дивно, що з цього зразка сечі відновлюється така невелика кількість хініну.
Оцінка фотолюмінесцентної спектроскопії
Масштаб операції
Фотолюмінесцентна спектроскопія використовується для рутинного аналізу слідів та ультратрасових аналітів у макро- та мезозразках. Межі виявлення для флуоресцентної спектроскопії впливають квантовий вихід аналіта. Для аналіта з можлива\(\Phi_f > 0.5\) межа виявлення пікомолярного при використанні високоякісного спектрофлюорометра. Наприклад, межа виявлення хініну сульфату, для якого\(\Phi\) становить 0,55, як правило, становить від 1 частини на мільярд і 1 частина на трильйон. Межі виявлення фосфоресценції дещо вищі, з типовими значеннями в наномолярному діапазоні для низькотемпературної фосфориметрії та в мікромолярному діапазоні для фосфориметрії кімнатної температури з використанням твердої підкладки.
Точність
Точність методу флуоресценції зазвичай становить від 1 до 5%, коли спектральні та хімічні перешкоди незначні. Точність обмежена тими ж типами проблем, які впливають на інші оптичні спектроскопічні методи. Крім того, на точність впливають перешкоди, які впливають на флуоресцентний квантовий вихід. Точність фосфоресценції дещо більша, ніж у флуоресценції.
Точність
Відносне стандартне відхилення для флуоресценції зазвичай становить від 0,5— 2%, коли концентрація аналіта значно перевищує межу виявлення. Точність зазвичай обмежується стабільністю джерела збудження. Точність фосфоресценції часто обмежується відтворюваністю при підготовці зразків до аналізу, при цьому поширені відносні стандартні відхилення 5-10%.
Чутливість
З Equation\ ref {10.4} і Equation\ ref {10.5} ми знаємо, що на чутливість флуоресцентного або фосфоресцентного методу впливає ряд параметрів. Ми вже розглядали важливість квантового виходу і вплив температури і складу розчину на\(\Phi_f\) і\(\Phi_p\). Крім квантового виходу, чутливість покращується за допомогою джерела збудження, який має більшу інтенсивність випромінювання, P 0, на бажаній довжині хвилі, і шляхом вибору довжини хвилі збудження, для якої аналіт має більшу молярну поглинаючу здатність,\(\varepsilon\). Іншим підходом до підвищення чутливості є збільшення обсягу, з якого контролюється викид. Рисунок Template:index показує, як обертання щілин монохроматора від їх звичайної вертикальної орієнтації до горизонтальної орієнтації збільшує об'єм вибірки. Результат може в- складати викид від зразка шляхом\(5-30 \times\).
Вибірковість
Вибірковість флуоресценції та фосфоресценції перевершує абсорбційну спектрофотометрію з двох причин: по-перше, не кожна сполука, яка поглинає випромінювання, є флуоресцентною або фосфоресцентною; і, по-друге, вибірковість між аналітом та інтерферентом можлива, якщо є різниця в будь-якому їх збудження або їх спектри випромінювання. Загальна інтенсивність викидів - це лінійна сума від кожного флуоресцентного або фосфоресцентного виду. Аналіз зразка, який містить n аналітів, таким чином, здійснюється шляхом вимірювання загальної інтенсивності випромінювання на n довжині хвиль.
Час, вартість та обладнання
Як і в інших оптичних спектроскопічних методах, флуоресцентні і фосфоресцентні методи забезпечують швидкий засіб для аналізу зразків і здатні до автоматизації. Флуориметри коштують відносно недорого, коливаються від декількох сотень до декількох тисяч доларів, і часто є задовільними для кількісної роботи. Спектрофлюометри коштують дорожче, причому моделі часто перевищують 50 000 доларів.
