9.6: Проблеми
- Page ID
- 24852
Деякі з наступних проблем вимагають однієї або декількох констант рівноваги або стандартних потенціалів стану. Для вашої зручності, ось гіперпосилання на додатки, що містять ці константи:
Додаток 10: Продукти розчинності
Додаток 11: Константи дисоціації кислоти
1. Обчисліть або намалюйте криві титрування для наступних титрувань кислотно-основи.
(а) 25,0 мл 0,100 М NaOH з 0,0500 М HCl
(б) 50,0 мл 0,0500 М ГСООН з 0,100 М NaOH
(c) 50,0 мл 0,100 М NH 3 з 0,100 М HCl
(г) 50,0 мл 0,0500 М етилендіаміну з 0,100 М HCl
(е) 50,0 мл 0,0400 М лимонної кислоти з 0,120 М NaOH
(f) 50,0 мл 0,0400 М Н 3 РО 4 з 0,120 М NaOH
2. Знайдіть точку (и) еквівалентності для кожної кривої титрування в задачі 1 і, де це можливо, обчисліть рН у точці еквівалентності. Яка стехіометрична залежність між молями кислоти і родимками основи для кожної з цих точок еквівалентності?
3. Запропонуйте відповідний візуальний індикатор для кожного з титрувань у задачі 1.
4. Для накреслення кривої титрування слабкої кислоти ми наближаємо рН на 10% об'єму точки еквівалентності як p K a — 1, а рН у 90% об'єму точки еквівалентності — p K a + 1. Покажіть, що ці припущення є розумними.
5. Винна кислота, Н 2 С 4 Н 4 О 6, являє собою дипротовую слабку кислоту з р К а1 3,0 і р К а2 4,4. Припустимо, у вас є зразок нечистої винної кислоти (чистота > 80%), і що ви плануєте визначити її чистоту шляхом титрування розчином 0,1 М NaOH за допомогою індикатора для сигналізації кінцевої точки. Опишіть, як ви будете проводити аналіз, приділяючи особливу увагу тому, скільки проби використовувати, бажаний діапазон рН для показника, і як ви будете обчислювати %w/w винної кислоти. Припустимо, ваш бюрет має максимальну ємність 50 мл.
6. Наступні дані для титрування монопротной слабкої кислоти з міцною основою були зібрані за допомогою автоматичного титратора. Підготуйте нормальну, першу похідну, другу похідну та криві титрування Gran для цих даних та знайдіть точку еквівалентності для кожного.
| обсяг NaOH (мл) | рН | обсяг NaOH (мл) | рН |
|---|---|---|---|
|
0,25 |
3.0 | 49.95 | 7.8 |
|
0,86 |
3.2 | 49.97 | 8.0 |
|
1.63 |
3.4 | 49.98 | 8.2 |
|
2.72 |
3.6 | 49.99 | 8.4 |
|
4.29 |
3.8 | 50.00 | 8.7 |
|
6.54 |
4.0 | 50.01 | 9.1 |
|
9.67 |
4.2 | 50.02 | 9.4 |
| 13.79 | 4.4 | 50.04 | 9.6 |
| 18.83 | 4.6 | 50.06 | 9.8 |
| 24.47 | 4.8 | 50.10 | 10.0 |
| 30.15 | 5.0 | 50.16 | 10.2 |
| 35.33 | 5.2 | 50.25 | 10.4 |
| 39.62 | 5.4 | 50.40 | 10.6 |
| 42.91 | 5.6 | 50.63 | 10.8 |
| 45.28 | 5.8 | 51.01 | 11.0 |
| 46.91 | 6.0 | 51.61 | 11.2 |
| 48.01 | 6.2 | 52.58 | 11.4 |
| 48.72 | 6.4 | 54.15 | 11.6 |
| 49.19 | 6.6 | 56.73 | 11.8 |
| 49.48 | 6.8 | 61.11 | 12.0 |
| 49.67 | 7.0 | 68.83 | 12.2 |
| 49.79 | 7.2 | 83.54 | 12.4 |
| 49.87 | 7.4 | 116.14 | 12.6 |
| 49.92 | 7.6 |
7. Шварц опублікував наступні модельовані дані для титрування\(1.02 \times 10^{-4}\) М розчину монопротной слабкої кислоти (p K a = 8,16) з\(1.004 \times 10^{-3}\) M NaOH [Schwartz, L.M. J. Chem. Едук. 1992, 69, 879-883]. Моделювання передбачає, що 50-мл піпетка використовується для перенесення порції слабкого кислотного розчину в посудину для титрування. Калібрування піпета показує, що він забезпечує об'єм всього 49,94 мл. Підготуйте нормальну, першу похідну, другу похідну та криві титрування Gran для цих даних та визначте точку еквівалентності для кожного. Як ці точки еквівалентності порівнюються з очікуваною точкою еквівалентності? Прокоментуйте корисність кожної кривої титрування для аналізу дуже розведених розчинів дуже слабких кислот.
| мл NaOH | рН | мл NaOH | рН |
|---|---|---|---|
|
0,03 |
6.212 |
4.79 |
8.858 |
|
0,09 |
6.504 | 4.99 | 8.926 |
|
0,29 |
6.936 | 5.21 |
8.994 |
|
0,72 |
7.367 | 5.41 | 9.056 |
| 1.06 | 7.567 | 5.61 | 9.118 |
| 1.32 | 7.685 | 5.85 | 9.180 |
| 1.53 | 7.776 | 6.05 | 9.231 |
| 1.76 | 7,863 | 6.28 | 9.283 |
| 1.97 | 7,938 | 6.47 | 9.327 |
| 2.18 | 8.009 | 6.71 | 9.374 |
| 2.38 | 8.077 | 6.92 | 9.414 |
| 2.60 | 8.146 | 7.15 | 9.451 |
| 2.79 | 8.208 | 7.36 | 9.484 |
| 3.01 | 8.273 | 7.56 | 9.514 |
| 3.19 | 8.332 | 7.79 | 9.545 |
| 3.41 | 8.398 | 7,99 | 9.572 |
| 3.60 | 8.458 | 8.21 | 9.599 |
| 3.80 | 8.521 | 8.44 | 9.624 |
| 3.99 | 8.584 | 8.64 | 9.645 |
| 4.18 | 8.650 | 8.84 | 9.666 |
| 4.40 | 8.720 | 9.07 | 9.688 |
| 4.57 | 8.784 | 9.27 | 9.706 |
8. Розрахуйте або намалюйте криву титрування для 50,0 мл розчину 0,100 М монопротної слабкої кислоти (p K a = 8.0) з міцною основою 0,1 М в неводному розчиннику з K s =\(10^{-20}\). Можна припустити, що зміна розчинника не впливає на слабку кислоту р К а. Порівняйте криву титрування з кривою титрування, коли вода є розчинником.
9. Після титрування суміші р -нітрофенолу (р К а = 7,0) і м -нітрофенолу (р К а = 8,3) слідують спектрофотометрично. Жодна кислота не поглинається на довжині хвилі 545 нм, але їх відповідні кон'югатні основи поглинають на цій довжині хвилі. Іон m -нітрофенолату має більшу поглинання, ніж еквимолярний розчин р-нітрофенолатного іона. Намалюйте спектрофотометричну криву титрування для суміші 50,00 мл, що складається з 0,0500 М р-нітрофенолу та 0,0500 М -нітрофенолу з 0,100 М NaOH. Порівняйте свій результат з очікуваними потенціометричними кривими титрування.
10. Кількісний аналіз на анілін (C 6 H 5 NH 2, K b =\(3.94 \times 10^{-10}\)) проводять кислотно-лужним титруванням з використанням льодовикової оцтової кислоти як розчинника і HClO 4 як титранта. Відомий обсяг проби, що містить 3-4 ммоль аніліну, переносять у 250-мл колбу Ерленмейєра і розводять приблизно до 75 мл льодовиковою оцтовою кислотою. Додають дві краплі індикатора метилфіалки, і розчин титрують попередньо стандартизованим 0.1000 M HClO 4 (приготованим в льодовикової оцтової кислоти з використанням безводного HClO4) до досягнення кінцевої точки. Результати повідомляються у вигляді частин на мільйон аніліну.
(а) Поясніть, чому це титрування проводиться з використанням льодовикової оцтової кислоти як розчинника замість води.
(б) Однією з проблем використання льодовикової оцтової кислоти в якості розчинника є її відносно високий коефіцієнт теплового розширення 0,111%/о С. Наприклад, 100,00 мл льодовикової оцтової кислоти при 25 o С займає 100,22 мл при 27 o С. Який вплив на заявлену концентрацію аніліну, якщо стандартизація HClO 4 проводиться при температурі, яка нижче такої для аналізу невідомого?
(c) Процедура вимагає зразка, який містить 3-4 ммоль аніліну. Навіщо потрібна ця вимога?
Деякі з наступних проблем вимагають однієї або декількох констант рівноваги або стандартних потенціалів стану. Для вашої зручності, ось гіперпосилання на додатки, що містять ці константи:
Додаток 10: Продукти розчинності
Додаток 11: Константи дисоціації кислоти
11. Використовуючи діаграму сходів, поясніть, чому наявність розчиненого CO 2 призводить до визначеної помилки для стандартизації NaOH, якщо рН кінцевої точки знаходиться в межах 6—10, але немає визначеної помилки, якщо рН кінцевої точки менше 6.
12. Кислотність проби води визначають титруванням до фіксованої кінцевої точки рН 3,7 і 8,3, причому перша забезпечує міру концентрації сильної кислоти, а пізніше - міру комбінованих концентрацій сильної кислоти і слабкої кислоти. Намалюйте криву титрування для суміші 0,10 М HCl та 0,10 M H 2 CO 3 з міцною основою 0,20 М та використовуйте її для обґрунтування вибору цих кінцевих точок.
13. Етилендіамінтетраоцтова кислота H 4 Y - слабка кислота з послідовними константами дисоціації кислоти 0,010,\(2.19 \times 10^{-3}\),\(6.92 \times 10^{-7}\), і\(5.75 \times 10^{-11}\). На малюнку нижче показана крива титрування для H 4 Y з NaOH. Яка стехіометрична залежність між H 4 Y і NaOH в точці еквівалентності, позначеної червоною стрілкою?
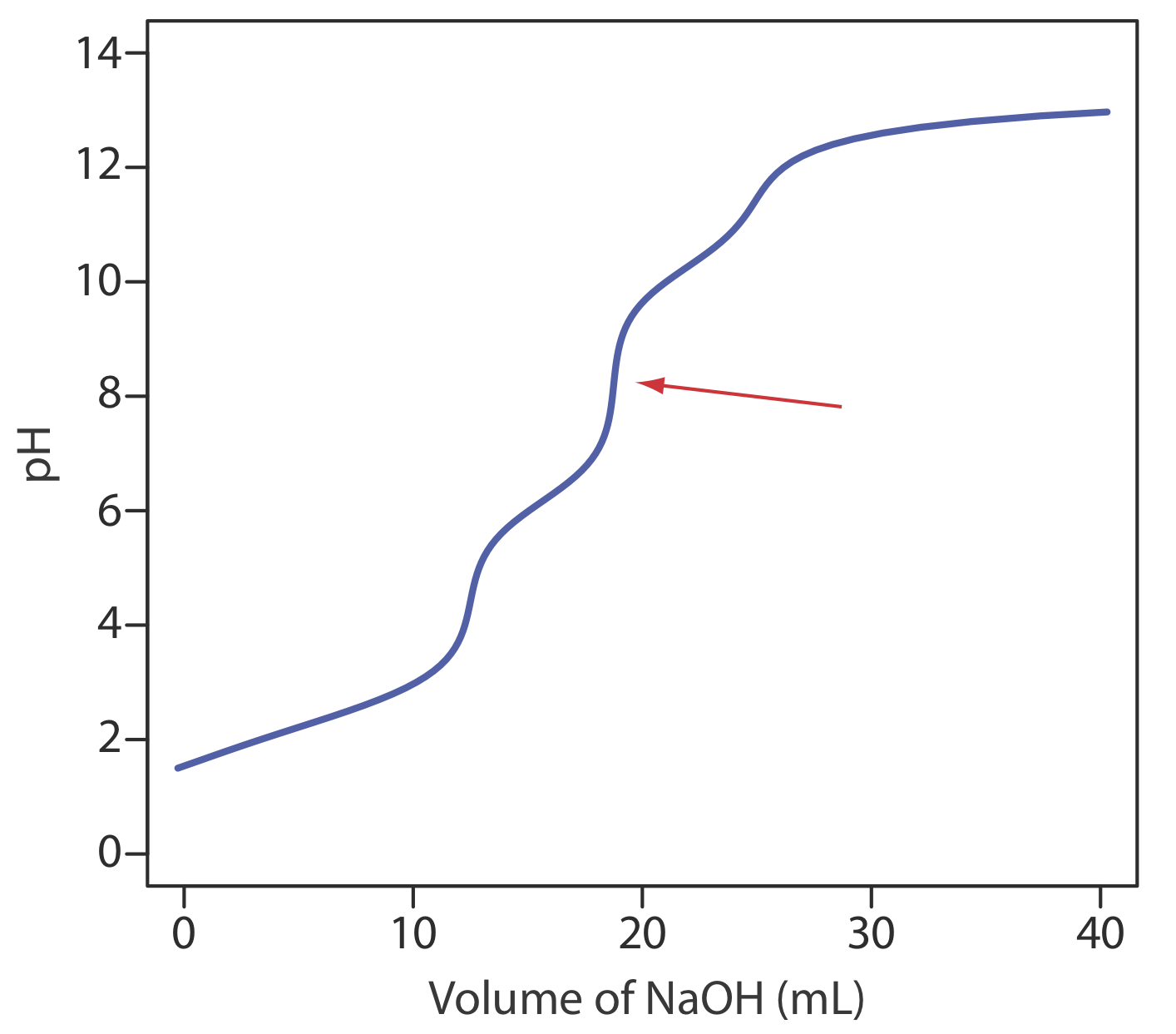
14. Для кількісного аналізу суміші, яка складається з сильної кислоти та монопротонної слабкої кислоти [(a) Boiani, J.A. Chem. Едук. 1986, 63, 724—726; (б) Кастільо, К.А.; Харамільо, А.Дж. Едук. 1989, 66, 341]. 50,00-мл суміш HCl і CH 3 COOH переносять в колбу Ерленмейера і титрують за допомогою цифрового піпету для додавання послідовних 1,00-мл аліквот 0,09186 M NaOH. Прогрес титрування контролюється шляхом реєстрації рН після кожного додавання титранту. Використовуючи дві статті, перераховані вище, як довідку, підготуйте графік Gran для наступних даних та визначте концентрації HCl та CH 3 COOH.
| мл NaOH | рН | мл NaOH | рН | мл NaOH | рН |
|---|---|---|---|---|---|
|
1.00 |
1.83 |
24.00 |
4.45 |
47.00 |
12.14 |
|
2.00 |
1.86 |
25.00 |
4.53 |
48.00 |
12.17 |
|
3.00 |
1.89 |
26.00 |
4.61 |
49.00 |
12.20 |
|
4.00 |
1,92 |
27.00 |
4.69 |
50.00 |
12.23 |
|
5.00 |
1,95 |
28.00 |
4.76 |
51.00 |
12.26 |
|
6.00 |
1,99 |
29.00 |
4.84 |
52.00 |
12.28 |
|
7.00 |
2.03 |
30.00 |
4.93 |
53.00 |
12.30 |
|
8.00 |
2.10 |
31.00 |
5.02 |
54.00 |
12.32 |
|
9.00 |
2.18 |
32.00 |
5.13 |
55.00 |
12.34 |
|
10.00 |
2.31 | 33.00 |
5.23 |
56.00 |
12.36 |
| 11.00 | 2.51 | 34.00 |
5.37 |
57.00 |
12.38 |
| 12.00 | 2.81 | 35.00 |
5.52 |
58.00 |
12.39 |
| 13.00 | 3.16 | 36.00 |
5.75 |
59.00 |
12.40 |
| 14.00 | 3.36 | 37.00 |
6.14 |
60.00 |
12.42 |
| 15.00 | 3.54 | 38.00 |
10.30 |
61.00 | 12.43 |
| 16.00 | 3.69 | 39.00 | 11.31 | 62.00 | 12.44 |
| 17.00 | 3.81 | 40.00 | 11.58 | 63.00 | 12.45 |
| 18.00 | 3.93 | 41.00 | 11.74 | 64.00 | 12.47 |
| 19.00 | 4.02 | 42.00 | 11.85 | 65.00 | 12.48 |
| 20.00 | 4.14 | 43.00 | 11.93 | 66.00 | 12.49 |
| 21.00 | 4.22 | 44.00 | 12.00 | 67.00 | 12.50 |
| 22.00 | 4.30 | 45.00 | 12.05 | 68.00 | 12.51 |
| 23.00 | 4.38 | 46.00 | 12.10 | 69.00 | 12.52 |
15. Поясніть, чому не можна для зразка води одночасно мати ОН - і\(\text{HCO}_3^-\) як джерела лужності.
16. Для кожного із зразків a-e визначають джерела лужності (OH -,\(\text{HCO}_3^-\),\(\text{CO}_3^{2-}\)) та їх відповідні концентрації в частках на мільйон. У кожному випадку 25,00-мл зразка титрують 0.1198 M HCl до бромокрезолу зеленого та кінцевих точок фенолфталеїну.
| зразок | обсяг HCl (mL) щоб кінцева точка фенолфталеїну | обсяг HCl (мл) до зеленої кінцевої точки бромокрезолу |
|---|---|---|
| a | 21.36 | 21.38 |
| б | 5.67 | 21.13 |
| c | 0.00 | 14.28 |
| d | 17.12 | 34.26 |
| е | 21.36 | 25.69 |
17. Зразок може містити будь-яке з наступного: HCl, NaOH, H 3 PO 4\(\text{H}_2\text{PO}_4^-\)\(\text{HPO}_4^{2-}\), або\(\text{PO}_4^{3-}\). Склад зразка визначається титруванням 25,00-мл порції з 0,1198 M HCl або 0,1198 M NaOH до фенолфталеїну і до кінцевих точок метилового апельсина. Для кожного з наступних зразків визначте, які види присутні та їх відповідні молярні концентрації.
| зразок | титрант | обсяг (мл) щоб кінцева точка фенофталеїну | обсяг (mL) щоб кінцева точка метилового оранжевого |
|---|---|---|---|
| a | HCl | 11.54 | 35.29 |
| б | NaOH | 19.79 | 9.89 |
| c | HCl | 22.76 | 22.78 |
| d | NaOH | 39.42 | 17.48 |
18. Білок в пробі 1,2846-г вівсяної крупи визначається за допомогою аналізу Кьельдаля. Зразок перетравлюють H 2 SO 4, отриманий розчин роблять основним з NaOH, а NH 3 переганяють в 50,00 мл 0,09552 M HCl. Надлишок HCl назад титрують за допомогою 37,84 мл 0,05992 М NaOH. Враховуючи, що білки в зерні в середньому 17,54% w/w N, повідомляють про %w/w білка в пробі.
19. Концентрацію SO 2 в повітрі визначають шляхом барботування проби повітря через пастку, що містить Н 2 О 2. Окислення SO 2 H 2 O 2 призводить до утворення H 2 SO 4, який потім визначається титруванням з NaOH. При типовому аналізі пробу повітря пропускають через пероксидну пастку зі швидкістю 12,5 л/хв протягом 60 хв і потрібно 10,08 мл 0,0244 М NaOH для досягнення кінцевої точки фенолфталеїну. Обчисліть мкл/л SO 2 в пробі повітря. Щільність SO 2 при температурі проби повітря становить 2,86 мг/мл.
20. Концентрація СО 2 в повітрі визначається непрямим титруванням кислотно-основи. Проба повітря барботається через розчин, який містить надлишок Ba (OH) 2, що випадає в осад BaCo 3. Надлишок Ba (OH) 2 назад титрується HCl. У типовому аналізі 3,5-літровий зразок повітря барботируется через 50,00 мл 0,0200 M Ba (OH) 2. Для заднього титрування 0.0316 M HCl потрібно 38,58 мл, щоб досягти кінцевої точки. Визначити проміле СО 2 в пробі повітря враховуючи, що щільність СО 2 при температурі зразка становить 1,98 г/л.
Деякі з наступних проблем вимагають однієї або декількох констант рівноваги або стандартних потенціалів стану. Для вашої зручності, ось гіперпосилання на додатки, що містять ці константи:
Додаток 10: Продукти розчинності
Додаток 11: Константи дисоціації кислоти
21. Чистота синтетичного препарату метилетилкетона, С 4 Н 8 О, визначається шляхом взаємодії його з гідроксиламіну гідрохлоридом, що виділяє HCl (див. Реакцію в табл. 9.2.7). У типовому аналізі 3,00-мл проби розводять до 50,00 мл і обробляють надлишком гідроксиламіну гідрохлориду. Вивільнений HCl титрують 0.9989 M NaOH, що вимагає 32.68 мл для досягнення кінцевої точки. Повідомте відсоток чистоти зразка, враховуючи, що щільність метилетилкетону становить 0,805 г/мл.
22. Тваринні жири і рослинні масла - це триефіри, що утворюються в результаті реакції між гліцерином (1,2,3-пропанетріолом) і трьома довголанцюговими жирними кислотами. Одним із методів, що застосовуються для характеристики жиру або масла, є визначення його числа омилення. При обробці киплячою водою КОН ефір омилюється в основний спирт і жирні кислоти (у вигляді карбоксилатних іонів). Число омилення - це кількість міліграмів КОН, необхідних для омилення 1.000 грам жиру або олії. У типовому аналізі 2,085-г зразка вершкового масла додають до 25,00 мл 0,5131 М КОН. Після завершення омилення надлишок КОН назад титрується 10,26 мл 0.5000 M HCl. Який номер омилення для цього зразка вершкового масла?
23. 250,0-мг зразка органічної слабкої кислоти розчиняють у відповідному розчиннику і титрують 0,0556 M NaOH, що вимагає 32,58 мл для досягнення кінцевої точки. Визначте еквівалентну вагу з'єднання.
24. На малюнку нижче показана потенціометрична крива титрування для зразка 0,4300-г очищеної амінокислоти, яка була розчинена в 50,00 мл води і титрована 0,1036 М NaOH. Визначте амінокислоту з можливостей, перерахованих в таблиці.
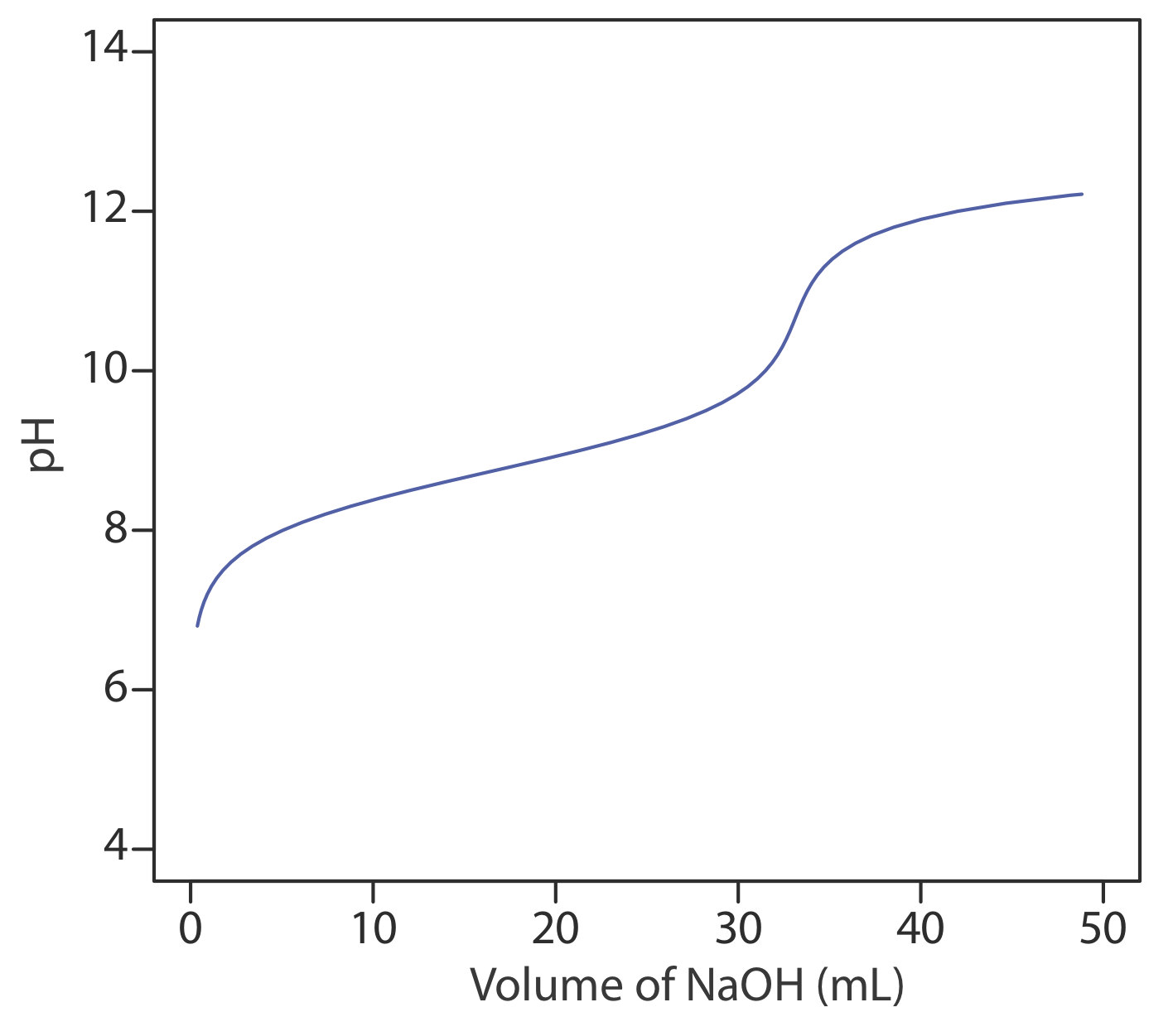
| амінокислоти | вага формули (г/моль) | К а |
|---|---|---|
| аланін | 89.1 | \(1.35 \times 10^{-10}\) |
| гліцин | 75.1 | \(1.67 \times 10^{-10}\) |
| метіонін | 149.2 | \(8.9 \times 10^{-10}\) |
| таурин | 125.2 | \(1.8 \times 10^{-9}\) |
| аспарагін | 150 | \(1.9 \times 10^{-9}\) |
| лейцин | 131.2 | \(1.79 \times 10^{-10}\) |
| фенілаланін | 166.2 | \(4.9 \times 10^{-10}\) |
| валін | 117.2 | \(1.91 \times 10^{-10}\) |
25. Використовуючи її криву титрування, визначити константу дисоціації кислоти для слабкої кислоти в задачі 9.6.
26. Де в масштабі операцій належать методи мікротитрування, розглянуті в розділі 9.7?
27. Кислотно-основне титрування може бути використано для визначення еквівалентної ваги аналіту, але воно не може бути використане для визначення його формульної ваги. Поясніть чому.
28. Комерційна пральна сода становить приблизно 30-40% w/w Na 2 CO 3. Одна процедура кількісного аналізу промивної соди містить наступну інструкцію:
Перенесіть приблизно 4-г пробу пральної соди в об'ємну колбу об'ємом об'ємом об'ємом 250 мл. Розчиніть зразок приблизно в 100 мл Н 2 О, а потім розведіть до позначки. За допомогою піпету перекладіть 25-мл аліквоту цього розчину в колбу Ерленмейера об'ємом 125 мл і додайте 25 мл H 2 O і 2 краплі бромокрезолу зеленого індикатора. Титуйте зразок 0,1 M HCl до кінцевої точки індикатора.
Які модифікації, якщо такі є, необхідні, якщо ви хочете адаптувати цю процедуру для оцінки чистоти комерційного Na 2 CO 3, тобто > 98% чистого?
29. Можливі різноманітні систематичні і випадкові помилки при стандартизації розчину NaOH проти первинної слабкої кислоти стандартного гідрофталату калію (КХП). Визначте, з обґрунтуванням, чи є наступні джерела систематичної помилки або випадкової помилки, або якщо вони не впливають на помилку. Якщо похибка систематична, то вкажіть, чи є експериментально визначена молярність для NaOH занадто високою або занадто низькою. Реакція стандартизації
\[\text{C}_8\text{H}_5\text{O}_4^-(aq) + \text{OH}^-(aq) \rightarrow \text{C}_8\text{H}_4\text{O}_4^-(aq) + \text{H}_2\text{O}(l) \nonumber\]
(а) Ваги, що використовуються для зважування КХП, не відкалібровані належним чином і завжди читають 0.15 г занадто низько.
(b) Індикатор титрування змінює колір між рН 3—4.
(c) Повітряний міхур, який знаходиться в кінчику бюрета на початку аналізу, вибивається під час титрування.
(г) Зразки КХП зважують в окремі колби Ерленмейєра, але залишок засмагляється тільки для першої колби.
(е) КХП не сушать перед його використанням.
(f) NaOH не сушать перед його використанням.
(g) У процедурі зазначено, що зразок КХП слід розчинити в 25 мл води, але його випадково розчиняють у 35 мл води.
30. Концентрація o -фталевої кислоти в органічному розчиннику, такому як n -бутанол, визначається титруванням кислота-основа з використанням водного NaOH як титранта. Коли титрант додається, o -фталева кислота екстрактує у водний розчин, де він реагує з титрантом. Титрант додається повільно, щоб забезпечити достатній час для екстракції.
(a) Який тип помилки ви очікуєте, якщо титрування проводиться занадто швидко?
(б) Запропонувати альтернативний титриметричний метод кислотно-основи, що дозволяє більш швидко визначити концентрацію o -фталевої кислоти в n -бутанолі.
Деякі з наступних проблем вимагають однієї або декількох констант рівноваги або стандартних потенціалів стану. Для вашої зручності, ось гіперпосилання на додатки, що містять ці константи:
Додаток 10: Продукти розчинності
Додаток 11: Константи дисоціації кислоти
31. Розрахуйте або намалюйте криві титрування для 50,0 мл 0.100 Mg 2 + з 0,100 М ЕДТА при рН 7 і 10. Знайдіть точку еквівалентності для кожної кривої титрування.
32. Розрахуйте або намалюйте криві титрування для 25,0 мл 0,0500 М Cu 2 + з 0,025 М ЕДТА при рН 10 і в присутності 10 —3 М і 10 —1 М NH 3. Знайдіть точку еквівалентності для кожної кривої титрування.
33. Намалюйте спектрофотометричну криву титрування для титрування суміші\(5.00 \times 10^{-3}\) M Bi 3 + та\(5.00 \times 10^{-3}\) M Cu 2+ з 0,0100 M EDTA. Припустімо, що лише комплекс Cu 2 + —EDTA поглинає на вибраній довжині хвилі.
34. Титрування ЕДТА сумішей Ca 2+ і Mg 2 + можна дотримуватися термометрично, оскільки утворення комплексу Ca 2 + —EDTA є екзотермічним, а утворення комплексу Mg 2 + —EDTA є ендотермічним. Намалюйте термометричну криву титрування для суміші\(5.00 \times 10^{-3}\) M Ca 2+ та\(5.00 \times 10^{-3}\) M Mg 2 +, використовуючи 0,0100 M EDTA як титрант. Теплоти формування для CAy 2— і mGy 2— складають відповідно —23,9 кДж/моль і 23,0 кДж/моль.
35. ЕДТА є одним з членів класу амінокарбоксилатних лігандів, які утворюють дуже стабільні комплекси 1:1 з іонами металів. У наступній таблиці наведено значення log K f для комплексів шести таких лігандів з Ca 2 + і Mg 2 +. Який ліганд краще вибрати для прямого титрування Са 2 + в присутності Mg 2 +?
| ліганд | Мг2+ | Са2+ |
|---|---|---|
| ЕДТА: етилендіамінтетраоцтова кислота | 8.7 | 10.7 |
| ГЕДТА: N-гідроксиетилендіаметраоцтова кислота | 7.0 | 8.0 |
| ЕЕДТА: етилтердіамінтетраоцтова кислота | 8.3 | 10.0 |
| EGTA: етиленгліколь-біс (\(\beta\)-аміноетилер) -N, N'-тетраоцтова кислота | 5.4 | 10.9 |
| DTPA: діетилентріамінпентаоцтова кислота | 9.0 | 107 |
| CYDTA: циклогеандіамінтетраоцтова кислота | 10.3 | 12.3 |
36. Кількість кальцію в фізіологічних рідинях визначається комплексометрическим титруванням з ЕДТА. В одному такому аналізі 0,100-мл проби сироватки крові роблять базовим шляхом додавання 2 крапель NaOH і титрують 0,00119 М ЕДТА, що вимагає 0,268 мл для досягнення кінцевої точки. Повідомте про концентрацію кальцію в зразку у вигляді міліграмів Са на 100 мл.
37. Після видалення оболонок з яєчної шкаралупи шкаралупу висушують і реєструють її масу як 5,613 м Яєчну шкаралупу переносять в стакан об'ємом 250 мл і розчиняють в 25 мл 6 М HCl. Після проціджування розчин, який містить розчинену яєчну шкаралупу, розводять до 250 мл в об'ємній колбі. Аліквоту об'ємом 10,00 мл поміщають в колбу Ерленмейера об'ємом 125 мл і буферують до рН 10. Титрування з 0.04988 M EDTA вимагає 44.11 мл, щоб досягти кінцевої точки. Визначте кількість кальцію в яєчній шкаралупі як% w/w CaCo 3.
38. Концентрацію ціаніду CN — в мідній гальванічній ванні визначають комплексометричним титруванням з використанням Ag + як титранта, утворюючи розчинний\(\text{Ag(CN)}_2^-\) комплекс. При типовому аналізі 5,00-мл проба з гальванічної ванни переносять в 250-мл колбу Ерленмейера, і обробляють 100 мл H 2 O, 5 мл 20% в/в NaOH і 5 мл 10% w/v KI. Зразок титрують 0,1012 М AgNO 3, що вимагає 27,36 мл для досягнення кінцевої точки, про що сигналізує утворення жовтого осаду AgI. Повідомте про концентрацію ціаніду у вигляді частин на мільйон NaCN.
39. Перед введенням ЕДТА більшість комплексоутворення використовували титрування Ag + або CN — як титрант. Аналіз для Cd 2 +, наприклад, був здійснений опосередковано шляхом додавання надлишку KCN для формування\(\text{Cd(CN)}_4^{2-}\) та зворотного титрування надлишку CN - з Ag +, формуючи\(\text{Ag(CN)}_2^-\). В одному з таких аналізів 0,3000-г проби руди розчиняють і обробляють 20,00 мл 0,5000 М KCN. Надлишок CN - вимагає 13,98 мл 0,1518 М AgNO 3, щоб досягти кінцевої точки. Визначте %w/w Cd в руді.
40. Розчини, які містять як Fe 3 +, так і Al 3 + вибірково аналізуються на Fe 3 + шляхом буферизації до рН 2 і титрування за допомогою ЕДТА. Потім рН розчину підвищують до 5 і додають надлишок ЕДТА, в результаті чого утворюється комплекс Al 3 + —EDTA. Надлишок ЕДТА піддається зворотному титруванню за допомогою стандартного рішення Fe 3 +, забезпечуючи непрямий аналіз для Al 3 +.
(а) При рН 2 переконайтеся, що формування комплексу Fe 3 + —EDTA сприятливе, і що формування комплексу Al 3 + —EDTA не є сприятливим.
(б) Аліквота 50,00 мл зразка, що містить Fe 3 + і Al 3 +, переноситься в 250-мл колбу Ерленмейєра і буферується до рН 2. Додають невелику кількість саліцилової кислоти, утворюючи розчинний комплекс Fe 3 + -саліцилової кислоти червоного кольору. Розчин титрують 0,05002 М ЕДТА, що вимагає 24,82 мл для досягнення кінцевої точки, про що сигналізує зникнення червоного кольору комплексу Fe 3 + -саліцилової кислоти. Розчин буферують до рН 5 і додають 50,00 мл 0,05002 М ЕДТА. Після того, як формування комплексу Al 3 + —ЕДТА завершено, надлишок ЕДТА знову титрується 0.04109 M Fe 3 +, що вимагає 17,84 мл для досягнення кінцевої точки, про що сигналізує повторна поява червоного кольору Fe 3 + - комплекс саліцилової кислоти. Повідомте про молярні концентрації Fe 3 + та A l3 + у зразку.
Деякі з наступних проблем вимагають однієї або декількох констант рівноваги або стандартних потенціалів стану. Для вашої зручності, ось гіперпосилання на додатки, що містять ці константи:
Додаток 10: Продукти розчинності
Додаток 11: Константи дисоціації кислоти
41. Прада і його колеги описали непрямий метод визначення сульфату в природних зразках, таких як морська вода і промислові стоки [Prada, S.; Guekezian, M.; Suarez-Iha, М.Е. Чим. Акт 1996, 329, 197—202]. Спосіб складається з трьох етапів: осадження сульфату у вигляді PbSO 4; розчинення PbSO 4 в амонічному розчині надлишку ЕДТА з утворенням розчинного pBy 2-комплексу; і титрування надлишку ЕДТА стандартним розчином Mg 2 +. Відомі наступні реакції і константи рівноваги:
\[\text{PbSO}_4(s) \rightleftharpoons \text{Pb}^{2+}(aq) + \text{SO}_4^{2-}(aq) \quad K_\text{sp} = 1.6 \times 10^{-8} \nonumber\]
\[\text{Pb}^{2+}(aq) + \text{Y}^{4-}(aq) \rightleftharpoons \text{PbY}^{2-}(aq) \quad K_\text{f} = 1.1 \times 10^{18} \nonumber\]
\[\text{Mg}^{2+}(aq) + \text{Y}^{4-}(aq) \rightleftharpoons \text{MgY}^{2-}(aq) \quad K_\text{f} = 4.9 \times 10^{8} \nonumber\]
\[\text{Zn}^{2+}(aq) + \text{Y}^{4-}(aq) \rightleftharpoons \text{ZnY}^{2-}(aq) \quad K_\text{f} = 3.2 \times 10^{16} \nonumber\]
(а) Переконайтеся, що осад PbSO 4 розчиняється в розчині Y 4—.
(б) Спорек запропонував подібний метод, використовуючи Zn 2 + як титрант і виявив, що точність часто була поганою [Sporek, K.F. Anal. Хім. 1958, 30, 1030—1032]. Одне пояснення полягає в тому, що Zn 2 + може реагувати з pBy 2— комплексом, утворюючи ZnY 2—. Покажіть, що це може бути проблемою при використанні Zn 2 + як титранту, але це не є проблемою при використанні Mg 2 + як титранту. Чи призведе таке зміщення Pb 2 + на Zn 2 + до повідомлення про занадто багато або занадто мало сульфату?
(c) У типовому аналізі 25,00 мл зразка промислових стоків проводиться через процедуру з використанням 50.00 мл 0,05000 М ЕДТА. Титрування надлишку ЕДТА вимагає 12.42 мл 0.1000 M Mg 2 +. Повідомити про молярну концентрацію\(\text{SO}_4^{2-}\) в зразку стоків.
42. У таблиці 9.3.1 наведені значення для частки ЕДТА присутній як Y 4—,\(\alpha_{\text{Y}^{4-}}\). Значення\(\alpha_{\text{Y}^{4-}}\) обчислюються за допомогою рівняння
\[\alpha_{\text{Y}^{4-}} = \frac{[\text{Y}^{4-}]}{C_\text{EDTA}} \nonumber\]
де [Y 4-] - концентрація повністю депротонованої ЕДТА, а С ЕДТА - загальна концентрація ЕДТА у всіх її формах
\[C_\text{EDTA} = [\text{H}_6\text{Y}^{2+}]+[\text{H}_5\text{Y}^{+}]+[\text{H}_4\text{Y}]+ [\text{H}_3\text{Y}^{-}] + [\text{H}_2\text{Y}^{2-}] + [\text{H}_\text{Y}^{3-}] + [\text{Y}^{4-}] \nonumber\]
\[\text{H}_6\text{Y}^{2+} (aq) + \text{H}_2\text{O}(l) \rightleftharpoons \text{H}_3\text{O}^+(aq) + \text{H}_5\text{Y}^{+}(aq) \quad K_\text{a1} \nonumber\]
\[\text{H}_5\text{Y}^{+} (aq) + \text{H}_2\text{O}(l) \rightleftharpoons \text{H}_3\text{O}^+(aq) + \text{H}_4\text{Y}(aq) \quad K_\text{a2} \nonumber\]
\[\text{H}_4\text{Y} (aq) + \text{H}_2\text{O}(l) \rightleftharpoons \text{H}_3\text{O}^+(aq) + \text{H}_3\text{Y}^{-}(aq) \quad K_\text{a3} \nonumber\]
\[\text{H}_3\text{Y}^{-} (aq) + \text{H}_2\text{O}(l) \rightleftharpoons \text{H}_3\text{O}^+(aq) + \text{H}_2\text{Y}^{2-}(aq) \quad K_\text{a4} \nonumber\]
\[\text{H}_2\text{Y}^{2-} (aq) + \text{H}_2\text{O}(l) \rightleftharpoons \text{H}_3\text{O}^+(aq) + \text{H}\text{Y}^{3-}(aq) \quad K_\text{a5} \nonumber\]
\[\text{H}\text{Y}^{2-} (aq) + \text{H}_2\text{O}(l) \rightleftharpoons \text{H}_3\text{O}^+(aq) + \text{Y}^{4-}(aq) \quad K_\text{a6} \nonumber\]
щоб показати, що
\[\alpha_{\text{Y}^{4-}} = \frac{K_\text{a1}K_\text{a2}K_\text{a3}K_\text{a4}K_\text{a5}K_\text{a6}}{d} \nonumber\]
де
\[d = [\text{H}_3\text{O}^+]^6 + [\text{H}_3\text{O}^+]^5K_\text{a1} + [\text{H}_3\text{O}^+]^4K_\text{a1}K_\text{a2} + [\text{H}_3\text{O}^+]^3K_\text{a1}K_\text{a2}K_\text{a3} + [\text{H}_3\text{O}^+]^2K_\text{a1}K_\text{a2}K_\text{a3}K_\text{a4} + [\text{H}_3\text{O}^+]K_\text{a1}K_\text{a2}K_\text{a3}K_\text{a4}K_\text{a5} + K_\text{a1}K_\text{a2}K_\text{a3}K_\text{a4}K_\text{a5}K_\text{a6} \nonumber\]
43. Розрахуйте або намалюйте криві титрування для наступних реакцій окислювально-відновного титрування при 25 o С. Припустимо, що аналіт спочатку присутній при концентрації 0,0100 М і що 25,0-мл зразка береться для аналізу. Титрант, який є жирним видом у кожній реакції, має концентрацію 0,0100 М.
(а) В 2+ (ак) + Се 4 + (ак)\(\rightarrow\) В 3+ (ак) +Се 3 + (ак)
(б) Сн 2 + (ак) + 2 Се 4 + (ак)\(\rightarrow\) Сн 4 + (ак) +2Сб 3 + (кв)
(c) 5Fe 2 + (aq) +\(\mathbf{MnO}_\mathbf{4}^\mathbf{-}\) (aq) + 8H + (ак)\(\rightarrow\) 5Fe 3 + (aq) + Мн 2 + (ак) +4Н 2 О (л) при рН 1
44. Яка точка еквівалентності для кожного титрування в задачі 43?
45. Запропонуйте відповідний показник для кожного титрування в задачі 43.
46. Вміст заліза в руді визначається окисно-відновним титруванням, яке використовує в якості титранта K 2 Cr 2 O 7. Зразок руди розчиняють у концентрованому HCl за допомогою Sn 2 + для прискорення її розчинення шляхом зниження Fe 3 + до Fe 2 +. Після розчинення зразка Fe 2 + і будь-які надлишки Sn 2 + окислюються до Fe 3 + і Sn 4 + за допомогою\(\text{MnO}_4^-\). Потім залізо обережно зменшують до Fe 2 +, додаючи 2—3 краплі надлишку Sn 2 +. Вносять розчин HgCl 2 і, якщо утворюється білий осад Hg 2 Cl 2, аналіз продовжують титруванням K 2 Cr 2 O 7. Зразок викидають без завершення аналізу, якщо не утворюється осад Hg 2 Cl 2 або при утворенні сірого осаду (через Hg).
(а) Поясніть, чому зразок викидається, якщо білий осад Hg 2 Cl 2 не утворюється або утворюється сірий осад.
(b) Чи вводиться визначальна помилка, якщо аналітик забуває додати Sn 2 + на етапі розчинення залізної руди?
(c) Чи введена визначальна помилка, якщо залізо не кількісно окислюється назад до Fe 3 +\(\text{MnO}_4^-\)?
47. Кількість Cr 3 + в неорганічній солі визначається окислювально-відновним титруванням. Частина зразка, яка містить приблизно 0,25 г Cr 3 +, точно зважується і розчиняється в 50 мл H 2 O. Cr 3 + окислюється\(\text{Cr}_2\text{O}_7^{2-}\) шляхом додавання 20 мл 0,1 М AgNO 3, який служить каталізатором, і 50 мл 10% в/в (NH 4) 2 S 2 O 8, який виконує роль окислювача. Після завершення реакції отриманий розчин кип'ятять протягом 20 хвилин для знищення надлишків\(\text{S}_2\text{O}_8^{2-}\), охолоджують до кімнатної температури, і розводять до 250 мл в об'ємній колбі. 50-мл порцію отриманого розчину переносять в колбу Ерленмейера, обробляють 50 мл стандартного розчину Fe 2 +, і підкислюють 200 мл 1 М Н 2 SO 4, знижуючи\(\text{Cr}_2\text{O}_7^{2-}\) до Cr 3 +. Надлишок Fe 2 + потім визначається шляхом зворотного титрування стандартним розчином К 2 Cr 2 O 7 за допомогою відповідного показника. Результати повідомляються як %w/w Cr 3 +.
(a) У процедурі є кілька місць, де вказано обсяг реагенту (див. Курсивом текст). Які з цих вимірів необхідно провести за допомогою об'ємного піпету.
(б) Надлишок пероксидисульфату,\(\text{S}_2\text{O}_8^{2-}\) руйнується кип'ятінням розчину. Який вплив на повідомлення% w/w Cr 3 +, якщо деякі з них не знищуються під час цього кроку?\(\text{S}_2\text{O}_8^{2-}\)
(c) Розчини Fe 2 + піддаються повільному окисленню повітря до Fe 3 +. Який вплив на повідомлений %w/w Cr 3 +, якщо стандартний розчин Fe 2 + ненавмисно дозволено частково окислюватися?
48. Точну концентрацію Н 2 О 2 в розчині, номінально 6% в/в Н 2 О 2, визначають шляхом окислювально-відновного титрування з використанням в\(\text{MnO}_4^-\) якості титранта. 25-мл аліквоту проби переносять в об'ємну колбу об'ємом об'ємом об'ємом 250 мл і розводять до об'єму дистильованою водою. 25-мл аліквоти розведеного зразка додають в колбу Ерленмейера, розбавлену 200 мл дистильованої води, і підкислюють 20 мл 25% в/в H 2 SO 4. Отриманий розчин титрують стандартним розчином KMnO 4 до збереження слабкого рожевого кольору протягом 30 с. результати повідомляються як %w/v H 2 O 2.
(а) Багато комерційно доступні розчини H 2 O 2 містять неорганічний або органічний стабілізатор для запобігання авторозкладання пероксиду до H 2 O і O 2. Який вплив має наявність цього стабілізатора на повідомлення% w/v H 2 O 2, якщо він також реагує з\(\text{MnO}_4^-\)?
(b) Лабораторна дистильована вода часто містить сліди розчиненого органічного матеріалу, з яким може вступати в реакцію\(\text{MnO}_4^-\). Опишіть простий метод виправлення цієї потенційної перешкоди.
(c) Які зміни процедури, якщо такі є, потрібні, якщо зразок має номінальну концентрацію 30% w/v H 2 O 2.
49. Кількість заліза в метеориті визначається окисно-відновним титруванням, використовуючи в якості титранта KMnO 4. Зразок 0,4185 г розчиняють у кислоті, а звільнений Fe 3+ кількісно зменшують до Fe 2+ за допомогою редуктора Вальдена. Титрування з 0,02500 М KMnO 4 вимагає 41,27 мл для досягнення кінцевої точки. Визначте %w/w Fe 2 O 3 в зразку метеорита.
50. У базових умовах\(\text{MnO}_4^-\) використовується як титрант для аналізу Mn 2 +, причому як аналіт, так і титрант утворюють MnO 2. При аналізі мінерального зразка на марганець розчиняють 0,5165-г проби і знижують марганець до Mn 2 +. Розчин виготовляють базовим і титрують з 0,03358 М KMnO 4, що вимагає 34,88 мл для досягнення кінцевої точки. Обчисліть %w/w Mn у зразку мінералу.
Деякі з наступних проблем вимагають однієї або декількох констант рівноваги або стандартних потенціалів стану. Для вашої зручності, ось гіперпосилання на додатки, що містять ці константи:
Додаток 10: Продукти розчинності
Додаток 11: Константи дисоціації кислоти
51. Кількість урану в руді визначається непрямим окислювально-відновним титруванням. Аналіз здійснюється шляхом розчинення руди в сірчаній кислоті і відновлення\(\text{UO}_2^+\) до U 4+ за допомогою редуктора Вальдена. Розчином обробляють надлишком Fe 3 +, утворюючи Fe 2 + і U 6+. Fe 2 + титрують стандартним розчином K 2 Cr 2 O 7. У типовому аналізі 0,315-г проби руди пропускають через редуктор Вальдена і обробляють 50,00 мл 0,0125 M Fe 3 +. Для заднього титрування з 0.00987 M K 2 Cr 2 O 7 потрібно 10,52 мл. Що таке %w/w U у зразку?
52. Товщину хромової пластини на автокрилі визначають шляхом розчинення в кислоті перетину 30,0-см 2 і окислення Cr 3 + до\(\text{Cr}_2\text{O}_7^{2-}\) пероксидисульфатом. Після видалення надлишку пероксидисульфату кип'ятінням додають 500,0 мг Fe (NH 4) 2 (SO 4) 2 • 6H 2 O, зменшуючи\(\text{Cr}_2\text{O}_7^{2-}\) до Cr 3 +. Надлишок Fe 2 + назад титрується, для досягнення кінцевої точки потрібно 18,29 мл 0,00389 M K 2 Cr 2 O 7. Визначити середню товщину хромової пластини враховуючи, що щільність Cr дорівнює 7,20 г/см 3.
53. Концентрацію СО в повітрі визначають шляхом пропускання відомого обсягу повітря через трубку, яка містить I 2 O 5, утворюючи СО 2 і I 2. I 2 виймають з трубки шляхом перегонки її в розчин, що містить надлишок КІ, виробляючи\(\text{I}_3^-\). \(\text{I}_3^-\)Титується стандартним розчином Na 2 S 2 O 3. У типовому аналізі 4,79-л зразка повітря відбирається, як описано тут, для досягнення кінцевої точки потрібно 7.17 мл 0,00329 M Na 2 S 2 O 3. Якщо повітря має щільність\(1.23 \times 10^{-3}\) г/мл, визначте частини на мільйон СО в повітрі.
54. Рівень розчиненого кисню в пробі води визначається методом Вінклера. При типовому аналізі 100,0-мл проби роблять основний і обробляють розчином MnSO 4, в результаті чого утворюється MnO 2. Додається надлишок КІ і розчин підкислюється, в результаті чого утворюються Mn 2 + і I 2. Вивільнений I 2 титрують розчином 0,00870 M Na 2 S 2 O 3, що вимагає 8,90 мл для досягнення кінцевої точки показника крохмалю. Розрахуйте концентрацію розчиненого кисню у вигляді частин на мільйон O 2.
55. Розрахуйте або намалюйте криву титрування для титрування 50,0 мл 0,0250 M KI з 0,0500 M AgNO 3. Підготуйте окремі криві титрування за допомогою PaG та Pi на осі y.
56. Розрахуйте або намалюйте криву титрування для титрування 25,0 мл суміші 0,0500 M KI та 0,0500 M KSCN, використовуючи 0,0500 M AgNO 3 як титрант.
57. Аналіз на Cl — методом Вольхарда вимагає зворотного титрування. Додають відому кількість AgNO 3, осаджуючи AgCl. Непрореагований Ag + визначається шляхом зворотного титрування за допомогою КСКН. Однак є ускладнення, оскільки AgCl більш розчинний, ніж AgScN.
(a) Чому відносні розчинності AgCl та AgScN призводять до помилки титрування?
(b) Чи отримана помилка титрування є позитивною чи негативною детермінантною помилкою?
(c) Як ви можете змінити процедуру, щоб усунути це джерело визначальної помилки?
(d) Чи є це джерело детермінантної помилки, що викликає занепокоєння при використанні методу Вольхарда для визначення Br —?
58. Вончіна та колеги припускають, що титрування опадів можна контролювати шляхом вимірювання рН як функції обсягу титранту, якщо титрант є слабкою основою [VonCina, DB; DobCnik, D.; GomisCek, S. Anal. Чим. Акт 1992, 263, 147—153]. Наприклад, при титруванні Pb 2 + з K 2 CrO 4 розчин, який містить аналіт спочатку підкислюють до рН 3,50 за допомогою HNO 3. Перед точкою еквівалентності концентрація\(\text{CrO}_4^{2-}\) контролюється продуктом розчинності PbCrO 4. Після точки еквівалентності концентрація\(\text{CrO}_4^{2-}\) визначається кількістю надлишкового титранту. Розглядаючи реакції, які контролюють концентрацію\(\text{CrO}_4^{2-}\), намалюйте очікувану криву титрування рН в порівнянні з об'ємом титранту.
59. Зразок 0,5131 г, який містить KBr, розчиняють у 50 мл дистильованої води. Титрування з 0,04614 M AgNO 3 вимагає 25,13 мл для досягнення кінцевої точки Мора. Порожнє титрування вимагає 0,65 мл, щоб досягти тієї ж кінцевої точки. Повідомити про %w/w KBr у зразку.
60. Методом Вольгарда проаналізовано 0,1093-г зразок нечистої Na 2 CO 3. Після додавання 50,00 мл 0,06911 M AgNO 3 зразок назад титрують 0,05781 М KSCN, що вимагає 27,36 мл для досягнення кінцевої точки. Повідомте про чистоту зразка Na 2 CO 3.
61. Зразок 0,1036 г, який містить тільки BaCl 2 і NaCl, розчиняють у 50 мл дистильованої води. Титрування з 0.07916 M AgNO 3 вимагає 19,46 мл, щоб досягти кінцевої точки Фаджана. Повідомте про %w/w BaCl 2 у зразку.
Деякі з наступних проблем вимагають однієї або декількох констант рівноваги або стандартних потенціалів стану. Для вашої зручності, ось гіперпосилання на додатки, що містять ці константи:
Додаток 10: Продукти розчинності
Додаток 11: Константи дисоціації кислоти
