8.2: Гравіметрія опадів
- Page ID
- 24886
При осадженні гравіметрії нерозчинна сполука утворюється, коли ми додаємо осаджуючий реагент, або осаджувач, до розчину, який містить наш аналіт. У більшості випадків осад є продуктом простої реакції метатезу між аналітом і осадником; однак будь-яка реакція, яка генерує осад потенційно, може служити гравіметричним методом.
Більшість осаджувальних гравіметричних методів були розроблені в дев'ятнадцятому столітті, або раніше, часто для аналізу руд. Рисунок 1.1.1 в розділі 1, наприклад, ілюструє осадження гравіметричний метод аналізу нікелю в рудах.
Теорія і практика
Усі гравіметричні аналізи опадів мають дві важливі атрибути. По-перше, осад повинен бути низької розчинності, високої чистоти та відомого складу, якщо його маса повинна точно відображати масу аналіту. По-друге, необхідно легко відокремити осад від реакційної суміші.
Розчинність міркування
Для забезпечення точного результату розчинність осаду повинна бути мінімальною. Точність загальної методики аналізу, як правило, краща за ± 0,1%, що означає, що осад повинен становити щонайменше 99,9% аналіту. Розширення цієї вимоги до 99,99% забезпечує розчинність осаду не обмежує точність гравіметричного аналізу.
Метод загального аналізу - це метод, при якому аналітичний сигнал - маса в цьому випадку - пропорційний абсолютній кількості аналіту у зразку. Див. Розділ 3 для обговорення різниці між методами загального аналізу та методами концентрації.
Ми можемо мінімізувати втрати розчинності, контролюючи умови, в яких утворюється осад. Це, в свою чергу, вимагає, щоб ми враховували кожну реакцію рівноваги, яка може вплинути на розчинність осаду. Наприклад, ми можемо визначити Ag + гравіметрично, додаючи NaCl як осад, утворюючи осад AgCl.
\[\mathrm{Ag}^{+}(a q)+\mathrm{Cl}^{-}(a q)\rightleftharpoons\mathrm{AgCl}(s) \label{8.1}\]
Якщо це єдина реакція, яку ми розглядаємо, то ми прогнозуємо, що розчинність осаду, S AgCl, задається наступним рівнянням.
Рівняння\ ref {8.2} говорить про те, що ми можемо мінімізувати втрати розчинності шляхом додавання великого надлишку Cl —. Насправді, як показано на малюнку Template:index, додавання великого надлишку Cl — збільшує розчинність осаду.
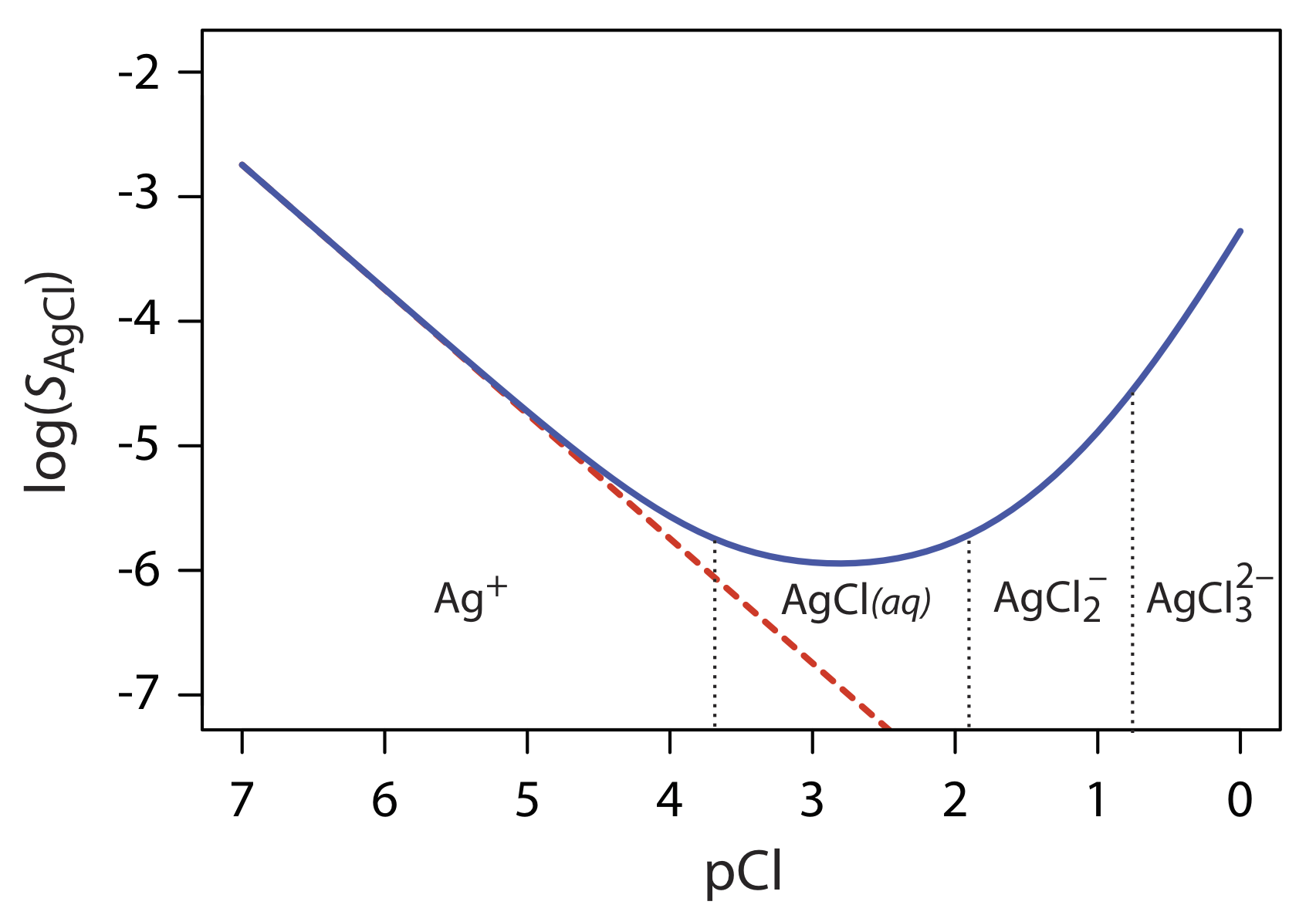
Щоб зрозуміти, чому розчинність AgCl є більш складною, ніж співвідношення, запропоноване Equation\ ref {8.2}, ми повинні нагадати, що Ag + також утворює ряд розчинних комплексів срібло-хлорметал—ліганд.
Зверніть увагу на різницю між реакцією\ ref {8.3}, в якій ми формуємо AgCl (aq) як продукт, і реакцією\ ref {8.1}, в якій ми формуємо AgCl (s) як продукт. Формування AgCl (aq) з AgCl (s)
\[\operatorname{AgCl}(s)\rightleftharpoons\operatorname{AgCl}(a q) \nonumber\]
називається внутрішньою розчинністю AgCl.
Фактична розчинність AgCl - це сума рівноважних концентрацій для всіх розчинних форм Ag +.
Підставивши в Equation\ ref {8.6} вирази рівноважної константи для реакції\ ref {8.1} та реакцій\ ref {8.3} —\ ref {8.5}, ми можемо визначити розчинність AgCl як
Рівняння\ ref {8.7} пояснює криву розчинності для AgCl, показану на малюнку Template:index. Коли ми додаємо NaCl до розчину Ag +, розчинність AgCl спочатку зменшується через реакцію\ ref {8.1}. За цих умов останні три члени в Equation\ ref {8.7} малі, а Equation\ ref {8.2} достатньо для опису розчинності AgCl. Для більш високих концентрацій Cl — реакція\ ref {8.4} і реакція\ ref {8.5} збільшують розчинність AgCl. Очевидно, що рівноважна концентрація хлориду важлива, якщо ми хочемо визначити концентрацію срібла шляхом осадження AgCl. Зокрема, треба уникати великого надлишку хлориду.
Переважні комплекси срібло-хлор для різних значень pCl показані сходовою діаграмою вздовж осі x на рисунку Template:index. Зверніть увагу, що збільшення розчинності починається тоді, коли розчинні комплекси вищого порядку\(\text{AgCl}_2^-\) і\(\text{AgCl}_3^{2-}\) є переважаючими видами.
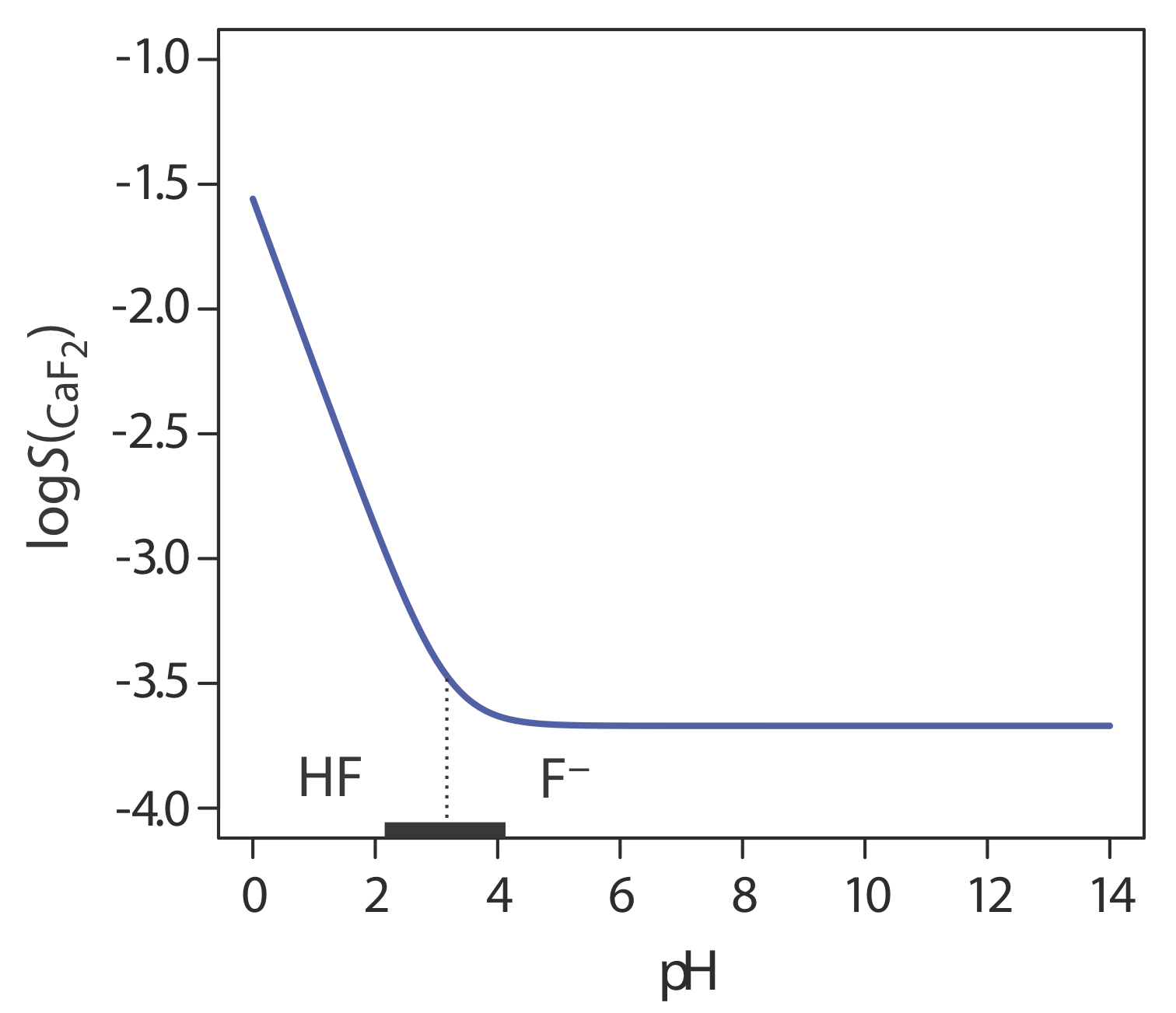
Ще одним важливим параметром, який може вплинути на розчинність осаду, є рН. Наприклад, осад гідроксиду, такий як Fe (OH) 3, більш розчинний при більш низьких рівнях рН, де концентрація ОН - невелика. Оскільки фтор є слабкою основою, розчинність фториду кальцію також залежить від рН.\(S_{\text{CaF}_2}\) Ми можемо вивести рівняння для\(S_{\text{CaF}_2}\) розгляду наступних реакцій рівноваги:
і наступне рівняння розчинності CaF 2.
Переконайтеся, що Equation\ ref {8.10} має сенс для вас. Реакція\ ref {8.8} говорить нам, що розчинення CaF 2 виробляє один моль Ca 2 + на кожні два молі F —, що пояснює термін 1/2 в Рівнянні\ ref {8.10}. Оскільки F — це слабка база, ми повинні враховувати обидві хімічні форми в розчині, що пояснює, чому ми включаємо HF.
Заміна виразів постійної рівноваги для реакції\ ref {8.8} та реакції\ ref {8.9} на Equation\ ref {8.10} дозволяє визначити розчинність CaF 2 через рівноважну концентрацію H 3 O +.
Рисунок Template:index показує, як рН впливає на розчинність CaF 2. Залежно від рН розчину, переважною формою фтору є HF або F —. Коли рН перевищує 4,17, переважаючим видом є F - а розчинність CaF 2 не залежить від рН, оскільки лише реакція\ ref {8.8} відбувається помітною мірою. При більш кислих рівнях рН розчинність CaF 2 збільшується через внесок реакції\ ref {8.9}.
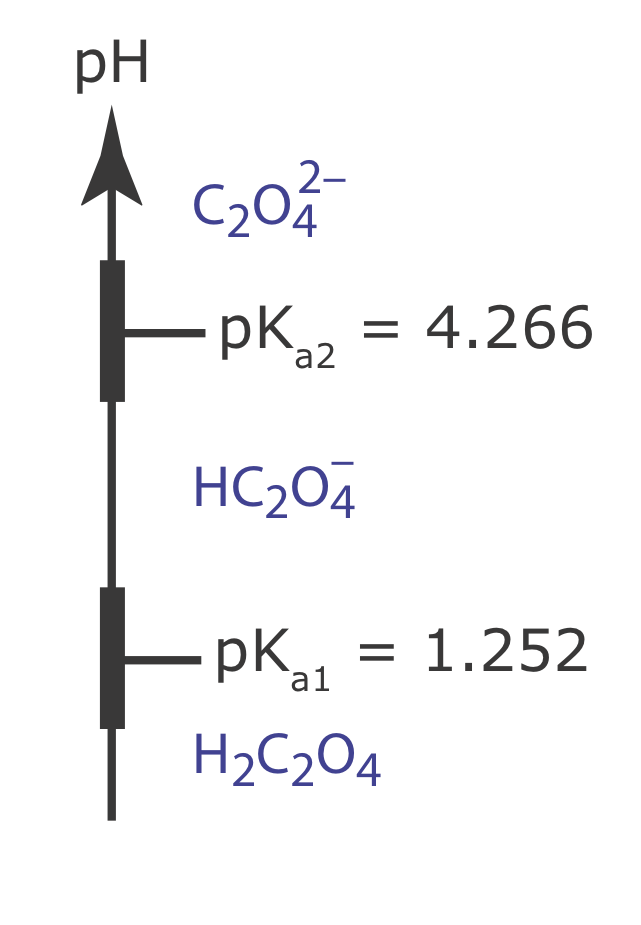
Ви можете використовувати діаграму сходів для прогнозування умов, які мінімізують розчинність осаду. Намалюйте сходову діаграму щавлевої кислоти, H 2 C2O 4, і використовуйте її для прогнозування діапазону значень рН, який мінімізує розчинність CaC 2 O 4. Відповідні константи рівноваги знаходяться в додатках.
- Відповідь
-
Реакція розчинності для CaC 2 O 4 становить
\[\mathrm{CaC}_{2} \mathrm{O}_{4}(s)\rightleftharpoons \mathrm{Ca}^{2+}(a q)+\mathrm{C}_{2} \mathrm{O}_{4}^{2-}(a q) \nonumber\]
Щоб мінімізувати розчинність, рН повинен бути досить основним, щоб оксалат\(\text{C}_2\text{O}_4^{2-}\),, не реагував на форму\(\text{HC}_2\text{O}_4^{-}\) H 2 C 2 O 4. Схема сходів щавлевої кислоти, включаючи приблизні буферні діапазони, показана нижче. Підтримка рН більше 5,3 гарантує, що\(\text{C}_2\text{O}_4^{2-}\) це єдина важлива форма щавлевої кислоти в розчині, мінімізуючи розчинність СаС 2 O 4.
Коли розчинність викликає занепокоєння, можливо зменшення розчинності за допомогою неводного розчинника. Розчинність осаду, як правило, більша у водному розчині через здатність води стабілізувати іони шляхом сольватування. Погана сольвуюча здатність неводного розчинника, навіть тих, які є полярними, призводить до меншої розчинності продукту. Наприклад, K sp PbSO 4 знаходиться\(2 \times 10^{-8}\) в Н 2 О і\(2.6 \times 10^{-12}\) в 50:50 суміші Н 2 О і етанолу.
Уникнення домішок
Крім того, що має низьку розчинність, осад повинен бути вільним від домішок. Оскільки опади зазвичай відбуваються в розчині, який багатий розчиненими твердими речовинами, початковий осад часто є нечистим. Щоб уникнути визначальної помилки, ми повинні видалити ці домішки, перш ніж визначити масу осаду.
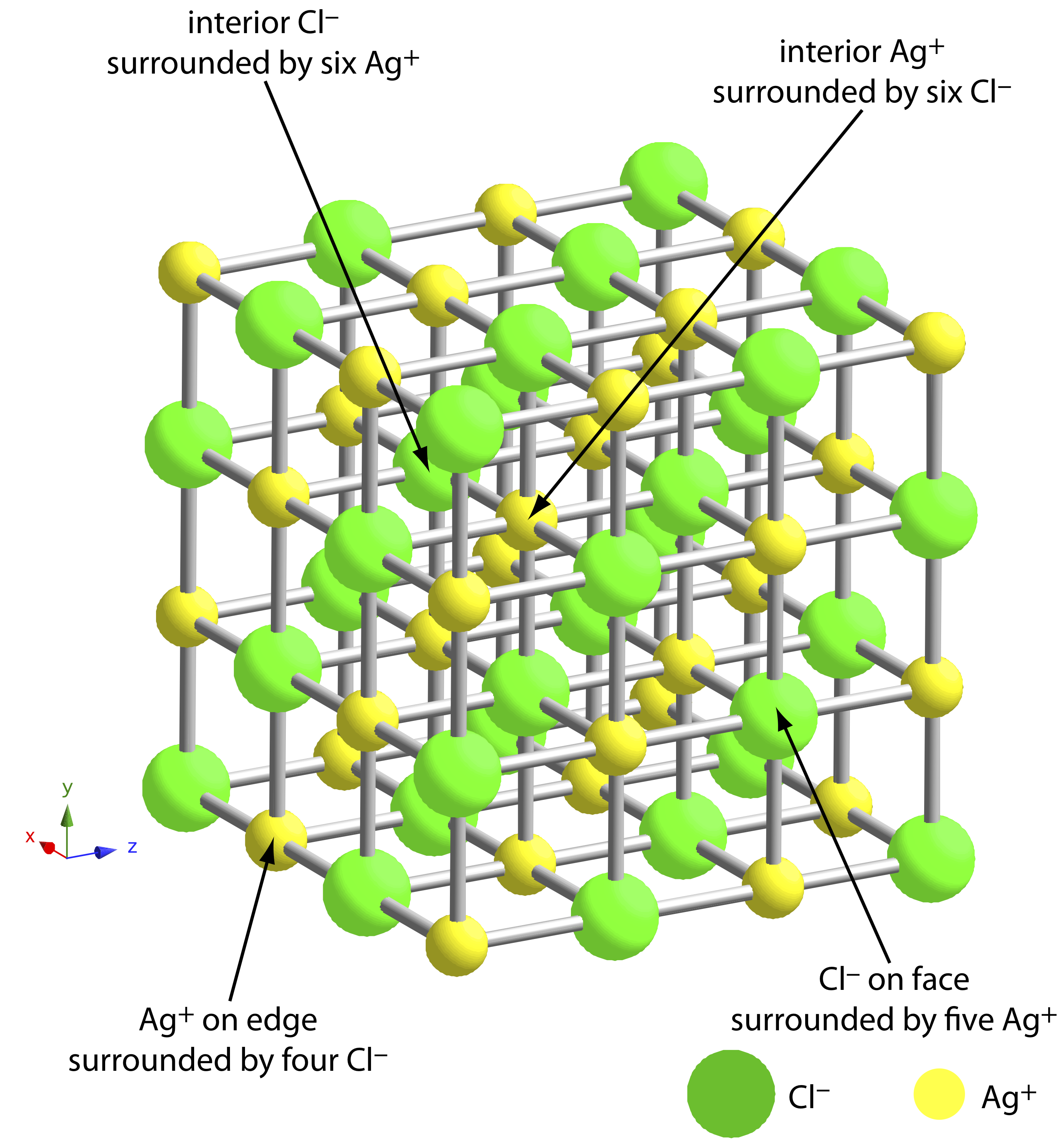
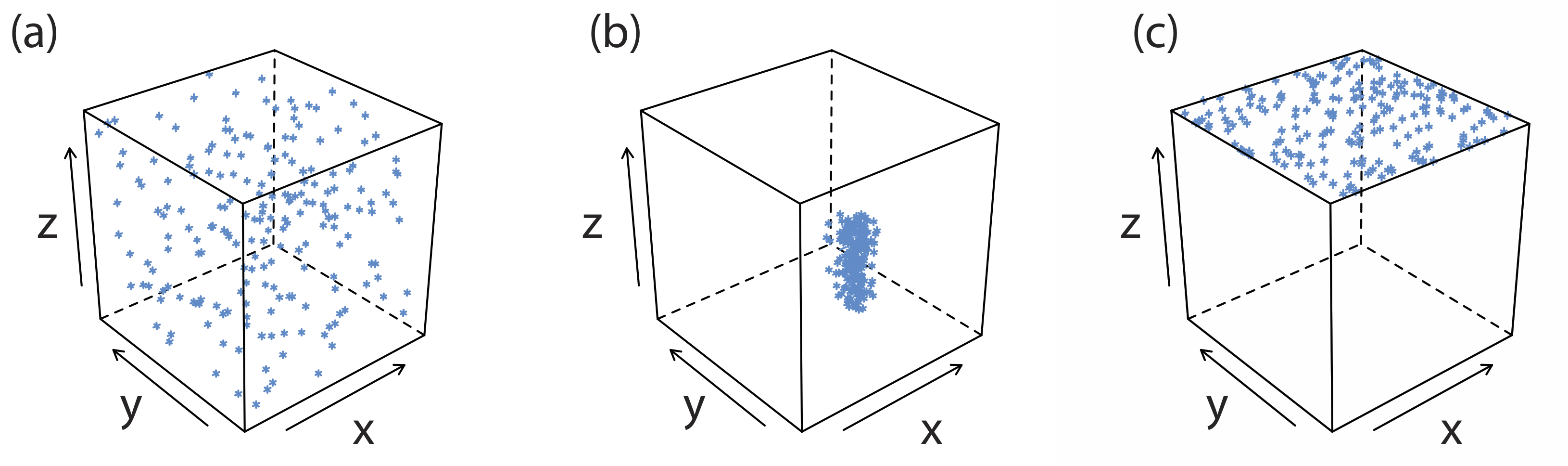
Найбільшим джерелом домішок є хімічні та фізичні взаємодії, які відбуваються на поверхні осаду. Осад, як правило, є кристалічним - навіть якщо тільки в мікроскопічному масштабі - з чітко визначеною решіткою катіонів та аніонів. Ці катіони та аніони на поверхні осаду несуть відповідно позитивний або негативний заряд, оскільки мають неповні координаційні сфери. Наприклад, в осаду AgCl кожен іон срібла у внутрішній частині осаду пов'язаний з шістьма іонами хлориду. Однак іон срібла на поверхні пов'язаний не більше ніж з п'ятьма іонами хлориду і несе частковий позитивний заряд (рис. Template:index). Наявність цих часткових зарядів робить поверхню осаду активною ділянкою для хімічних і фізичних взаємодій, які виробляють домішки.
Однією загальною домішкою є включення, при якому потенційний інтерферет, розмір і заряд якого схожі на іон решітки, може підставляти в структуру решітки, якщо інтерфрент випадає в осад з однаковою кристалічною структурою (Рисунок Template:Index a). Імовірність утворення включення є найбільшою, коли концентрація інтерференційного іона значно більша за концентрацію іонів решітки. Включення не зменшує кількість аналіту, який випадає в осад, за умови, що осад присутній в достатньому надлишку. Таким чином, маса осаду завжди більша, ніж очікувалося.
Включення важко видалити, оскільки воно хімічно є частиною решітки осаду. Єдиний спосіб видалити включення - через повторне осадження, в якому ми виділяємо осад з його супернатантного розчину, розчиняємо осад нагріванням в невеликій порції відповідного розчинника, а потім реформуємо осад, даючи розчину охолонути. Оскільки концентрація інтерферента після розчинення осаду менше, ніж у вихідному розчині, кількість включеного матеріалу зменшується після повторного осадження. Ми можемо повторювати процес повторного осадження до тих пір, поки маса включення не буде незначною. Втрата аналіту під час повторного осадження, однак, є потенційним джерелом детермінантної помилки.
Припустимо, що 10% інтерферента утворює включення під час кожного опадів. Коли ми спочатку формуємо осад, 10% вихідного інтерференту присутній як включення. Після першого повторного осадження 10% включених інтерферентних залишків, що становить 1% від початкового інтерференту. Друге повторне осадження зменшує інтерферент до 0,1% від початкової кількості.
Оклюзія утворюється, коли заважають іони потрапляють в пастку всередині зростаючого осаду. На відміну від включення, яке випадково диспергується всередині осаду, оклюзія локалізується або вздовж дефектів у структурі решітки осаду, або всередині агрегатів окремих частинок осаду (Рисунок Template:index b). Оклюзія зазвичай збільшує масу осаду; однак маса осаду менша, якщо оклюзія включає аналіт у більш низькій молекулярній формі, ніж осад.
Ми можемо мінімізувати оклюзію, підтримуючи осад в рівновазі зі своїм супернатантним розчином протягом тривалого часу, процес, який називається травленням. Під час травлення динамічний характер рівноваг розчинності—опадів, в яких осад розчиняється і реформується, гарантує, що оклюзія врешті-решт повторно піддається розчині супернатанту. Оскільки темпи розчинення та повторного осадження повільні, менше можливостей для формування нових оклюзій.
Після завершення осадження поверхня продовжує притягувати іони з розчину (рис. {{Template.index (ID:4)} c). Ці поверхневі адсорбати містять третій тип домішок. Ми можемо мінімізувати поверхневу адсорбцію за рахунок зменшення доступної площі поверхні осаду. Однією з переваг травлення є те, що він збільшує середній розмір частинок осаду. Оскільки ймовірність того, що частка повністю розчиниться, обернено пропорційна її розміру, при перетравленні більші частинки збільшуються в розмірах за рахунок більш дрібних частинок. Одним із наслідків утворення меншої кількості більших частинок є загальне зменшення площі поверхні осаду. Ми також можемо видалити поверхневі адсорбати, промиваючи осад, хоча ми не можемо ігнорувати потенційні втрати аналіту.
Включення, оклюзії та поверхневі адсорбати є прикладами копреципатів - інакше розчинних видів, які утворюються разом з осадом, який містить аналіт. Інший вид домішки - інтерферент, який в умовах аналізу утворює самостійний осад. Наприклад, осадження диметилгліоксиму нікелю вимагає трохи основного рН. За цих умов будь-який Fe 3 + у зразку випаде в осад як Fe (OH) 3. Крім того, оскільки більшість опадів рідко є вибірковими до одного аналіту, існує ризик того, що осадник реагує як з аналітом, так і з інтерферентом.
Крім утворення осаду з Ni 2 +, диметилгліоксим також утворює опади з Pd 2 + і Pt 2 +. Ці катіони є потенційними перешкодами в аналізі на нікель.
Ми можемо мінімізувати утворення додаткових опадів, контролюючи умови розчину. Якщо інтерферент утворює осад, який менш розчинний, ніж осад аналіту, ми можемо осаджувати інтерферент і видалити його шляхом фільтрації, залишаючи аналіт позаду в розчині. Крім того, ми можемо замаскувати аналіт або інтерферент, щоб запобігти його опадам. Обидва наведені вище підходи проілюстровані аналітичним методом Фрезеніуса для визначення Ni в рудах, які містять Pb 2 +, Cu 2+ та Fe 3 + (див. Рис. 1.1.1 в главі 1). Розчинення руди в присутності H 2 SO 4 вибірково випадає в осад Pb 2 + як PbSO 4. Обробка отриманого супернатанта Н 2 S осаджує Cu 2 + як Cu. Після видалення CU шляхом фільтрації в осад Fe 3 + додають аміак як Fe (ОН) 3. Нікель, який утворює розчинний амінний комплекс, залишається в розчині.
Маскування було введено в главі 7.
Контроль розміру частинок
Розмір має значення, коли мова йде про утворення осаду. Більші частинки легше фільтрувати, і, як зазначалося раніше, менша площа поверхні означає, що існує менша можливість утворення поверхневих адсорбатів. Контролюючи умови реакції, ми можемо значно збільшити середній розмір частинок осаду.
Освіта осаду складається з двох різних подій: зародження, початкового утворення більш дрібних, стійких частинок осаду і зростання частинок. Більші частинки утворюються, коли швидкість росту частинок перевищує швидкість зародження. Розуміння умов, що сприяють зростанню частинок, важливо, коли ми розробляємо гравіметричний метод аналізу.
Ми визначаємо відносне перенасичення розчиненої речовини, RSS, як
\[R S S=\frac{Q-S}{S} \label{8.12}\]
де Q - фактична концентрація розчиненої речовини, а S - концентрація розчиненої речовини в рівновазі [Von Weimarn, P. Chem. оборотів. 1925, 2, 217—242]. Чисельник рівняння\ ref {8.12}, Q — S, є мірою перенасичення розчиненої речовини. Розчин з великим позитивним значенням RSS має високу швидкість зародження і утворює осад з безліччю дрібних частинок. Коли RSS невеликий, випадання опадів частіше відбувається за рахунок зростання частинок, ніж шляхом зародження.
Пересичений розчин - це той, який містить більше розчиненої речовини, ніж передбачене рівноважною хімією. Перенасичений розчин за своєю суттю нестійкий і осаджує розчинену речовину, щоб досягти свого рівноважного положення. Наскільки швидко відбуваються опади, залежить, частково, від значення RSS.
Рівняння\ ref {8.12} передбачає, що ми можемо мінімізувати RSS, якщо ми зменшимо концентрацію розчиненої речовини, Q, або якщо ми збільшимо розчинність осаду, S. Розчинність осаду зазвичай збільшується при більш високих температурах, і регулювання рН може вплинути на розчинність осаду, якщо він містить кислий або основний іон. Температура і рН, отже, є корисними способами збільшення значення S. Формування осаду в розведеному розчині аналіту або додавання осадника повільно і при енергійному перемішуванні є способами зменшення значення Q.
Існують практичні межі мінімізації RSS. Деякі опади, такі як Fe (OH) 3 та PbS, настільки нерозчинні, що S дуже малий, а великий RSS неминучий. Такі розчинні речовини неминуче утворюють дрібні частинки. Крім того, умови, які сприяють невеликому RSS, можуть призвести до відносно стабільного перенасиченого розчину, який вимагає тривалого часу для повного осаду. Наприклад, майже місяць потрібно для утворення видимого осаду BasO 4 в умовах, в яких початковий RSS дорівнює 5 [Bassett, J.; Denney, R.C.; Jeffery, G.H. Mendham. Підручник Дж. Фогеля з кількісного неорганічного аналізу, Лонгман: Лондон, 4-е видання, 1981, стор. 408].
Видимий осад займає більше часу, щоб утворюватися, коли RSS невеликий як тому, що існує повільна швидкість зародження, так і тому, що відбувається стійке зниження RSS, коли осад утворюється. Одним з рішень останньої проблеми є генерація осадителя in situ як продукт повільної хімічної реакції, яка ефективно підтримує постійний RSS. Оскільки осад утворюється в умовах низького RSS, початкове зародження виробляє невелику кількість частинок. Як додаткові осаджуючі форми, ріст частинок витісняє зародження, що призводить до більших частинок осаду. Цей процес називається однорідним опаданням [Gordon, L.; Salutsky, M.L.; Willard, H. Опади з однорідного розчину, Wiley: NY, 1959].
Для однорідного осадження використовуються два загальних методу. Якщо розчинність осаду залежить від рН, то ми можемо змішати аналіт і осад в умовах, коли випадання опадів не відбувається, а потім збільшити або зменшити рН шляхом хімічної генерації OH - або H 3 O +. Наприклад, гідроліз сечовини, CO (NH 2) 2, є джерелом OH — через наступні дві реакції.
\[\mathrm{CO}\left(\mathrm{NH}_{2}\right)_{2}(a q)+\mathrm{H}_{2} \mathrm{O}( l)\rightleftharpoons2 \mathrm{NH}_{3}(a q)+\mathrm{CO}_{2}(g) \nonumber\]
\[\mathrm{NH}_{3}(a q)+\mathrm{H}_{2} \mathrm{O}( l)\rightleftharpoons\mathrm{OH}^{-}(a q)+\mathrm{NH}_{4}^{+}(a q) \nonumber\]
Оскільки гідроліз сечовини залежить від температури - швидкість незначна при кімнатній температурі - ми можемо використовувати температуру для контролю швидкості гідролізу та швидкості утворення осаду. Осади СаС 2 О 4, наприклад, були отримані цим методом. Після розчинення зразка, який містить Са 2 +, розчин роблять кислим з HCl перед додаванням розчину 5% в/в (NH 4) 2 C 2 O 4. Оскільки розчин кислий, осад СаС 2 О 4 не утворюється. Розчин нагрівають приблизно до 50 о С і додають сечовину. Через кілька хвилин починає утворюватися осад СаС 2 О 4, при цьому опади досягають завершення приблизно через 30 хв.
При другому способі однорідного осадження осад утворюється хімічною реакцією. Наприклад, Pb 2 + осаджується однорідно, як PbCrO 4 за допомогою бромату\(\text{BrO}_3^-\), для окислення Cr 3 + до\(\text{CrO}_4^{2-}\).
\[6 \mathrm{BrO}_{3}^{-}(a q)+10 \mathrm{Cr}^{3+}(a q)+22 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons 3 \mathrm{Br}_{2}(a q)+10 \mathrm{CrO}_{4}^{2-}(a q)+44 \mathrm{H}^{+}(a q) \nonumber\]
Рисунок Template:index показує результат отримання PbCrO 4 шляхом прямого додавання K 2 CrO 4 (мензурка A) та однорідним осадженням (стакан B). Обидві склянки містять однакову кількість PbCrO 4. Оскільки безпосереднє додавання К 2 CrO 4 призводить до швидкого осадження і утворення більш дрібних частинок, осад залишається менш осілим, ніж осад, приготований однорідно. Зверніть увагу, також, різниця в кольорі двох випадає в осад.

Вплив розміру частинок на колір добре відомий геологам, які використовують смуговий тест, щоб допомогти ідентифікувати мінерали. Колір об'ємного мінералу і його колір при порошкоподібному часто бувають різними. Натирання мінералу поперек неглазурованої порцелянової тарілки залишає після себе невелику смугу порошкоподібного мінералу. Об'ємні зразки гематиту, Fe 2 O 3, мають чорний колір, але його смуга - звичний іржаво-червоний. Кроцит, мінерал PbCrO 4, має червоно-оранжевий колір, його смуга оранжево-жовта.
При однорідному опаді утворюються великі частинки осаду, відносно вільні від домішок. Ці переваги, однак, компенсуються збільшенням часу, необхідного для отримання осаду, і тенденцією осаду до осадження у вигляді тонкої плівки на стінках контейнера. Остання проблема особливо серйозна для гідроксидних осадів, що утворюються за допомогою сечовини.
Додатковий метод збільшення розміру частинок заслуговує згадки. Коли частинки осаду електрично нейтральні, вони, як правило, коагулюються на більші частинки, які легше фільтрувати. Поверхнева адсорбція надлишкових іонів решітки, однак, забезпечує частинки осаду чистим позитивним або чистим негативним поверхневим зарядом. Електростатичне відштовхування між частинками подібного заряду перешкоджає їх згортанню в більші частинки.
Давайте використаємо осадження AgCl з розчину AgNO 3 з використанням NaCl як осадника, щоб проілюструвати цей ефект. На початку осадження, коли NaCl є граничним реагентом, надлишкові іони Ag + хімічно адсорбуються до частинок AgCl, утворюючи позитивно заряджений первинний адсорбційний шар (рис. Template:index a). Розчин, що контактує з цим шаром, містить більше інертних аніонів,\(\text{NO}_3^-\) в даному випадку, ніж інертні катіони, Na +, що дає вторинний адсорбційний шар з негативним зарядом, який врівноважує позитивний заряд первинного адсорбційного шару. Розчин поза вторинним адсорбційним шаром залишається електрично нейтральним. Коагуляція не може відбуватися, якщо вторинний адсорбційний шар занадто товстий, оскільки окремі частинки AgCl не можуть наблизитися один до одного досить близько.
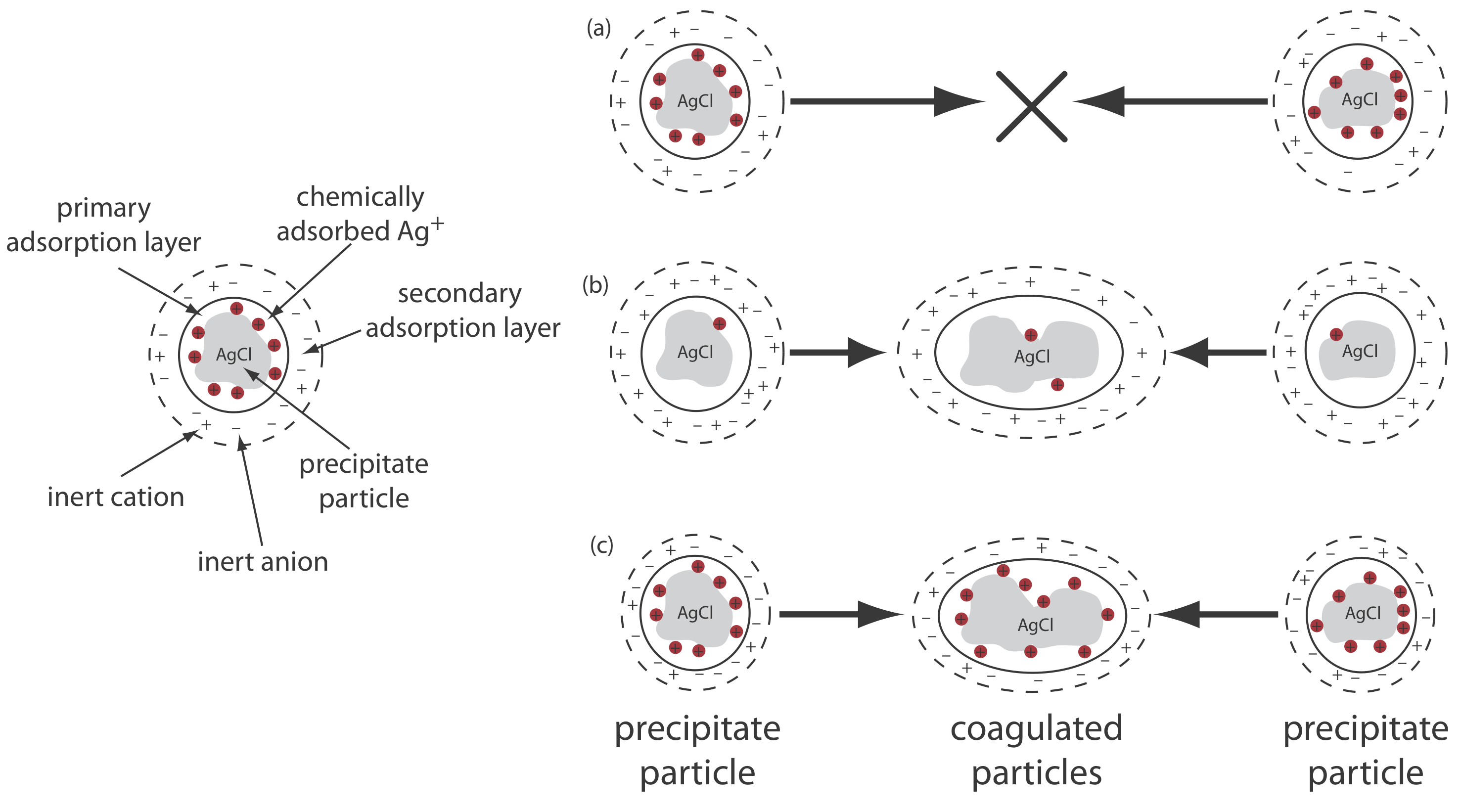
Ми можемо індукувати коагуляцію трьома способами: зменшенням кількості хімічно адсорбованих іонів Ag +, збільшенням концентрації інертних іонів або нагріванням розчину. Коли ми додаємо додатковий NaCl, осаджуючи більше надлишку Ag +, кількість хімічно адсорбованих іонів срібла зменшується і відбувається коагуляція (рис. Template:index b). Додавання занадто великої кількості NaCl, однак, створює первинний адсорбційний шар надлишку Cl - з втратою коагуляції.
Згортання і декоагуляція AgCl, коли ми додаємо NaCl до розчину AgNO 3, можуть служити кінцевою точкою для титрування. Див. розділ 9 для отримання додаткової інформації.
Другим способом індукування коагуляції є додавання інертного електроліту, який збільшує концентрацію іонів у вторинному адсорбційному шарі (рис. Template:index c). При наявності більшої кількості іонів товщина шару вторинного поглинання зменшується. Частинки осаду тепер можуть наближатися один до одного ближче, що дозволяє осаду згортатися. Кількість електроліту, необхідного для виклику спонтанної коагуляції, називається критичною концентрацією згортання.
Нагрівання розчину і осаду забезпечує третій спосіб індукувати коагуляцію. Зі збільшенням температури кількість іонів в первинному адсорбційному шарі зменшується, що знижує поверхневий заряд осаду. Крім того, нагрівання збільшує кінетичну енергію частинок, дозволяючи їм подолати електростатичне відштовхування, що перешкоджає коагуляції при більш низьких температурах.
Фільтрація осаду
Після випадання в осад і перетравлення осаду відокремлюємо його від розчину фільтруванням. Найбільш поширеним методом фільтрації використовується фільтрувальний папір, яка класифікується за швидкістю, розміром і зольності при запалюванні. Швидкість, або як швидко супернатант проходить через фільтрувальний папір, є функцією розміру пор паперу. Більший розмір пір дозволяє супернатанту швидше проходити крізь фільтрувальний папір, але не затримує дрібні частинки осаду. Фільтрувальний папір оцінюється як швидка (затримує частинки розміром більше 20-25 мкм), середньо-швидка (затримує частинки розміром більше 16 мкм), середовище (затримує частинки розміром більше 8 мкм) та повільну (зберігає частинки розміром більше 2-3 мкм). Важливий правильний вибір швидкості фільтрації. Якщо швидкість фільтрації занадто висока, ми можемо не зберегти частину осаду, що спричиняє негативну детермінантну помилку. З іншого боку, осад може закупорити пори, якщо ми використовуємо занадто повільний фільтрувальний папір.
Розмір фільтрувального паперу - це лише його діаметр. Фільтрувальний папір поставляється в багатьох розмірах, включаючи 4,25 см, 7,0 см, 11,0 см, 12,5 см, 15,0 см і 27,0 см. Виберіть розмір, який зручно вписується у вашу воронку. Для типової воронки довжиною 65 мм хороший вибір фільтрувального паперу 11,0 см і 12,5 см.
Оскільки фільтрувальний папір гігроскопічна, її непросто висушити до постійної ваги. Коли важлива точність, фільтрувальний папір видаляється перед тим, як визначити масу осаду. Після перенесення осаду і фільтрувального паперу в критий тигель ми нагріваємо тигель до температури, яка покриває папір до CO 2 (g) і H 2 O (g), процес, званий запалюванням.
Запалювання фільтрувального паперу низької якості залишає після себе залишок неорганічної золи. Для кількісної роботи використовуйте низькозольний фільтрувальний папір. Цей сорт фільтрувального паперу попередньо обробляється сумішшю HCl і HF для видалення неорганічних матеріалів. Кількісний фільтрувальний папір зазвичай має зольність менше 0,010% Вт/Вт.
Гравітаційна фільтрація здійснюється шляхом складання фільтрувального паперу в конус і розміщення його в воронці з довгим стовбуром (Рисунок Template:index). Щоб утворилося щільне ущільнення між конусом фільтра і воронкою, змочуємо папір водою або супернатантом і притискаємо папір до стінки воронки. При правильному приготуванні стебло воронки заповнюється супернатантом, збільшуючи швидкість фільтрації.
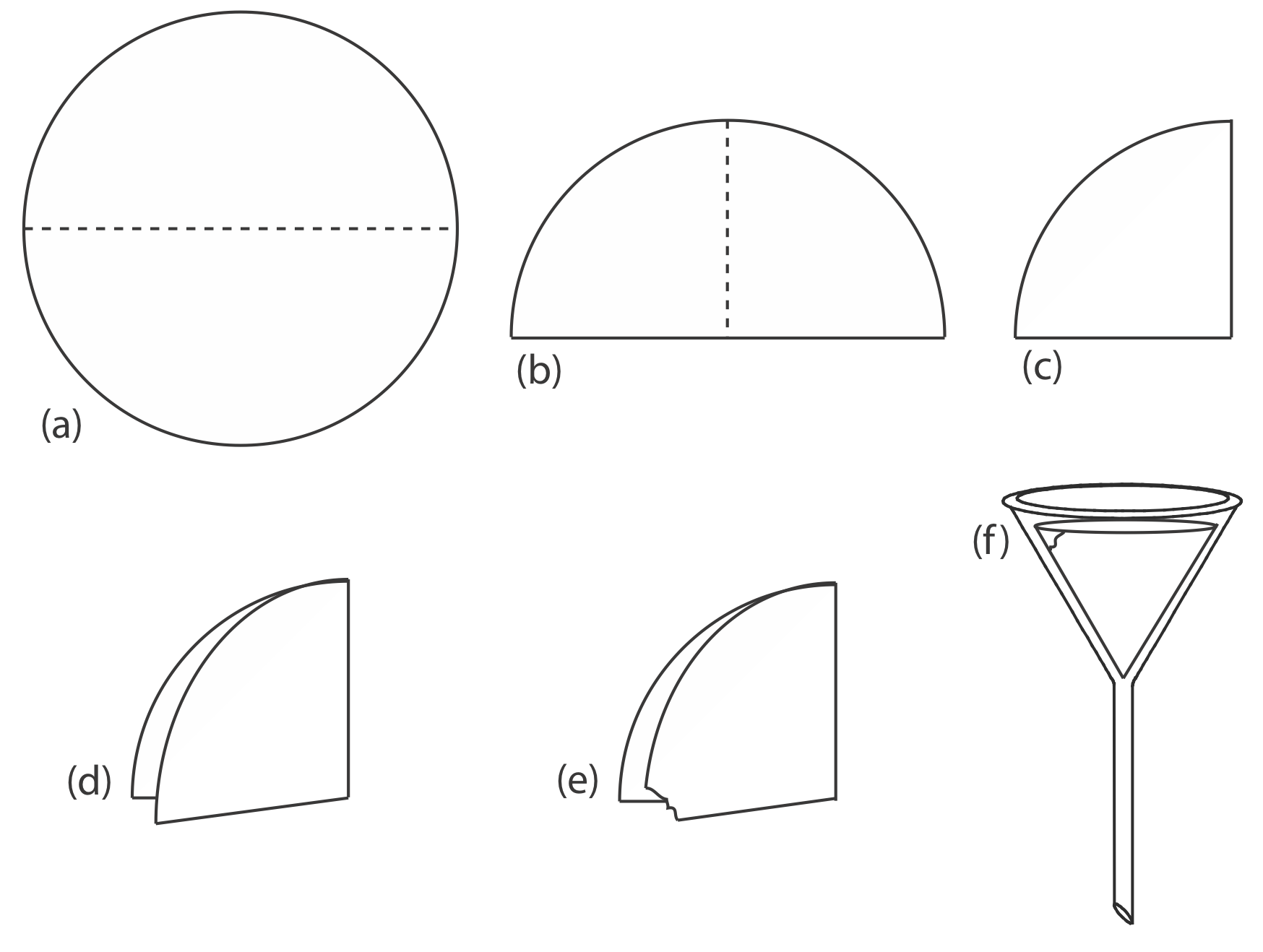
куточок (е) перед тим, як папір розкривається в конус і поміщається в воронку (f).
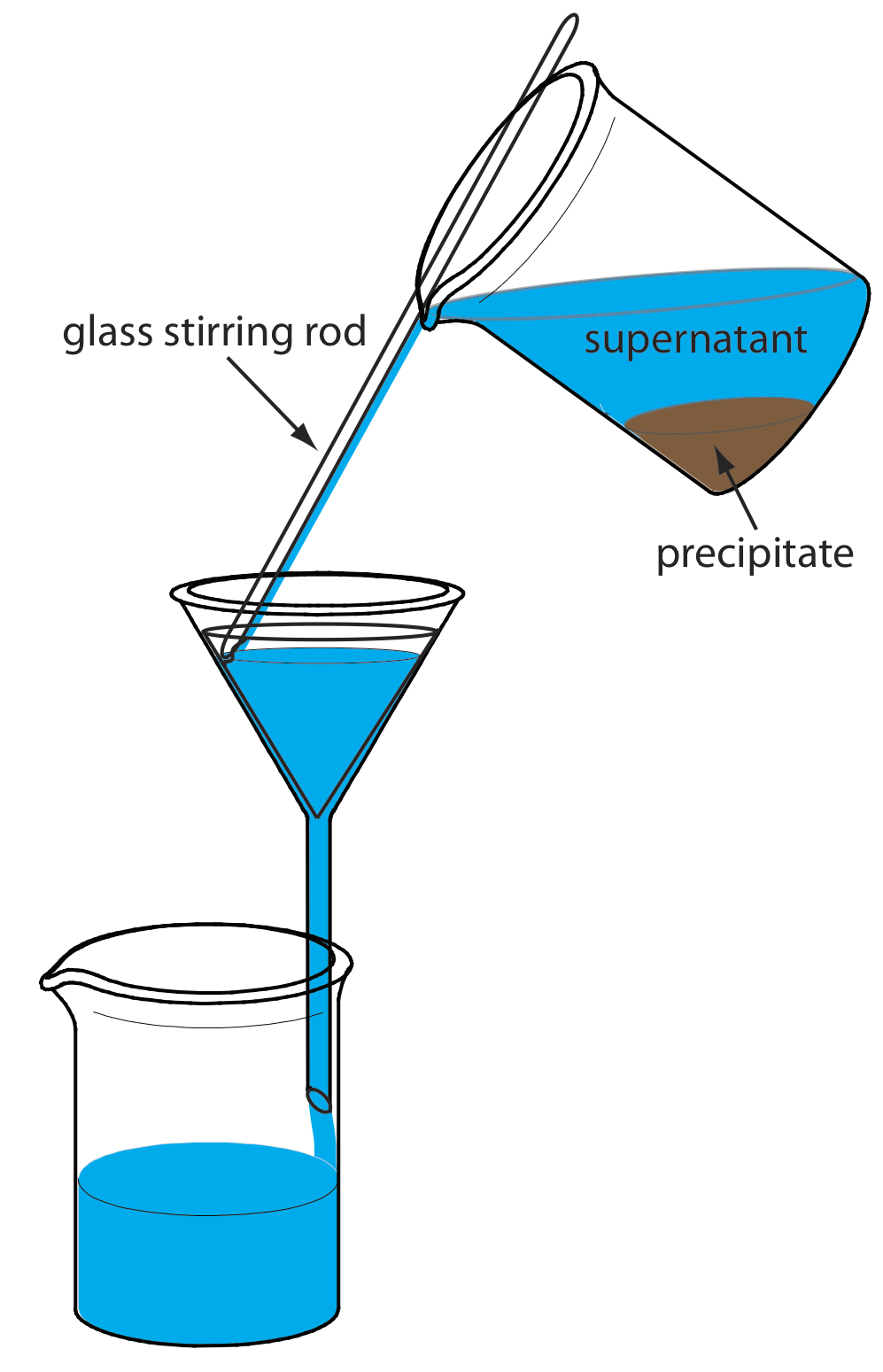
Осад переноситься на фільтр в кілька прийомів. Першим кроком є зціджування більшості супернатанта через фільтрувальний папір без перенесення осаду (Рисунок Template:index). Це запобігає засміченню фільтрувального паперу на початку процесу фільтрації. Осад промивають, поки він залишається в його склянці, при цьому полоскання зціджують через фільтрувальний папір. Нарешті, осад переноситься на фільтрувальний папір за допомогою потоку розчину для полоскання. Будь-який осад, який чіпляється за стінки склянки, переноситься за допомогою гумового поліцейського (гнучкого гумового шпателя, прикріпленого до кінця скляного перемішувального стрижня).
Альтернативним методом фільтрації осаду є використання фільтруючого тигля. Найпоширеніший варіант - це тигель зі скла, який містить пористий скляний дисковий фільтр. Ошатні скляні тиглі класифікуються за їх пористістю: грубі (утримують частинки розміром більше 40-60 мкм), середні (затримують частинки більше 10-15 мкм) і дрібні (затримують частинки більше 4—5,5 мкм). Іншим видом фільтруючого тигля є тигель Гуча, який представляє собою порцеляновий тигель з перфорованим дном. У тигель поміщають килимок зі скловолокна, щоб утримати осад. Для обох типів тиглів преципітат переноситься тим же способом, описаним раніше для фільтрувального паперу. Замість того, щоб використовувати гравітацію, супернатант витягується через тигель за допомогою всмоктування з вакуумного аспіратора або насоса (Рисунок Template:index).
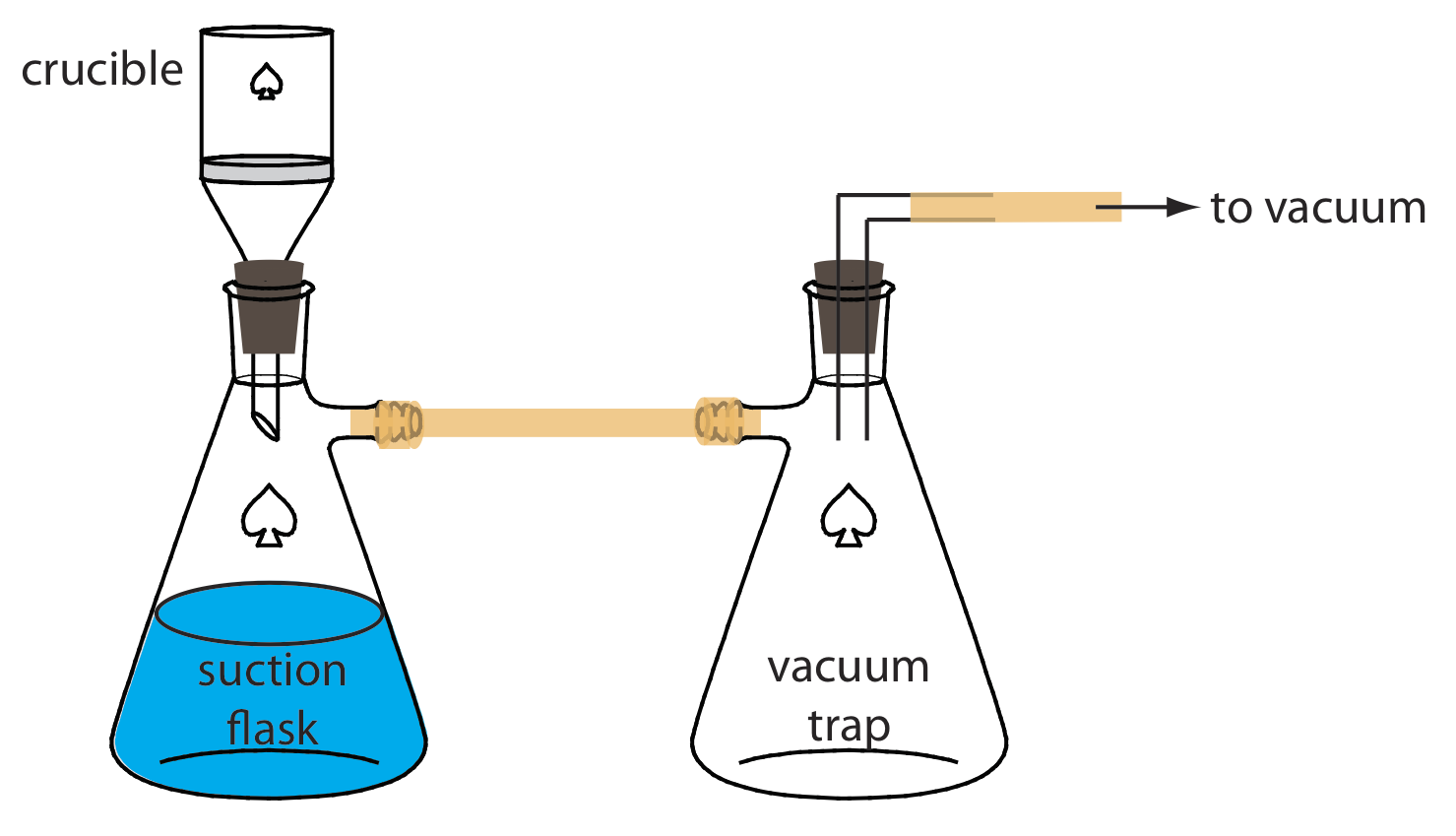
Промивання осаду
Оскільки супернатант багатий розчиненими інертними іонами, ми повинні видалити залишкові сліди супернатанту без втрати аналіту через розчинність. У багатьох випадках це просто передбачає використання холодних розчинників або розчинів для полоскання, які містять органічні розчинники, такі як етанол. РН розчину для полоскання має вирішальне значення, якщо осад містить кислий або основний іон. Коли коагуляція відіграє важливу роль у визначенні розміру частинок, додавання летючого інертного електроліту в розчин для промивання запобігає поверненню осаду на більш дрібні частинки, які можуть пройти через фільтр. Цей процес повернення до більш дрібних частинок називається пептизацією. Летючий електроліт видаляється при висиханні осаду.
Загалом, ми можемо мінімізувати втрати аналіту, якщо замість одного великого обсягу використовувати кілька невеликих порцій розчину для полоскання. Тестування використовуваного розчину для полоскання на наявність домішки - ще один спосіб захистити від надмірного промивання осаду. Наприклад, якщо Cl — залишковий іон у супернатанті, ми можемо перевірити його наявність за допомогою AgNO 3. Після того як наберемо невелику порцію розчину для полоскання, додаємо кілька крапель AgNO 3 і шукаємо наявність або відсутність осаду AgCl. Якщо утворюється осад, то ми знаємо Cl — присутній і продовжуємо промивати осад. Додаткове полоскання не потрібно, якщо AgNO 3 не виробляє осад.
Сушка осаду
Після відділення осаду від його супернатантного розчину висушуємо осад, щоб видалити залишкові сліди розчину для полоскання і для видалення будь-яких летючих домішок. Температура і спосіб сушіння залежать від способу фільтрації і бажаної хімічної форми осаду. Поміщення осаду в лабораторну піч і нагрівання до температури 110 о С досить для видалення води та інших легко випаровуються домішок. Більш високі температури вимагають муфельної печі, пальника Бунзена або пальника Мекера, і необхідні, якщо нам потрібно розкласти осад до визначення його ваги.
Оскільки фільтрувальний папір вбирає вологу, ми повинні видалити її, перш ніж зважити осад. Це досягається шляхом складання фільтрувального паперу над осадом і перенесення як фільтрувального паперу, так і осаду в порцеляновий або платиновий тигель. Ніжне нагрівання спочатку висихає, а потім застигає фільтрувальний папір. Як тільки папір починає обвуглювати, ми повільно збільшуємо температуру, поки не залишиться сліду від фільтрувального паперу і будь-який залишився вуглець окислюється до CO 2.
Круглоскляні тиглі не витримують високих температур і сушаться в печі при температурі нижче 200 о С. Скловолокнисті мати, що використовуються в тиглі Gooch, можуть нагріватися до максимальної температури приблизно 500 о С.
Склад кінцевого осаду
Для кількісного застосування кінцевий осад повинен мати чітко виражений склад. Осад, який містить летючі іони або значну кількість гідратованої води, зазвичай сушать при температурі, яка повністю видаляє ці летючі види. Наприклад, один стандартний гравіметричний метод визначення магнію передбачає його осадження як MgNH 4 PO 4 •6H 2 O. На жаль, цей осад важко висушити при більш низьких температурах без втрати непостійної кількості гідратованої води і аміаку. Замість цього осад сушать при температурі більше 1000 о С, де він розкладається до пірофосфату магнію, Mg 2 P 2 O 7.
Додаткова проблема зустрічається, якщо ізольоване тверде тіло є нестехіометричним. Наприклад, осадження Mn 2 + як Mn (OH) 2 і нагрівання часто утворюють нестехіометричний оксид марганцю, MnO x, де x варіюється від одного до двох. При цьому нестехіометричний продукт є результатом утворення суміші оксидів з різним ступенем окислення марганцю. Інші нестехіометричні сполуки утворюються в результаті гратчастих дефектів кристалічної структури [Уорд, Р., ред., Нестехіометричні сполуки (Ad. Хім. Сер. 39), Американське хімічне товариство: Вашингтон, округ Колумбія, 1963].
Представницький метод 8.2.1: Визначення Mg у воді та стічних водах
Найкращий спосіб оцінити теоретичні та практичні деталі, розглянуті в цьому розділі, - це уважно вивчити типовий гравіметричний метод опадів. Хоча кожен метод унікальний, визначення Mg 2 + у воді та стічних водах шляхом осадження MgNH 4 PO 4 • 6H 2 O та виділення Mg 2 P 2 O 7 дає повчальний приклад типової процедури. Опис тут базується на методі 3500-Mg D у стандартних методах дослідження води та стічних вод, 19-е видання, Американська асоціація охорони здоров'я: Вашингтон, округ Колумбія, 1995. З публікацією 20-го видання в 1998 році цей метод більше не числиться затвердженим методом.
Опис методу
Магній осаджується як MgNH 4 PO 4 • 6H 2 O, використовуючи (NH 4) 2 HPO 4 як осадитель. Розчинність осаду в нейтральному розчині відносно висока (0,0065 г/100 мл в чистій воді при 10 о С), але набагато менш розчинний в присутності розведеного аміаку (0,0003 г/100 мл в 0,6 М NH 3). Оскільки осаджувач не є селективним, необхідне попереднє відділення Mg 2 + від потенційних перешкод. Кальцій, який є найбільш значущим інтерферентом, видаляється шляхом його осадження у вигляді CaC 2 O 4. Наявність надлишку солей амонію з осадителя, або від додавання занадто великої кількості аміаку, призводить до утворення Mg (NH 4) 4 (PO 4) 2, який після висихання утворює Mg (PO 3) 2. Осад виділяють шляхом гравітаційної фільтрації, використовуючи розчин для полоскання розведеного аміаку. Після фільтрування осад перетворюють в Mg 2 P 2 O 7 і зважують.
Порядок дій
Перенесіть зразок, який містить не більше 60 мг Mg 2 +, в склянку 600-мл. Додайте 2-3 краплі індикатора метилового червоного кольору, і при необхідності відрегулюйте обсяг до 150 мл. Підкислюють розчин 6 М HCl і додають 10 мл 30% в/в (NH 4) 2 HPO 4. Після охолодження і при постійному перемішуванні додають концентрований NH 3 крапельно, поки індикатор метилового червоного кольору не стане жовтим (pH > 6,3). Після перемішування протягом 5 хв додайте 5 мл концентрованого NH 3 і продовжуйте перемішувати ще 10 хв. Дайте отриманому розчину і осаду постояти протягом ночі. Ізолювати осад, фільтруючи через фільтрувальний папір, промиваючи 5% v/v NH 3. Розчиніть осад у 50 мл 10% в/в HCl і осад вдруге після тієї ж процедури. Після фільтрування акуратно зніміть фільтрувальний папір шляхом обвуглювання. Нагріти осад при 500 o С до білого кольору, а потім довести осад до постійної маси при 1100 о С.
Питання
1. Чому процедура вимагає проби, яка містить не більше 60 мг Mg 2 +?
60-мг порції Mg 2 + генерує приблизно 600 мг MgNH 4 PO 4 • 6H 2 O, що є значною кількістю осаду. Більша кількість осаду важко фільтрується і важко промивається без домішок.
2. Чому розчин підкислюється HCl перед тим, як ми додаємо осад?
HCl гарантує, що MgNH 4 PO 4 • 6H 2 O не випадає в осад відразу після додавання осаду. Оскільки\(\text{PO}_4^{3-}\) є слабкою основою, осад розчиняється в сильнокислому розчині. Якщо додати осад в нейтральних або базових умовах (тобто високий RSS), то отриманий осад буде складатися з більш дрібних, менш чистих частинок. Збільшення рН шляхом додавання основи дозволяє осаду утворюватися при більш сприятливих (тобто низькому RSS) умовах.
3. Чому в розчин додають кислотно-базовий індикатор метилового червоного кольору?
Індикатор змінює колір при рН приблизно 6,3, що вказує на те, що NH 3 достатньо для нейтралізації HCl, доданого на початку процедури. Кількість NH 3 має вирішальне значення для цієї процедури. Якщо додати недостатню кількість NH 3, то розчин виходить занадто кислим, що збільшує розчинність осаду і призводить до негативної детермінантної похибки. Якщо додати занадто багато NH 3, осад може містити сліди Mg (NH 4) 4 (PO 4) 2, який при сушінні утворює Mg (PO 3) 2 замість Mg 2 P 2 O 7. Це збільшує масу запаленого осаду, і дає позитивну детермінантну похибку. Після додавання достатньої кількості NH 3 для нейтралізації HCl ми додаємо додатково 5 мл NH 3 для завершення кількісного осадження MgNH 4 PO 4 • 6H 2 O.
4. Поясніть, чому формування Mg (PO 3) 2 замість Mg 2 P 2 O 7 збільшує масу осаду.
Кожен моль Mg 2 P 2 O 7 містить два молі магнію і кожен моль Mg (PO 3) 2 містить тільки один моль магнію. Отже, збереження маси вимагає, щоб на місці кожного моля Mg 2 P 2 утворювалися дві молі Mg (PO 3) 2 O 7. Один моль Mg 2 P 2 O 7 важить 222,6 м Дві молі Mg (PO 3) 2 важать 364,5 м Будь-яка заміна Mg 2 P 2 O 7 Mg (PO 3) 2 повинна збільшити масу осаду.
5. Які додаткові кроки, крім тих, що обговорюються в питаннях 2 і 3, допомагають поліпшити чистоту осаду?
Два додаткових етапи процедури допомагають утворити осад, вільний від домішок: травлення і повторне осадження.
6. Чому осад промивають розчином 5% в/в NH 3?
Робиться це з тієї ж причини, що осадження проводиться в амонічному розчині; використання розведеного аміаку мінімізує втрати розчинності при промиванні осаду.
Кількісні програми
Хоча вже не є поширеним аналітичним прийомом, гравіметрія опадів все ж забезпечує надійний підхід для оцінки точності інших методів аналізу, або для перевірки складу стандартних еталонних матеріалів. У цьому розділі ми розглянемо загальне застосування осаджувальної гравіметрії до аналізу неорганічних та органічних сполук.
неорганічний аналіз
У таблиці Template:index наведено резюме гравіметричних методів осадження неорганічних катіонів та аніонів. Кілька методів однорідної генерації осадників наведено в таблиці Template:index. Більшість неорганічних осадників виявляють погану селективність для аналіту. Однак багато органічних осадників є селективними для одного або двох неорганічних іонів. У таблиці Template:index наведено приклади кількох поширених органічних осадників.
| аналіт | осаджувач | утворюється осад | осад зважений |
|---|---|---|---|
|
Ба 2 + |
(Н 42) Кро 4 | Бакро 4 | Бакро 4 |
| Пб 2 + | К 2 КрО 4 | ПБКро 4 | ПБКро 4 |
| Вік + | HCl | AgCl | AgCl |
| \(\text{Hg}_2^{2+}\) | HCl | Хг 2 Сл 2 | Хг 2 Сл 2 |
| Всі 3 + | NH 3 | Аль (ОН) 3 | Всі 2 з 3 |
| Будьте 2+ | NH 3 | Бути (ОН) 2 | БеО |
| Фе 3 + | NH 3 | Фе (ОН) 3 | Фр 2 З 3 |
| Ка 2+ | (Н 42) Кро 4 | СаС 2 О 4 | СаСО 3 або СаО |
| Сб 3 + | Н 2 С | Сб 2 С 3 | Сб 2 С 3 |
| Як 3 + | Н 2 С | Як 2 S 3 | Як 2 S 3 |
| Рт 2+ | Н 2 С | ГГ | ГГ |
| Ба 2+ | Н 2 ТАК 4 | Басо 4 | Басо 4 |
| Пб 2+ | Н 2 ТАК 4 | ПБСО 4 | PbSO 4 |
| Ср 2+ | Н 2 ТАК 4 | СРСО 4 | СРСО 4 |
| Бути 3 + | (НЧ 42) HP 4 | NH 4 БеПО 4 | Будьте 2 П 2 О 7 |
| Мг 2+ | (НЧ 42) HP 4 | NH 4 МГПО 4 | Мг 2 П 2 О 7 |
| Зн 2+ | (НЧ 42) HP 4 | НЧ 4 ЗнПО 4 | Зн 2 П 2 О 7 |
| Ср 2+ | КХ 2 ПО 4 | СРШПО 4 | Ср 2 П 2 О 7 |
| CN — | Гано 3 | AgCN | AgCN |
| I— | Гано 3 | AGI | AGI |
| Бр — | Гано 3 | AgBr | AgBr |
| Cl — | Гано 3 | AgCl | AgCl |
| \(\text{ClO}_3^-\) | ЕСО 4 /Агно 3 | AgCl | AgCl |
| СКН — | СО 2 /кусо 4 | CusCN | CusCN |
| \(\text{SO}_4^2-\) | БакЛ 2 | Басо 4 | Басо 4 |
| осаджувач | реакція |
|---|---|
| ОЙ— | \(\left(\mathrm{NH}_{2}\right)_{2} \mathrm{CO}(a q)+3 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons2 \mathrm{NH}_{4}^{+}(a q)+\mathrm{CO}_{2}(g)+2 \mathrm{OH}^{-}(a q)\) |
|
\(\text{SO}_4^{2-}\) |
\(\mathrm{NH}_{2} \mathrm{HSO}_{3}(a q)+2 \mathrm{H}_{2} \mathrm{O}(l )\rightleftharpoons\mathrm{NH}_{4}^{+}(a q)+\mathrm{H}_{3} \mathrm{O}^{+}(a q)+\mathrm{SO}_{4}^{2-}(a q)\) |
| S 2— | \(\mathrm{CH}_{3} \mathrm{CSNH}_{2}(a q)+\mathrm{H}_{2} \mathrm{O}(l )\rightleftharpoons\mathrm{CH}_{3} \mathrm{CONH}_{2}(a q)+\mathrm{H}_{2} \mathrm{S}(a q)\) |
| \(\text{IO}_3^-\) | \(\mathrm{HOCH}_{2} \mathrm{CH}_{2} \mathrm{OH}(a q)+\mathrm{IO}_{4}^{-}(a q)\rightleftharpoons2 \mathrm{HCHO}(a q)+\mathrm{H}_{2} \mathrm{O}(l)+\mathrm{IO}_{3}^{-}(a q)\) |
| \(\text{PO}_4^{3-}\) | \(\left(\mathrm{CH}_{3} \mathrm{O}\right)_{3} \mathrm{PO}(a q)+3 \mathrm{H}_{2} \mathrm{O}(l)\rightleftharpoons3 \mathrm{CH}_{3} \mathrm{OH}(a q)+\mathrm{H}_{3} \mathrm{PO}_{4}(a q)\) |
| \(\text{C}_2\text{O}_4^{2-}\) | \(\left(\mathrm{C}_{2} \mathrm{H}_{5}\right)_{2} \mathrm{C}_{2} \mathrm{O}_{4}(a q)+2 \mathrm{H}_{2} \mathrm{O}( l)\rightleftharpoons2 \mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}(a q)+\mathrm{H}_{2} \mathrm{C}_{2} \mathrm{O}_{4}(a q)\) |
| \(\text{CO}_3^{2-}\) | \(\mathrm{Cl}_{3} \mathrm{CCOOH}(a q)+2 \mathrm{OH}^{-}(a q)\rightleftharpoons\mathrm{CHCl}_{3}(a q)+\mathrm{CO}_{3}^{2-}(a q)+\mathrm{H}_{2} \mathrm{O}(l)\) |
| аналіт | осаджувач | будова | утворений преципірат | осад зважений |
|---|---|---|---|---|
| Ні 2 + | диметилгліоксим | 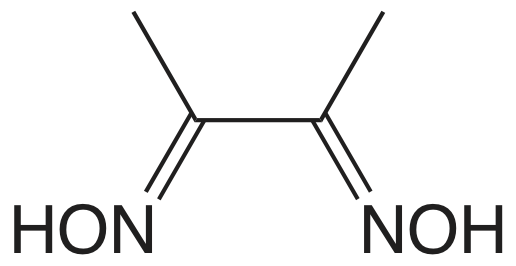 |
Ні (С 4 Н 7 О 2 Н 2) | Ні (С 4 Н 7 О 2 Н 2) |
| Фе 3 + | чашка | 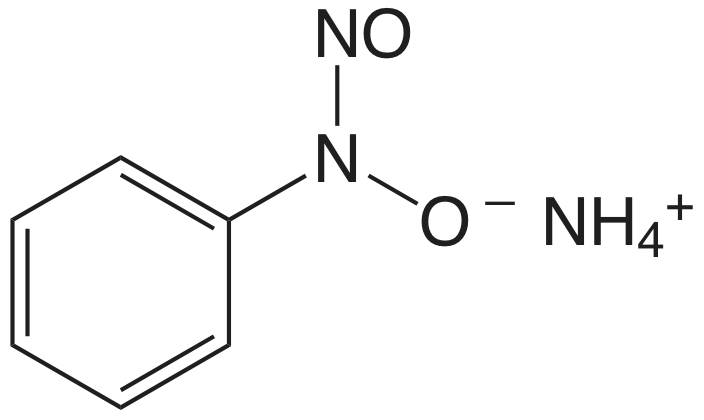 |
Фе (С 6 Н 5 Н 2 О 2) 3 | Фр 2 З 3 |
| Cu 2 + | купрон | 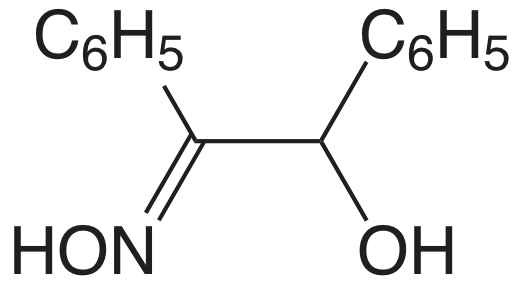 |
КуС 14 Н 11 О 2 Н | КуС 14 Н 11 О 2 Н |
| Со 2 + | 1-нітрозо-2-нафтол | 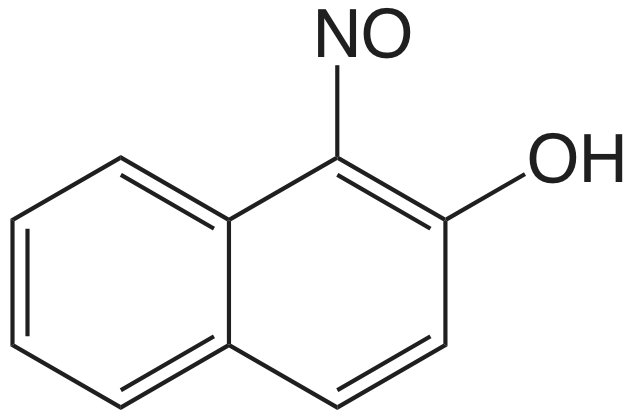 |
СО (С 10 Н 6 О 2 Н) 3 | Ко або СОСО 4 |
| К + | тетрафенілборат натрію | Na [Б (С 6 Н 5) 4] | К [Б (С 6 Ч 5) 4] | К [Б (С 6 Ч 5) 4] |
| \(\text{NO}_3^-\) | нітрон | 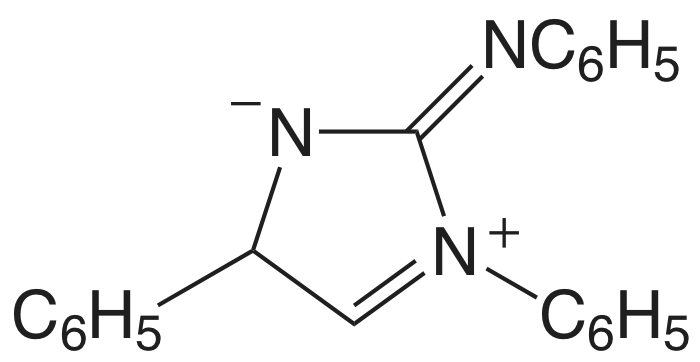 |
С 20 Ч 16 Н 4 ГНО 3 | С 20 Ч 16 Н 4 ГНО 3 |
Гравіметрія опадів продовжує перераховуватися як стандартний метод визначення\(\text{SO}_4^{2-}\) у воді та аналізі стічних вод [Метод 4500-SO42— C та метод 4500-SO42— D, опублікований у стандартних методах дослідження вод та стічних вод, 20-е видання, American Public Health Асоціація: Вош-інгтон, D.C., 1998]. Осадження проводять за допомогою BaCl 2 в кислому розчині (відрегульованому HCl до рН 4,5-5,0) для запобігання осадження BaCo 3 або Ba 3 (PO 4) 2, а також при температурі близько температури кипіння розчину. Осад перетравлюється при температурі 80-90 о С не менше двох годин. Беззольна фільтрувальна паперова целюлоза додається до осаду, щоб допомогти в його фільтрації. Після фільтрування осад підпалюють до постійної маси при 800 o С. В якості альтернативи осад фільтрують через дрібнопористий розтертий скляний тигель (без додавання фільтрувальної паперової маси) і сушать до постійної маси при 105 o С. помилки, включаючи оклюзії Ba (NO 3) 2, BaCl 2 та сульфатів лугу.
Інші стандартні методи визначення сульфату у воді та стічних водах включають іонну хроматографію (див. Розділ 12), капілярний іонний електрофорез (див. Главу 12), турбідиметрію (див. Главу 10) і аналіз потоку ін'єкцій (див. Розділ 13).
Органічний аналіз
Кілька органічних функціональних груп або гетероатомів можна визначити за допомогою гравіметричних методів осадження. Таблиця Template:index містить резюме кількох репрезентативних прикладів. Зауважимо, що визначення алкоксифункціональних груп є непрямим аналізом, при якому функціональна група реагує з і надлишком HI, а невідреагував I — визначається осадженням як AgCl.
| аналіт | лікування | осаджувач | осадити |
|---|---|---|---|
| органічні галогеніди (R- X), де X - Cl, Br або I | окислення HNO 3 в присутності Ag + | Гано 3 | Ag X |
| органічні галогеніди (R-X), де X - Cl, Br або I | згоряння в О 2 (з каталізатором Pt) в присутності Ag+ | Гано 3 | GAx |
| органічна сірка | окислення HNO 3 в присутності Ba 2+ | БакЛ 2 | Басо 4 |
| органічна сірка | горіння в О 2 (з каталізатором Pt) з SO 2 і SO 3, зібраними в розведених Н 2 О 2 | БакЛ 2 | Басо 4 |
| алкоксигрупи (—O-R або —COO- R), де R дорівнює —CH 3 або —C 2 H 5 | реакція з HI на отримання ІІ | Гано 3 | AGI |
Кількісні розрахунки
Стіхіометрія реакції опадів забезпечує математичну залежність між аналітом і осадом. Оскільки гравіметричний метод опадів може включати додаткові хімічні реакції, щоб привести аналіт в іншу хімічну форму, знання стехіометрії реакції опадів не завжди є достатнім. Навіть якщо у вас немає повного набору збалансованих хімічних реакцій, ви можете використовувати збереження маси, щоб вивести математичну залежність між аналітом і осадом. Наступний приклад демонструє такий підхід для безпосереднього аналізу одного аналіту.
Для визначення кількості магнетиту, Fe 3 O 4, в нечистої руді в концентрованому HCl розчиняють пробу 1,5419-г, в результаті чого утворюється суміш Fe 2 + і Fe 3 +. Після додавання HNO 3 для окислення Fe 2+ до Fe 3 + та розведення водою Fe 3 + осаджується у вигляді Fe (OH) 3 за допомогою NH 3. Фільтрування, промивання і запалювання осаду забезпечує 0,8525 г чистого Fe 2 O 3. Обчисліть %w/w Fe 3 O 4 у зразку.
Рішення
Збереження маси вимагає, щоб осад Fe 2 O 3 містив все залізо спочатку в зразку руди. Ми знаємо, що є 2 молі Fe на моль Fe 2 O 3 (FW = 159,69 г/моль) і 3 молі Fe на моль Fe 3 O 4 (FW = 231,54 г/моль); таким чином
\[0.8525 \ \mathrm{g} \ \mathrm{Fe}_{2} \mathrm{O}_{3} \times \frac{2 \ \mathrm{mol} \ \mathrm{Fe}}{159.69 \ \mathrm{g} \ \mathrm{Fe}_{2} \mathrm{O}_{3}} \times \frac{231.54 \ \mathrm{g} \ \mathrm{Fe}_{3} \mathrm{O}_{4}}{3 \ \mathrm{mol} \ \mathrm{Fe}}=0.82405 \ \mathrm{g} \ \mathrm{Fe}_{3} \mathrm{O}_{4} \nonumber\]
Таким чином,% w/w Fe 3 O 4 в зразку, отже, становить
\[\frac{0.82405 \ \mathrm{g} \ \mathrm{Fe}_{3} \mathrm{O}_{4}}{1.5419 \ \mathrm{g} \ \text { sample }} \times 100=53.44 \% \nonumber\]
0,7336-г проби сплаву, що містить мідь і цинк, розчиняють у 8 М HCl і розводять до 100 мл в об'ємній колбі. В одному аналізі цинк в 25,00-мл порції розчину осаджують у вигляді ZnNH 4 PO 4 і виділяють у вигляді Zn 2 P 2 O 7, що дає 0,163 м Мідь в окремій 25,00-мл порції розчину обробляють до осаду CuScN, що дає 0,2383 g. Обчислити %w/w Zn та %w/w Cu у зразку.
- Відповідь
-
Збереження маси вимагає, щоб весь цинк в сплаві знаходився в кінцевому продукті, Zn 2 P 2 O 7. Ми знаємо, що є 2 молі Zn на моль Zn 2 P 2 O 7; таким чином
\[0.1163 \ \mathrm{g} \ \mathrm{Zn}_{2} \mathrm{P}_{2} \mathrm{O}_{7} \times \frac{2 \ \mathrm{mol} \ \mathrm{Zn}}{304.70 \ \mathrm{g}\ \mathrm{Zn}_{2} \mathrm{P}_{2} \mathrm{O}_{7}} \times \frac{65.38 \ \mathrm{g} \ \mathrm{Zn}}{\mathrm{mol} \ \mathrm{Zn}}=0.04991 \ \mathrm{g} \ \mathrm{Zn}\nonumber\]
Це маса Zn в 25% зразка (25,00 мл частина загального обсягу 100,0 мл). Отже, %w/w Zn є
\[\frac{0.04991 \ \mathrm{g} \ \mathrm{Zn} \times 4}{0.7336 \ \mathrm{g} \text { sample }} \times 100=27.21 \% \ \mathrm{w} / \mathrm{w} \mathrm{Zn} \nonumber\]
Для міді ми знаходимо, що
\[\begin{array}{c}{0.2383 \ \mathrm{g} \ \mathrm{CuSCN} \times \frac{1 \ \mathrm{mol} \ \mathrm{Zn}}{121.63 \ \mathrm{g} \ \mathrm{CuSCN}} \times \frac{63.55 \ \mathrm{g} \ \mathrm{Cu}}{\mathrm{mol} \ \mathrm{Cu}}=0.1245 \ \mathrm{g} \ \mathrm{Cu}} \\ {\frac{0.1245 \ \mathrm{g} \ \mathrm{Cu} \times 4}{0.7336 \ \mathrm{g} \text { sample }} \times 100=67.88 \% \ \mathrm{w} / \mathrm{w} \mathrm{Cu}}\end{array} \nonumber\]
У практичній вправі Template:index вибірка містить два аналіти. Оскільки ми можемо осаджувати кожен аналіт вибірково, знаходження їх відповідних концентрацій є простим стехіометричним розрахунком. Але що робити, якщо ми не можемо окремо осаджувати два аналіти? Щоб знайти концентрації обох аналітів, нам все ще потрібно генерувати два осади, принаймні один з яких повинен містити обидва аналіти. Хоча це ускладнює розрахунки, ми все ж можемо використовувати збереження маси для вирішення проблеми.
Зразок 0.611 г сплаву, який містить Al і Mg, розчиняється і обробляється для запобігання перешкод іншими складовими сплаву. Алюміній і магній осаджують за допомогою 8-гідроксихіноліну, який дає змішаний осад Al (C 9 H 6 NO) 3 і Mg (C 9 H 6 NO) 2, що важить 7,815 м Запалювання осаду перетворює його в суміш Al 2 O 3 і MgO, що важить 1,002 г Обчисліть %w/w Al і% w/w Mg в сплаві.
Рішення
Маси твердих тіл забезпечують нам наступні два рівняння.
\[\mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3}+ \ \mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{2}=7.815 \ \mathrm{g} \nonumber\]
\[\mathrm{g} \ \mathrm{Al}_{2} \mathrm{O}_{3}+\mathrm{g} \ \mathrm{MgO}=1.002 \ \mathrm{g} \nonumber\]
З двома рівняннями і чотирма невідомими нам потрібні два додаткових рівняння для вирішення задачі. Збереження маси вимагає, щоб весь алюміній в Al (C 9 H 6 NO) 3 також знаходився в Al 2 O 3; таким чином
\[\mathrm{g} \ \mathrm{Al}_{2} \mathrm{O}_{3}=\mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3} \times \frac{1 \ \mathrm{mol} \ \mathrm{Al}}{459.43 \ \mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3}} \times \frac{101.96 \ \mathrm{g} \ \mathrm{Al}_{2} \mathrm{O}_{3}}{2 \ \mathrm{mol} \ \mathrm{Al}_{2} \mathrm{O}_{3}} \nonumber\]
\[\mathrm{g} \ \mathrm{Al}_{2} \mathrm{O}_{3}=0.11096 \times \mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3} \nonumber\]
Використовуючи той же підхід, консервація маси для магнію дає
\[\mathrm{g} \ \mathrm{MgO}=\mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{2} \times \frac{1 \ \mathrm{mol} \ \mathrm{Mg}}{312.61 \ \mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{2}} \times \frac{40.304 \ \mathrm{g} \ \mathrm{MgO}}{\mathrm{mol} \ \mathrm{MgO}} \nonumber\]
\[\mathrm{g} \ \mathrm{MgO}=0.12893 \times \mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{2} \nonumber\]
Підстановка рівнянь для g MgO і g Al 2 O 3 в рівняння для об'єднаних ваг MgO і Al 2 O 3 залишає нам два рівняння і два невідомих.
\[\mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3}+\mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{2}=7.815 \ \mathrm{g} \nonumber\]
\[0.11096 \times \mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3}+ 0.12893 \times \mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{2}=1.002 \ \mathrm{g} \nonumber\]
Множення першого рівняння на 0.11096 і віднімання другого рівняння дає
\[-0.01797 \times \mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{2}=-0.1348 \ \mathrm{g} \nonumber\]
\[\mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{2}=7.504 \ \mathrm{g} \nonumber\]
\[\mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3}=7.815 \ \mathrm{g}-7.504 \ \mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}, \mathrm{H}_{6} \mathrm{NO}\right)_{2}=0.311 \ \mathrm{g} \nonumber\]
Тепер ми можемо завершити проблему, використовуючи підхід з Приклад Template:index. Збереження маси вимагає, щоб весь алюміній і магній у вихідному зразку металу Dow знаходилися в осадах Al (C 9 H 6 NO) 3 і Mg (C 9 H 6 NO) 2. Для алюмінію ми знаходимо, що
\[0.311 \ \mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3} \times \frac{1 \ \mathrm{mol} \ \mathrm{Al}}{459.45 \ \mathrm{g} \ \mathrm{Al}\left(\mathrm{C}_{9} \mathrm{H}_{6} \mathrm{NO}\right)_{3}} \times \frac{26.982 \ \mathrm{g} \ \mathrm{Al}}{\mathrm{mol} \ \mathrm{Al}}=0.01826 \ \mathrm{g} \ \mathrm{Al} \nonumber\]
\[\frac{0.01826 \ \mathrm{g} \ \mathrm{Al}}{0.611 \ \mathrm{g} \text { sample }} \times 100=2.99 \% \mathrm{w} / \mathrm{w} \mathrm{Al} \nonumber\]
а для магнію ми маємо
\[7.504 \ \text{g Mg}\left(\mathrm{C}_9 \mathrm{H}_{6} \mathrm{NO}\right)_{2} \times \frac{1 \ \mathrm{mol} \ \mathrm{Mg}}{312.61 \ \mathrm{g} \ \mathrm{Mg}\left(\mathrm{C}_9 \mathrm{H}_{6} \mathrm{NO}\right)_{2}} \times \frac{24.305 \ \mathrm{g} \ \mathrm{Mg}}{\mathrm{mol} \ \mathrm{MgO}}=0.5834 \ \mathrm{g} \ \mathrm{Mg} \nonumber\]
\[\frac{0.5834 \ \mathrm{g} \ \mathrm{Mg}}{0.611 \ \mathrm{g} \text { sample }} \times 100=95.5 \% \mathrm{w} / \mathrm{w} \mathrm{Mg} \nonumber\]
Зразок силікатної породи, що важить 0,8143 г, вносять в розчин і обробляють з отриманням 0,2692 г суміші NaCl і KCl. Суміш хлористих солей розчиняють в суміші етанолу і води, і обробляють HClO 4, осаджуючи 0,3314 г KClO 4. Що таке %w/w Na 2 O в силікатній породі?
- Відповідь
-
Маси твердих тіл забезпечують нам наступні рівняння:
\[\mathrm{g} \ \mathrm{NaCl}+\mathrm{g} \ \mathrm{KCl}=0.2692 \ \mathrm{g} \nonumber\]
\[\mathrm{g} \ \mathrm{KClO}_{4} = 0.3314 \ \mathrm{g} \nonumber\]
З двома рівняннями є три невідомі - g NaCl, g KCl та g KClO 4 —нам потрібно одне додаткове рівняння для вирішення задачі. Збереження маси вимагає, щоб весь калій спочатку в KCl потрапляв у KClO 4; таким чином
\[\text{g KClO}_4 = \text{g KCl} \times \frac{1 \text{ mol Cl}}{74.55 \text{ g KCl}} \times \frac {138.55 \text{ g KClO}_4}{\text{mol Cl}} = 1.8585 \times \text{ g KCl} \nonumber\]
З огляду на масу KClO 4, ми використовуємо третє рівняння для розв'язання маси KCl в суміші хлористих солей
\[\text{ g KCl} = \frac{\text{g KClO}_4}{1.8585} = \frac{0.3314 \text{ g}}{1.8585} = 0.1783 \text{ g KCl} \nonumber\]
Маса NaCl в суміші хлористих солей, отже, становить
\[\text{ g NaCl} = 0.2692 \text{ g} - \text{g KCl} = 0.2692 \text{ g} - 0.1783 \text{ g KCl} = 0.0909 \text{ g NaCl} \nonumber\]
Нарешті, щоб повідомити про %w/w Na 2 O в зразку, ми використовуємо збереження маси на натрій для визначення маси Na 2 O
\[0.0909 \text{ g NaCl} \times \frac{1 \text{ mol Na}}{58.44 \text{ g NaCl}} \times \frac{61.98 \text{ g Na}_2\text{O}}{2 \text{ mol Na}} = 0.0482 \text{ g Na}_2\text{O} \nonumber\]
даючи %w/w Na 2 O як
\[\frac{0.0482 \text{ g Na}_2\text{O}}{0.8143 \text{ g sample}} \times 100 = 5.92\% \text{ w/w Na}_2\text{O} \nonumber\]
Попередні проблеми є прикладами прямих методів аналізу, оскільки осад містить аналіт. При непрямому аналізі осад утворюється в результаті реакції з аналітом, але аналіт не входить до складу осаду. Як показує наступний приклад, незважаючи на додаткову складність, ми все ж можемо використовувати принципи збереження для організації наших розрахунків.
Нечистий зразок Na 3 PO 3, який важить 0,1392 г, розчиняють у 25 мл води. Готують другий розчин, який містить 50 мл 3% в/в HgCl 2, 20 мл 10% в/в ацетату натрію і 5 мл льодовикової оцтової кислоти. Додавання розчину, який містить зразок, до другого розчину окислюється\(\text{PO}_3^{3-}\)\(\text{PO}_4^{3-}\) і осаджує Hg 2 Cl 2. Після перетравлення, проціджування і промивання осаду отримують 0,4320 г Hg 2 Cl 2. Повідомте про чистоту вихідного зразка як% w/w Na 3 PO 3.
Рішення
Це приклад непрямого аналізу, оскільки осад, Hg 2 Cl 2, не містить аналіту Na 3 PO 3. Хоча стехіометрія реакції між Na 3 PO 3 і HgCl 2 наведена раніше в розділі, давайте подивимося, як ми можемо вирішити проблему, використовуючи принципи збереження. (Хоча ви можете написати збалансовані реакції для будь-якого аналізу, застосування принципів збереження може заощадити значну кількість часу! )
Реакція між Na 3 PO 3 і HgCl 2 являє собою окислювально-відновну реакцію, в якій фосфор підвищує свій ступінь окислення з +3 в Na 3 PO 3 до +5 в Na 3 PO 4, і в якій ртуть зменшує свою Ступінь окислення від +2 в HgCl 2 до +1 в Hg 2 Cl 2. Окислювально-відновна реакція повинна підкорятися збереженню електронів, оскільки всі електрони, що виділяються відновником, Na 3 PO 3, повинні бути прийняті окислювачем, HgCl 2. Знаючи це, запишемо наступні стехіометричні коефіцієнти перетворення:
\[\frac{2 \ \mathrm{mol} \ e^{-}}{\mathrm{mol} \ \mathrm{Na}_{3} \mathrm{PO}_{3}} \text { and } \frac{1 \mathrm{mol} \ e^{-}}{\mathrm{mol} \ \mathrm{HgCl}_{2}} \nonumber\]
Тепер ми готові вирішити проблему. Спочатку використовуємо консервацію маси для ртуті для перетворення маси осаду в молі HgCl 2.
\[0.4320 \ \mathrm{g} \ \mathrm{Hg}_{2} \mathrm{Cl}_{2} \times \frac{2 \ \mathrm{mol} \ \mathrm{Hg}}{472.09 \ \mathrm{g} \ \mathrm{Hg}_{2} \mathrm{Cl}_{2}} \times \frac{1 \ \mathrm{mol} \ \mathrm{HgCl}_{2}}{\mathrm{mol} \ \mathrm{Hg}}=1.8302 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HgCl}_{2} \nonumber\]
Далі використовуємо збереження електронів, щоб знайти масу Na 3 PO 3.
\[1.8302 \times 10^{-3} \ \mathrm{mol} \ \mathrm{HgCl}_{2} \times \frac{1 \ \mathrm{mol} \ e^{-}}{\mathrm{mol} \ \mathrm{HgCl}_{2}} \times \frac{1 \ \mathrm{mol} \ \mathrm{Na}_{3} \mathrm{PO}_{4}}{2 \ \mathrm{mol} \ e^{-}} \times \frac{147.94 \ \mathrm{g} \ \mathrm{Na}_{3} \mathrm{PO}_{3}}{\mathrm{mol} \ \mathrm{Na}_{3} \mathrm{PO}_{3}}=0.13538 \ \mathrm{g} \ \mathrm{Na}_{3} \mathrm{PO}_{3} \nonumber\]
Нарешті, ми обчислюємо %w/w Na 3 PO 3 у вибірці.
\[\frac{0.13538 \ \mathrm{g} \ \mathrm{Na}_{3} \mathrm{PO}_{3}}{0.1392 \ \mathrm{g} \text { sample }} \times 100=97.26 \% \mathrm{w} / \mathrm{w} \mathrm{Na}_{3} \mathrm{PO}_{3} \nonumber\]
У міру того, як вам стане комфортно користуватися принципами збереження, ви побачите способи подальшого спрощення проблем. Наприклад, збереження електронів вимагає, щоб електрони, що виділяються Na 3 PO 3, опинилися в добутку, Hg 2 Cl 2, отримуючи наступний стехіометричний коефіцієнт перетворення:
\[\frac{2 \ \operatorname{mol} \ \mathrm{Na}_{3} \mathrm{PO}_{3}}{\mathrm{mol} \ \mathrm{Hg}_{2} \mathrm{Cl}_{2}} \nonumber\]
Цей коефіцієнт перетворення забезпечує прямий зв'язок між масою Hg 2 Cl 2 і масою Na 3 PO 3.
Один з підходів для визначення фосфату\(\text{PO}_4^{3-}\), полягає в осадженні його як фосфомолібдат амонію, (NH 4) 3 PO 4 •12MoO 3. Після того, як ми виділяємо осад фільтрацією, розчиняємо його в кислоті і осаджуємо і зважуємо молібдат як PbMoO 3. Припустимо, ми знаємо, що наш зразок становить не менше 12,5% Na 3 PO 4 і що нам потрібно відновити мінімум 0,600 г PbMoO 3? Яка мінімальна кількість вибірки, яка нам потрібна для кожного аналізу?
- Відповідь
-
Щоб знайти масу (NH 4) 3 PO 4 •12MoO 3, яка дасть 0,600 г PbMoO 3, ми спочатку використовуємо збереження маси для молібдену; таким чином
\[0.600 \ \mathrm{g} \ \mathrm{PbMoO}_{3} \times \frac{1 \ \mathrm{mol} \ \mathrm{Mo}}{351.2 \ \mathrm{g} \ \mathrm{PbMoO}_{3}} \times \frac{1876.59 \ \mathrm{g} \ \left(\mathrm{NH}_{4}\right)_{3} \mathrm{PO}_{4} \cdot 12 \mathrm{MoO}_{3}}{12 \ \mathrm{mol} \ \mathrm{Mo}}= 0.2672 \ \mathrm{g} \ \left(\mathrm{NH}_{4}\right)_{3} \mathrm{PO}_{4} \cdot 12 \mathrm{MoO}_{3} \nonumber\]
Далі, щоб перетворити цю масу (NH 4) 3 PO 4 •12MoO 3 в масу Na 3 PO 4, використовуємо консервацію маси на\(\text{PO}_4^{3-}\).
\[0.2672 \ \mathrm{g} \ \left(\mathrm{NH}_{4}\right)_{3} \mathrm{PO}_{4} \cdot 12 \mathrm{MoO}_{3} \times \frac{1 \ \mathrm{mol} \ \mathrm{PO}_{4}^{3-}}{1876.59 \ \mathrm{g \ }\left(\mathrm{NH}_{4}\right)_{3} \mathrm{PO}_{4} \cdot 12 \mathrm{MoO}_{3}} \times \frac{163.94 \ \mathrm{g} \ \mathrm{Na}_{3} \mathrm{PO}_{4}}{\mathrm{mol} \ \mathrm{PO}_{4}^{3-}}=0.02334 \ \mathrm{g} \ \mathrm{Na}_{3} \mathrm{PO}_{4} \nonumber\]
Нарешті, ми перетворюємо цю масу Na 3 PO 4 у відповідну масу зразка.
\[0.02334 \ \mathrm{g} \ \mathrm{Na}_{3} \mathrm{PO}_{4} \times \frac{100 \ \mathrm{g} \text { sample }}{12.5 \ \mathrm{g} \ \mathrm{Na}_{3} \mathrm{PO}_{4}}=0.187 \ \mathrm{g} \text { sample } \nonumber\]
Зразок 0,187 г достатньо, щоб гарантувати, що ми відновимо мінімум 0,600 г PbMoO 3. Якщо зразок містить більше 12,5% Na 3 PO 4, то 0,187 г зразка дасть більше 0,600 г PbMoO 3.
Якісні програми
Реакція опадів є корисним методом для ідентифікації неорганічних і органічних аналітів. Оскільки якісний аналіз не вимагає кількісних вимірювань, аналітичний сигнал - це просто спостереження за тим, що утворюється осад. Хоча якісні застосування гравіметрії опадів були замінені спектроскопічними методами аналізу, вони продовжують знаходити застосування в точковому тестуванні на наявність специфічних аналітів [Jungreis, E. Spot Test Analysis; 2-е видання, Wiley: New York, 1997].
Для якісного аналізу можна використовувати будь-який з опадів, перелічених у таблиці Template:index, таблиці {{Template.index (ID:3)}} та таблиці Template:index.
Оцінка гравіметрії опадів
Масштаб операції
Масштаб операції з осадження гравіметрії обмежується чутливістю балансу і наявністю проби. Для досягнення точності ± 0,1% за допомогою аналітичних ваг з чутливістю ± 0,1 мг ми повинні виділити не менше 100 мг осаду. Як наслідок, гравіметрія опадів зазвичай обмежується основними або незначними аналітами в макро- або мезозразках. Аналіз аналіту слідового рівня або мікропроби вимагає мікроаналітичного балансу.
Точність
Для макрозразка, який містить основний аналіт, відносна похибка 0,1— 0,2% досягається регулярно. Основними обмеженнями є втрати розчинності, домішки в осад і втрата осаду при обробці. Коли важко отримати осад, вільний від домішок, часто можна визначити емпіричну залежність між масою осаду і масою аналіта шляхом відповідної калібрування.
Точність
Відносна точність гравіметрії опадів залежить від розміру зразка та маси осаду. Для меншої кількості зразка або осаду регулярно отримують відносну точність 1—2 ppt. При роботі з більшою кількістю зразка або осаду відносна точність поширюється до декількох проміле. Мало кількісних прийомів можна досягти такого рівня точності.
Чутливість
Для будь-якого гравіметричного методу опадів ми можемо записати наступне загальне рівняння, щоб зв'язати сигнал (грами осаду) з абсолютною кількістю аналіту в зразку
\[\text { g precipitate }=k \times \mathrm{g} \text { analyte } \label{8.13}\]
де k, чутливість методу, визначається стехіометрією між осадом і аналітом.
Рівняння\ ref {8.13} передбачає, що ми використовували відповідну заготовку для корекції сигналу для будь-якого внеску реагенту в масу осаду.
Розглянемо, наприклад, визначення Fe як Fe 2 O 3. Використовуючи консервацію маси для заліза, маса осаду
\[\mathrm{g} \ \mathrm{Fe}_{2} \mathrm{O}_{3}=\mathrm{g} \ \mathrm{Fe} \times \frac{1 \ \mathrm{mol} \ \mathrm{Fe}}{\text{AW Fe}} \times \frac{\text{FW Fe}_{2} \mathrm{O}_{3}}{2 \ \mathrm{mol} \ \mathrm{Fe}} \nonumber\]
і значення k дорівнює
Як ми бачимо з Equation\ ref {8.14}, є два способи покращити чутливість методу. Найбільш очевидним способом підвищення чутливості є збільшення відношення молярної маси осаду до співвідношення аналіту. Іншими словами, він допомагає утворювати осад з максимально можливою вагою формули. Менш очевидний спосіб покращення чутливості методу вказує термін 1/2 в Equation\ ref {8.14}, який становить стехіометрію між аналітом і осадом. Ми також можемо покращити чутливість, утворюючи осад, який містить менше одиниць аналіту.
Припустимо, ви бажаєте визначити кількість заліза в пробі. Яка з наступних сполук - FeO, Fe 2 O 3 або Fe 3 O 4 - забезпечує найбільшу чутливість?
- Відповідь
-
Щоб визначити, яка форма має найбільшу чутливість, використовуємо консервацію маси для заліза, щоб знайти взаємозв'язок між масою осаду і масою заліза.
\[\begin{aligned} \mathrm{g} \ \mathrm{FeO} &=\mathrm{g} \ \mathrm{Fe} \times \frac{1 \ \mathrm{mol} \ \mathrm{Fe}}{55.85 \ \mathrm{g} \ \mathrm{Fe}} \times \frac{71.84 \ \mathrm{g} \ \mathrm{FeO}}{\mathrm{mol} \ \mathrm{Fe}}=1.286 \times \mathrm{g} \ \mathrm{Fe} \\ \mathrm{g} \ \mathrm{Fe}_{2} \mathrm{O}_{3} &=\mathrm{g} \ \mathrm{Fe} \times \frac{1 \ \mathrm{mol} \ \mathrm{Fe}}{55.85 \ \mathrm{g} \ \mathrm{Fe}} \times \frac{159.69 \ \mathrm{g} \ \mathrm{Fe}_{2} \mathrm{O}_{3}}{2 \ \mathrm{mol} \ \mathrm{Fe}}=1.430 \times \mathrm{g} \ \mathrm{Fe} \\ \mathrm{g} \ \mathrm{Fe}_{3} \mathrm{O}_{4} &=\mathrm{g} \ \mathrm{Fe} \times \frac{1 \ \mathrm{mol} \ \mathrm{Fe}}{55.85 \ \mathrm{g} \ \mathrm{Fe}} \times \frac{231.53 \ \mathrm{g} \ \mathrm{Fe}_{3} \mathrm{O}_{4}}{3 \ \mathrm{mol} \ \mathrm{Fe}}=1.382 \times \mathrm{g} \ \mathrm{Fe} \end{aligned} \nonumber\]
З трьох варіантів найбільша чутливість виходить при Fe 2 O 3, оскільки вона забезпечує найбільше значення для k.
Вибірковість
Через хімічну природу процесу осадження, як правило, не є селективними для одного аналіту. Наприклад, срібло не є селективним осадником для хлориду, оскільки воно також утворює опади з бромідом та йодидом. Перешкоди часто є серйозною проблемою, і їх слід враховувати, якщо потрібно отримати точні результати.
Час, вартість та обладнання
Гравіметрія опадів є трудомісткою і рідко практичною, якщо у вас є велика кількість зразків для аналізу; однак, оскільки значна частина часу, вкладеного в гравіметрію опадів, не вимагає негайного нагляду аналітика, це практична альтернатива при роботі лише з декількома зразками. Потреби в обладнанні нечисленні - мензурки, фільтруючі пристрої, духовки або пальники та баланси - недорогі, зазвичай доступні в більшості лабораторій і прості в обслуговуванні.
