26.2: Бактеріальні захворювання нервової системи
- Page ID
- 4035
Цілі навчання
- Визначте найпоширеніші бактерії, які можуть викликати інфекції нервової системи
- Порівняйте основні характеристики конкретних бактеріальних захворювань, що вражають нервову систему
Бактеріальні інфекції, що вражають нервову систему, серйозні і можуть бути небезпечними для життя. На щастя, існує лише кілька видів бактерій, які зазвичай асоціюються з неврологічними інфекціями.
бактеріальний менінгіт
Бактеріальний менінгіт - одна з найсерйозніших форм менінгіту. Бактерії, що викликають менінгіт, часто отримують доступ до ЦНС через кровотік після травми або в результаті дії бактеріальних токсинів. Бактерії також можуть поширюватися з структур у верхніх дихальних шляхах, таких як ротоглотка, носоглотка, пазухи та середнє вухо. Пацієнти з ранами голови або кохлеарними імплантатами (електронний пристрій, поміщений у внутрішнє вухо) також схильні до ризику розвитку менінгіту.
Багато бактерій, які можуть викликати менінгіт, зазвичай зустрічаються у здорових людей. Найпоширенішими причинами неонатального бактеріального менінгіту є Neisseria meningitidis, Streptococcus pneumoniae та Haemophilus influenzae. Всі три з цих бактеріальних збудників поширюються від людини до людини дихальними виділеннями. Кожен може колонізуватися і перетинатися через слизові оболонки ротоглотки і носоглотки, і потрапляти в кров. Потрапивши в кров, ці збудники можуть поширюватися по всьому організму і здатні як встановити інфекцію, так і спровокувати запалення в будь-якій ділянці тіла, включаючи мозкові оболонки (рис.\(\PageIndex{1}\)). Без відповідної системної антибактеріальної терапії рівень летальності може досягати 70%, а 20% тих, хто вижив, можуть залишитися з незворотним пошкодженням нервів або руйнуванням тканин, що призводить до втрати слуху, неврологічної інвалідності або втрати кінцівки. Показники смертності значно нижчі (лише 15%) серед населення, де доступні відповідні лікувальні препарати та профілактичні вакцини. 1
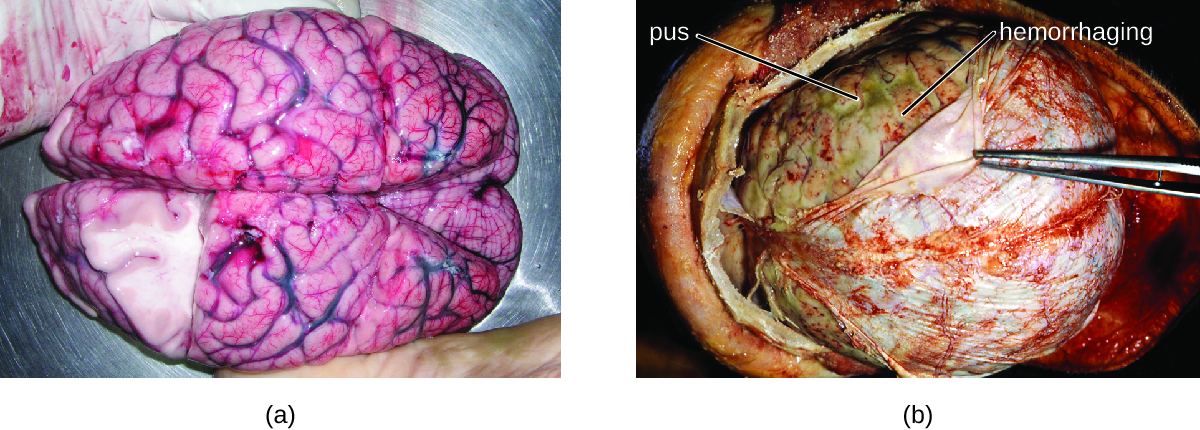
Різноманітні інші бактерії, в тому числі Listeria monocytogenes і кишкова паличка, також здатні викликати менінгіт. Ці бактерії викликають інфекції павутинної матерії та ліквору після поширення через циркуляцію в крові або шляхом поширення від інфекції пазух або носоглотки. Streptococcus agalactiae, зазвичай зустрічається в мікробіоті піхви та шлунково-кишкового тракту, також може викликати бактеріальний менінгіт у новонароджених після передачі від матері або до народження, або під час народження.
Глибоке запалення, викликане цими мікробами, може призвести до ранніх симптомів, які включають сильний головний біль, лихоманку, сплутаність свідомості, нудоту, блювоту, світлобоязнь та жорсткість шиї. Системні запальні реакції, пов'язані з деякими типами бактеріального менінгіту, можуть призвести до крововиливів та пурпурових уражень на шкірі, за якими слідують ще більш важкі стани, які включають шок, судоми, кому та смерть - в деяких випадках протягом декількох годин.
Діагноз бактеріального менінгіту найкраще підтверджується аналізом ліквору, отриманого за допомогою люмбальної пункції. Аномальні рівні поліморфноядерних нейтрофілів (ПМН) (> 10 ПМНС/мм 3), глюкози (< 45 mg/dL), and protein (> 45 мг/дл) в лікворі свідчать про бактеріальний менінгіт. 2 Характеристика специфічних форм бактеріального менінгіту детально описана в наступних підрозділах.
Менінгококовий менінгіт
Менінгококовий менінгіт - серйозна інфекція, викликана грамнегативним коком N. meningitidis. У деяких випадках смерть може наступити протягом декількох годин від появи симптомів. Нефатальні випадки можуть призвести до незворотного пошкодження нервів, що призводить до зниження слуху та пошкодження мозку, або ампутації кінцівок через некроз тканин.
Менінгококовий менінгіт може заразити людей будь-якого віку, але його поширеність найвища серед немовлят, підлітків, молодих людей. 3 Менінгококовий менінгіт колись був найпоширенішою причиною епідемій менінгіту у людських популяцій. Це все ще трапляється в районі Африки на південь від Сахари, відомої як пояс менінгіту, але епідемії менінгококового менінгіту стали рідкісними в більшості інших регіонів завдяки менінгококовим вакцинам. Однак спалахи все ще можуть відбуватися в громадах, школах, коледжах, в'язницях та інших групах населення, де люди знаходяться в тісному безпосередньому контакті.
N. meningitidis має високу спорідненість до слизових оболонок ротоглотки і носоглотки. Контакт з дихальними виділеннями, що містять N. meningitidis, є ефективним способом передачі. Патогенність N. meningitidis посилюється факторами вірулентності, які сприяють швидкому прогресуванню захворювання. До них відносяться ліпоолігосахарид (LOS) ендотоксин, тип IV пілі для прикріплення до тканин господаря та полісахаридні капсули, які допомагають клітинам уникнути фагоцитозу та опосередкованого комплементу вбивства. Додаткові фактори вірулентності включають IgA протеазу (яка розщеплює антитіла IgA), фактори інвазії Opa, Opc та porin (які сприяють трансклітинному проникненню через гематоенцефалічний бар'єр), фактори поглинання заліза (які позбавляють гемових одиниць від гемоглобіну в клітинах-господарях і використовують їх для росту) та стрес білки, що захищають бактерії від активних молекул кисню.
Унікальною ознакою менінгококового менінгіту є утворення петехіальної висипки на шкірі або слизових оболонках, що характеризується крихітними, червоними, плоскими, геморагічними ураженнями. Ця висип, що з'являється незабаром після початку захворювання, є відповіддю на ЛОС-ендотоксин і фактори вірулентності прилипання, які порушують роботу ендотеліальних клітин капілярів і дрібних вен в шкірі. Порушення кровоносних судин запускає утворення крихітних тромбів, внаслідок чого кров просочується в навколишні тканини. У міру прогресування інфекції рівні факторів вірулентності збільшуються, а геморагічні ураження можуть збільшуватися в розмірах, оскільки кров продовжує просочуватися в тканини. Поразки розміром понад 1,0 см зазвичай виникають у пацієнтів, які розвивають шок, оскільки фактори вірулентності викликають посилення крововиливу і утворення згустків. Сепсис, в результаті системного ураження від менінгококових факторів вірулентності, може призвести до швидкої поліорганної недостатності, шоку, дисемінованого внутрішньосудинного згортання крові, смерті.
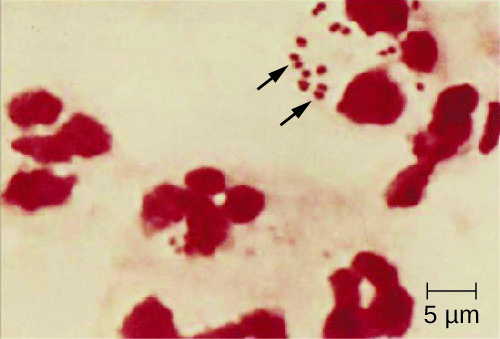
Оскільки менінгококовий менінгіт прогресує так швидко, для своєчасного виявлення N. meningitidis потрібна більша різноманітність клінічних зразків. Необхідні зразки можуть включати кров, ліквору, мазки з носоглотки та ротоглотки, мазки з уретри та ендоцервікального каналу, петехіальні аспірати та біопсії. Протоколи безпеки при поводженні та транспортуванні зразків, підозрюваних у містять N. meningitidis, слід завжди дотримуватися, оскільки випадки смертельної менінгококової хвороби траплялися у медичних працівників, які зазнали впливу крапель або аерозолів із зразків пацієнтів. Оперативна передбачувана діагностика менінгококового менінгіту може виникнути при безпосередній оцінці ліквору по Граму, виявляючи екстра-і внутрішньоклітинні грамнегативні диплококи з характерною мікроскопічною морфологією кавових зерен, пов'язаної з ПМН (рис.\(\PageIndex{2}\)). Ідентифікація також може бути проведена безпосередньо з ліквору за допомогою латексної аглютинації та імунохроматографічних експрес-діагностичних тестів, специфічних для N. meningitidis. Ідентифікація видів також може бути виконана за допомогою схем типування на основі послідовності ДНК для гіперзмінних білків зовнішньої мембрани N. meningitidis, який замінив серо (sub) типування.
Менінгококові інфекції можна лікувати за допомогою антибіотикотерапії, найчастіше застосовуються цефалоспорини третього покоління. Однак, оскільки результати можуть бути негативними навіть при лікуванні, профілактична вакцинація - найкраща форма лікування. У 2010 році країни поясу менінгіту Африки почали використовувати нову кон'югатну вакцину проти менінгококової серогрупи А. Ця програма різко скоротила кількість випадків менінгококового менінгіту шляхом надання індивідуального і стадного імунітету.
Відомо, що існує дванадцять різних капсулярних серотипів N. meningitidis. Серотипи A, B, C, W, X і Y є найбільш поширеними в усьому світі. CDC рекомендує вакцинувати дітей віком від 11 до 12 років одноразовою дозою чотиривалентної вакцини, яка захищає від серотипів A, C, W та Y, з бустером у віці 16 років. 4 Додатковий підсилювач або ін'єкції менінгококової вакцини серогрупи В можуть бути надані особам, які перебувають у умовах високого ризику (наприклад, епідемічні спалахи в кампусах коледжів).
Менінгіт в кампусі
Студенти коледжу, які проживають в гуртожитках або комунальному житловому приміщенні, мають підвищений ризик зараження епідемічним менінгітом. З 2011 по 2015 рік у кампусах коледжів у США було щонайменше дев'ять спалахів менінгококів. У цих інцидентах брали участь загалом 43 студенти (з них четверо померли). 5 Незважаючи на швидку діагностику та агресивне протимікробне лікування, деякі з тих, хто вижив страждали від ампутацій або серйозних неврологічних проблем.
Профілактична вакцинація студентів першого курсу коледжу, які проживають у гуртожитках, рекомендована CDC, а страхові компанії тепер покривають вакцинацію менінгококом для студентів гуртожитків коледжів. Деякі коледжі призначили вакцинацію менінгококової кон'югатною вакциною для певних студентів, що вступають до коледжу (рис.\(\PageIndex{3}\)).
Пневмококовий менінгіт
Пневмококовий менінгіт викликається інкапсульованою грампозитивною бактерією S. pneumoniae (pneumococcus, також званий стреп-пневмо). Цей організм зазвичай зустрічається в мікробіоті глотки 30-70% маленьких дітей, в залежності від методу забору проб, в той час як S. pneumoniae можна зустріти менш ніж у 5% здорових дорослих. Хоча він часто присутній без симптомів захворювання, цей мікроб може перетнути гематоенцефалічний бар'єр у сприйнятливих людей. У деяких випадках це також може призвести до септицемії. З моменту введення вакцини Hib S. pneumoniae стала провідною причиною менінгіту у людей у віці від 2 місяців до дорослого віку.
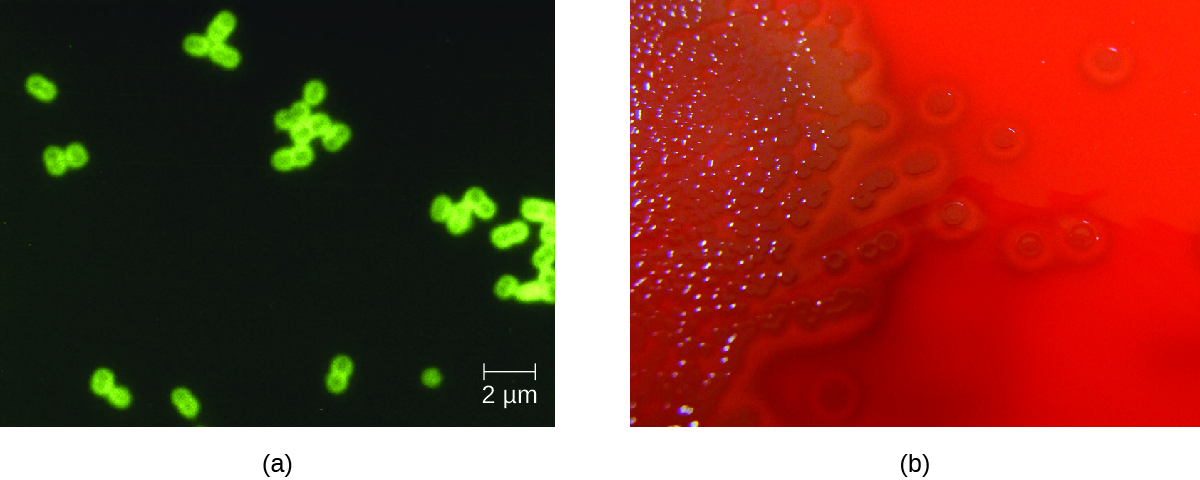
S. pneumoniae можна ідентифікувати в зразках ліквору за допомогою зразків, забарвлених грамами, латексної аглютинації та імунохроматографічного РДТ, специфічного для S. pneumoniae. У грамоподібних зразках S. pneumoniae фігурує у вигляді грампозитивних, ланцетноподібних диплококів (рис.\(\PageIndex{4}\)). Ідентифікація S. pneumoniae також може бути досягнута за допомогою культур спинномозкової ліквору та крові, причому на основі реакції квеллунга на унікальні капсульні полісахариди можна ідентифікувати щонайменше 93 різних серотипу. ПЛР і ЗТ-ПЛР аналізи також доступні для підтвердження ідентифікації.
Основні фактори вірулентності, що виробляються S. pneumoniae, включають PI-1 пілін для адгезії до клітин-господаря (пневмококова адгезія) та фактор вірулентності В (paVB) для прикріплення до клітин дихальних шляхів; холінзв'язуючі білки (cbPa), які зв'язуються з епітеліальними клітинами і перешкоджають імунним факторам IgA і С3; і цитоплазматичний бактеріальний токсин пневмолізин, який викликає запальну реакцію.
При появі стійких до ліків штамів S. pneumoniae пневмококовий менінгіт зазвичай лікують антибіотиками широкого спектру дії, такими як левофлоксацин, цефотаксим, пеніцилін або інші β-лактамні антибіотики. Дві доступні пневмококові вакцини описані в Бактеріальні інфекції дихальних шляхів.
Гемофільний грип типу B
Менінгіт, обумовлений серотипом H. influenzae b (Hib), інкапсульованим плеоморфним грамнегативним коккобацил, зараз є рідкістю в більшості країн через використання ефективної вакцини Hib. Без застосування вакцини Hib H. influenzae може бути основною причиною менінгіту у дітей віком від 2 місяців до 5 років. H. influenzae можна виявити в горлі здорових осіб, включаючи немовлят і маленьких дітей. До п'ятирічного віку у більшості дітей виробився імунітет до цього мікробу. Немовлята старше 2 місяців, однак, не виробляють достатньої захисної відповіді антитіл і сприйнятливі до серйозних захворювань. Внутрішньочерепний тиск, викликаний цією інфекцією, призводить до 5% смертності та 20% частоти глухоти або пошкодження мозку у тих, хто вижив. 6
H. influenzae виробляє щонайменше 16 різних факторів вірулентності, включаючи LOS, що викликає запалення, і Haemophilus адгезії і фактор проникнення (Hap), який сприяє приєднанню та інвазії в дихальні епітеліальні клітини. Бактерія також має полісахаридну капсулу, яка допомагає їй уникнути фагоцитозу, а також такі фактори, як протеаза IgA1 та білок P2, які дозволяють їй ухилятися від антитіл, що виділяються зі слизових оболонок. Крім того, такі фактори, як гемоглобінзв'язуючий білок (Hgp) і трансферин-зв'язуючий білок (Tbp), набувають залізо з гемоглобіну і трансферину відповідно для росту бактерій.
Попередній діагноз інфекцій H. influenzae може бути поставлений шляхом прямої ПЛР і мазка ліквору. Пофарбовані мазки виявлять внутрішньоклітинні і позаклітинні ПМН з дрібними, плеоморфними, грамнегативними коккобацилами або ниткоподібними формами, характерними для H. influenzae. Початкове підтвердження цього роду може бути засноване на його вибагливому зростанні на шоколадному агарі. Ідентифікація підтверджена вимогами до екзогенних біохімічних кофакторів росту NAD та гему (методом MALDI-TOF), латексної аглютинації та ЗТ-ПЛР.
Менінгіт, викликаний H. influenzae, зазвичай лікують доксицикліном, фторхінолонами, цефалоспоринами другого і третього покоління та карбапенемами. Кращий засіб профілактики зараження грипом H. з використанням кон'югатної вакцини Hib полісахариду. Рекомендується всім дітям отримувати цю вакцину у віці 2, 4 та 6 місяців, з остаточною дозою підсилювача у віці від 12 до 15 місяців. 7
Неонатальний менінгіт
S. agalactiae, стрептокок групи В (СГБ) - це інкапсульована грампозитивна бактерія, яка є найпоширенішою причиною менінгіту новонароджених, термін, який позначає менінгіт, що виникає у немовлят віком до 3 місяців. 8 S. agalactiae також може викликати менінгіт у людей різного віку і може бути виявлений в урогенітальній та шлунково-кишковій мікробіоті близько 10— 30% людей.
Неонатальна інфекція виникає як раннє або пізнє захворювання. Ранній початок захворювання визначається як зустрічається у немовлят віком до 7 днів. Немовля спочатку заражається S. agalactiae під час пологів, коли бактерії можуть переноситися з піхви матері. Частота раннього початку неонатального менінгіту може бути значно знижена, даючи внутрішньовенні антибіотики матері під час пологів.
Неонатальний менінгіт з пізнім початком виникає у немовлят віком від 1 тижня до 3 місяців. Немовлята, народжені матерями з S. agalactiae в урогенітальному тракті, мають більш високий ризик виникнення менігіту з пізнім початком, але інфекції з пізнім початком можуть передаватися з джерел, відмінних від матері; часто джерело інфекції невідоме. Немовлята, які народилися передчасно (до 37 тижнів вагітності) або матері, які розвивають лихоманку, також мають більший ризик захворіти на пізній неонатальний менінгіт.
Ознаки та симптоми раннього початку захворювання включають нестабільність температури, апное (припинення дихання), брадикардію (уповільнене серцебиття), гіпотонію, утруднення годування, дратівливість і кульгавість. Під час сну малюкові може бути важко прокинутися. Симптоми пізнього захворювання частіше включають судоми, випирає джерельце (м'яка пляма), ригідність шиї, геміпарез (слабкість на одній стороні тіла) і опістотонос (жорстке тіло з вигнутою спиною і головою, закинутою назад).
S. agalactiae виробляє щонайменше 12 факторів вірулентності, які включають FbSA, що прикріплюється до білків поверхні клітин господаря, PI-1 pilithat сприяє вторгненню ендотеліальних клітин людини, полісахаридної капсули, яка запобігає активації альтернативного шляху комплементу і пригнічує фагоцитоз, і токсин-фактор CAMP, який утворює пори в мембранах клітин господаря і зв'язується з антитілами IgG та IgM.
Діагностика менінгіту новонароджених часто, але не рівномірно, підтверджується позитивними результатами посівів ліквору або крові. Тести включають рутинну культуру, виявлення антигенів за допомогою імуноферментного аналізу, серотипування різних типів капсул, ПЛР та ЗТ-ПЛР. Зазвичай його лікують β-лактамними антибіотиками, такими як внутрішньовенний пеніцилін або ампіцилін плюс гентаміцин. Навіть при лікуванні приблизно 10% смертності спостерігається у інфікованих новонароджених. 9
Вправа\(\PageIndex{1}\)
- Які групи найбільш вразливі до кожного з бактеріальних захворювань менінгіту?
- Для яких із захворювань бактеріального менінгіту існують вакцини в даний час?
- Який організм може викликати епідемічний менінгіт?
Захворювання, пов'язані з клостридієм
Види в роду Clostridium - грампозитивні, ендоспороутворюючі стрижні, які є облігатними анаеробами. Ендоспори Clostridium spp. широко поширені в природі, зазвичай зустрічаються в грунті, воді, фекаліях, стічних водах та морських відкладеннях. Clostridium spp. виробляють більше видів білкових екзотоксинів, ніж будь-який інший бактеріальний рід, включаючи два екзотоксини з протеазною активністю, які є найпотужнішими відомими біологічними токсинами: ботулінічний нейротоксин (БОНТ) та протиправцевий нейротоксин (Tent). Ці два токсини мають смертельні дози 0,2-10 нг на кг маси тіла.
БонТ може бути вироблений унікальними штамами C. butyricum і C. baratii; однак, це в першу чергу пов'язано з C. botulinum і станом ботулізму. Tent, який викликає правець, виробляється лише C. tetani. Ці потужні нервові екзотоксини є первинними факторами вірулентності для цих збудників. Спосіб дії для цих токсинів був описаний у Факторах вірулентності бактеріальних та вірусних патогенів та проілюстрований на малюнку 15.3.7.
Діагностика правця або ботулізму зазвичай включає біоаналізи, які виявляють наявність BonT та TenT у зразках фекалу, крові (сироватці) або підозрюваних продуктах. Крім того, як C. botulinum, так і C. tetani можна виділити і культивувати за допомогою комерційно доступних середовищ для анаеробів. Також доступні тести ІФА та ЗТ-ПЛР.
Правець
Правець - це неінфекційне захворювання, що характеризується неконтрольованими м'язовими спазмами (скороченнями), викликаними дією тента. Зазвичай це відбувається, коли C. tetani заражає рану і виробляє ТЕНТ, який швидко зв'язується з нервовою тканиною, що призводить до інтоксикації (отруєння) нейронів. Залежно від місця та ступеня зараження випадки правця можуть бути описані як локалізовані, головні або генералізовані. Генералізований правець, який виникає у новонародженого, називається неонатальним правцем.
Локалізований правець виникає, коли ТЕНТ зачіпає тільки групи м'язів, близькі до місця травми. Ураження ЦНС відсутня, і симптоми, як правило, легкі, з локалізованими м'язовими спазмами, викликаними дисфункцією оточуючих нейронів. Особи з частковим імунітетом - особливо раніше вакциновані особи, які нехтують отримувати рекомендовані знімки бустера - найімовірніше розвинути локалізований правець внаслідок зараження проколу рани C. tetani.
Цефальний правець - рідкісна, локалізована форма правця, як правило, пов'язана з ранами на голові або обличчі. У рідкісних випадках він мав місце у випадках отиту (інфекції середнього вуха). Цефальний правець часто призводить до того, що пацієнти бачать подвійні зображення через спазми, що впливають на м'язи, які контролюють рух очей.
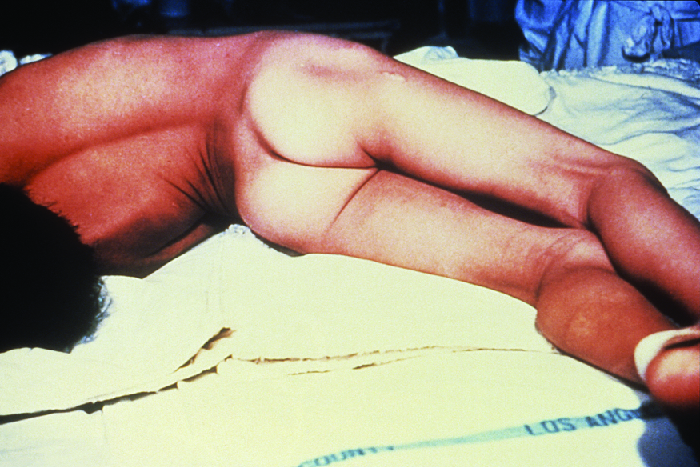
Як локалізований, так і головний правець може прогресувати до генералізованого правця - набагато більш серйозного стану - якщо Tent здатний поширюватися далі в тканини організму. При генералізованому правці тенТ надходить в нейрони ПНС. Звідти TenT рухається від місця рани, як правило, на кінцівці тіла, ретроградно (назад вгору) до гальмівних нейронів у ЦНС. Там він перешкоджає вивільненню гамма-аміномасляної кислоти (ГАМК), нейромедіатора, відповідального за розслаблення м'язів. Виникаючі м'язові спазми часто спочатку виникають в щелепних м'язах, приводячи до характерного симптому блокування щелепи (неможливість відкрити рот). Оскільки токсин поступово продовжує блокувати вивільнення нейромедіаторів, інші м'язи залучаються, що призводить до неконтрольованих, раптових м'язових спазмів, які є достатньо потужними, щоб викликати розриви сухожиль та перелом кісток. Спазми в м'язах шиї, спини та ніг можуть призвести до того, що тіло утворює жорстку, жорстку дугу, поставу, звану опістотоносом (рис.\(\PageIndex{5}\)). Спазми в гортані, діафрагмі, м'язах грудної клітки обмежують здатність пацієнта ковтати і дихати, в кінцевому підсумку приводячи до смерті від асфіксії (недостатнього надходження кисню).
Неонатальний правець зазвичай виникає, коли кукси пуповини забруднені спорами C. tetani після пологів. Хоча цей стан рідкісний у Сполучених Штатах, неонатальний правець є основною причиною дитячої смертності в країнах, де не вистачає імунізації матері від правця і де пологи часто відбуваються в антисанітарних умовах. В кінці першого тижня життя інфіковані немовлята стають дратівливими, погано харчуються, розвиваються ригідність при спазмах. Неонатальний правець має дуже поганий прогноз зі смертністю 70% — 100%. 10
Лікування пацієнтів із правцем включає допоміжне дихання за допомогою апарату штучної вентиляції легенів, знезараження ран, баланс рідини та антибіотикотерапію метронідазолом або пеніциліном для зупинки росту C. tetani. Крім того, пацієнти лікуються антитоксином TenT, бажано у вигляді людського імуноглобуліну для нейтралізації нефіксованого токсину та бензодіазепінів для посилення ефекту ГАМК для розслаблення м'язів і тривоги.
Вакцина проти правцевого анатоксину (ТТ) доступна для захисту та профілактики правця. Це Т-компонент вакцин, таких як DTaP, Tdap та Td. CDC рекомендує дітям отримувати дози вакцини DTaP у віці 2, 4, 6 та 15—18 місяців та інші у віці 4—6 років. Одна доза Td рекомендується підліткам та дорослим як підсилювач ТТ кожні 10 років. 11
ботулізм
Ботулізм - рідкісне, але часто смертельне захворювання, спричинене інтоксикацією БонТ. Вона може виникнути або в результаті зараження C. botulinum, в цьому випадку бактерії виробляють BonT in vivo, або в результаті безпосереднього впровадження БонТ в тканини.
Інфекція та вироблення BonT in vivo можуть призвести до ранового ботулізму, дитячого ботулізму та кишкового токсикозу у дорослих. Рановий ботулізм зазвичай виникає, коли C. botulinum вводять безпосередньо в рану після травматичної травми, глибокої проколу рани або місця ін'єкції. Дитячий ботулізм, який виникає у немовлят молодше 1 року, та кишковий токсикоз у дорослих, який виникає у дорослих з ослабленим імунітетом, є наслідком прийому C. botulinum endospores в їжу. Ендоспори проростають в організмі, в результаті чого відбувається вироблення BonT в кишковому тракті.
Інтоксикації виникають, коли БонТ виробляється поза організмом, а потім впроваджується безпосередньо в організм через їжу (харчовий ботулізм), повітря (інгаляційний ботулізм) або клінічну процедуру (ятрогенний ботулізм). Харчовий ботулізм, найпоширеніша з цих форм, виникає, коли BonT виробляється в забрудненій їжі, а потім потрапляє в організм разом з їжею (нагадаємо випадок у пункті: смуга поганих потлаків). Інгаляційний ботулізм зустрічається рідко, оскільки БонТ нестійкий як аерозоль і не зустрічається в природі; однак він може бути проведений в лабораторії і використовувався (безуспішно) як біозброя терористами в Японії в 1990-х роках. Мало місце також кілька випадків випадкового інгаляційного ботулізму. Ятрогенний ботулізм також зустрічається рідко; це пов'язано з ін'єкціями BonT, що використовуються в косметичних цілях (див. Мікроз'єднання: лікарське використання ботулотоксину).
Коли БонТ потрапляє в кровотік в шлунково-кишковому тракті, рані або легенях, він переноситься в нервово-м'язові з'єднання рухових нейронів, де необоротно зв'язується з пресинаптичними мембранами і перешкоджає вивільненню ацетилхоліну з пресинаптичного терміналу рухових нейронів в нервово-м'язову стик. Наслідком запобігання вивільненню ацетилхоліну є втрата м'язової активності, що призводить до розслаблення м'язів і, врешті-решт, паралічу.
Якщо BonT всмоктується через шлунково-кишковий тракт, ранні симптоми ботулізму включають помутніння зору, опущення повік, утруднене ковтання, спазми в животі, нудоту, блювоту, запор або, можливо, діарею. Далі слід прогресуючий млявий параліч, поступове ослаблення і втрата контролю над м'язами. Досвід пацієнта може бути особливо жахливим, оскільки слух залишається нормальним, свідомість не втрачається, і він повністю усвідомлює прогресування свого стану. У немовлят помітними ознаками ботулізму є слабкий крик, зниження здатності до смоктання і гіпотонія (кульгавість голови або тіла). Зрештою, ботулізм закінчується смертю від дихальної недостатності, викликаної прогресуючим паралічем м'язів верхніх дихальних шляхів, діафрагми та грудної клітини.
Ботулізм лікується антитоксином, специфічним для БонТ. При своєчасному введенні антитоксин зупиняє прогресування паралічу, але не змінює його. Після введення антитоксину пацієнт повільно відновлює неврологічну функцію, але це може зайняти кілька тижнів або місяців, залежно від тяжкості випадку. Під час одужання пацієнти, як правило, повинні залишатися госпіталізованими та отримувати дихальну допомогу через апарат ШВЛ.
Вправа\(\PageIndex{2}\)
- Як часто слід оновлювати вакцинацію проти правця у дорослих?
- Які найпоширеніші причини ботулізму?
- Чому ботулізм не лікується антибіотиком?
Медикаментозне використання ботулотоксину
Хоча це найбільш токсичний біологічний матеріал, відомий людині, ботулотоксин часто навмисно вводять людям для лікування інших станів. Ботулотоксин типу А застосовується косметично для зменшення зморшок. Ін'єкція дрібних кількостей цього токсину в обличчя викликає розслаблення м'язів обличчя, тим самим надаючи шкірі більш гладкий вигляд. Сіпання повік і схрещені очі також можна лікувати ін'єкціями ботулотоксину. Інші види застосування цього токсину включають лікування гіпергідрозу (надмірної пітливості). Насправді ботулотоксин може бути використаний для стримування наслідків кількох інших, очевидно, немікробних захворювань, пов'язаних з неналежною нервовою функцією. До таких захворювань належать ДЦП, розсіяний склероз, хвороба Паркінсона. Кожне з цих захворювань характеризується втратою контролю над м'язовими скороченнями; лікування ботулотоксином служить для розслаблення скорочених м'язів.
лістеріоз
Listeria monocytogenes - це некапсульований, неспорулюючий, грампозитивний стрижень і харчовий збудник, який викликає лістеріоз. Групи ризику включають вагітних жінок, новонароджених, людей похилого віку та людей з ослабленим імунітетом (згадайте тематичні дослідження Clinical Focus у галузі росту мікробів та мікробних механізмів патогенності). Лістеріоз призводить до менінгіту приблизно в 20% випадків, особливо новонароджених і пацієнтів старше 60 років. CDC визначає лістеріоз як третю провідну причину смерті через хвороби харчового походження, при цьому загальний рівень смертності досягає 16%. 12 У вагітних жінок лістеріоз може викликати також мимовільний аборт у вагітних через унікальну здатність збудника перетинати плаценту.
L. monocytogenes, як правило, вводиться в харчові продукти шляхом забруднення грунтом або тваринним гноєм, що використовується як добриво. Продукти харчування, які зазвичай асоціюються з лістеріозом, включають свіжі фрукти та овочі, заморожені овочі, оброблене м'ясо, м'які сири та сире молоко. 13 На відміну від більшості інших патогенів харчового походження, Listeria здатна рости при температурі від 0° C до 50° C, і тому може продовжувати рости навіть у охолоджених продуктах.
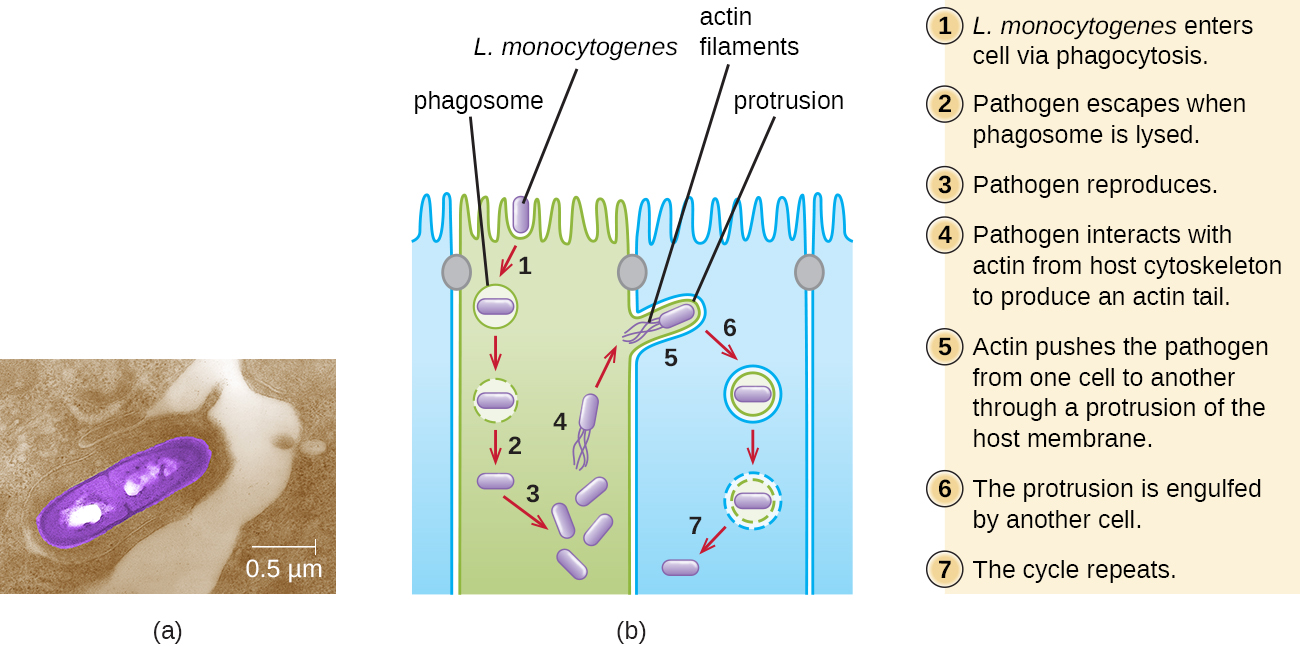
Попадання забрудненої їжі призводить спочатку до інфікування шлунково-кишкового тракту. Однак L. monocytogenes виробляє кілька унікальних факторів вірулентності, які дозволяють йому перетинати кишковий бар'єр і поширюватися на інші системи організму. Поверхневі білки, звані інтерналінами (InLa і InLb), допомагають L. monocytogenes вторгатися в нефагоцитарні клітини і тканини, проникаючи в стінку кишечника і стаючи дисемірующими через кровоносну та лімфатичну системи. Інтерналіни також дозволяють L. monocytogenes порушувати інші важливі бар'єри, включаючи гематоенцефалічний бар'єр і плаценту. У тканині L. monocytogenes використовує інші білки, звані лістеріолізином O та ActA, для полегшення міжклітинного руху, дозволяючи інфекції поширюватися від клітини до клітини (рис.\(\PageIndex{6}\)).
L. monocytogenes зазвичай ідентифікується шляхом культивування зразків із нормально стерильного ділянки (наприклад, крові або ліквору). Відновлення життєздатних організмів можна посилити за допомогою холодного збагачення шляхом інкубації зразків у бульйоні при 4° C протягом тижня і більше. Розрізнення типів і підтипів L. monocytogenes - важливий крок для діагностики та епідеміології - зазвичай проводиться за допомогою гель-електрофорезу імпульсного поля. Ідентифікація також може бути досягнута за допомогою хемілюмінесцентних аналізів ДНК зондів та MALDI-TOF.
Лікування лістеріозу передбачає антибіотикотерапію, найчастіше ампіциліном і гентаміцином. Вакцина відсутня.
Вправа\(\PageIndex{3}\)
Як лістерія потрапляє в нервову систему?
Хвороба Хансена (проказа)
Хвороба Хансена (також відома як проказа) викликається довгою, тонкою ниткоподібної паличкоподібної бактерією Mycobacterium leprae, облігатним внутрішньоклітинним збудником. M. leprae класифікується як грампозитивні бактерії, але найкраще візуалізувати мікроскопічно з кислотостійким плямою і, як правило, називають кислотостійкою бактерією. Хвороба Хансена вражає ПНС, приводячи до постійних пошкоджень і втрати придатків або інших частин тіла.
Хвороба Хансена є інфекційною, але не дуже заразною; приблизно 95% людського населення не можуть бути легко заражені, оскільки вони мають природний імунітет до М. leprae. Передача від людини до людини відбувається при вдиханні в слизову носа або тривалому і повторному контакті з інфікованою шкірою. Броненосці, один із лише п'яти ссавців, сприйнятливих до хвороби Хансена, також були причетні до передачі деяких випадків. 14
У людському організмі M. leprae найкраще росте при більш холодних температурах, що містяться в периферичних тканині, таких як ніс, пальці ніг, пальці та вуха. Деякі фактори вірулентності, що сприяють патогенності M. leprae, розташовані на капсулі і клітинній стінці бактерії. Ці фактори вірулентності дозволяють йому зв'язуватися з клітинами Швана та вторгатися в них, що призводить до прогресуючої демієлінізації, яка поступово руйнує нейрони ПНС. Втрата функції нейронів призводить до гіпестезії (оніміння) при інфікованих ураженнях. M. leprae легко фагоцитується макрофагами, але здатний вижити всередині макрофагів частково шляхом нейтралізації активних форм кисню, що утворюються в окислювальному сплеску фаголізосоми. Як і L. monocytogenes, M. leprae також може переміщатися безпосередньо між макрофагами, щоб уникнути кліренсу імунними факторами.
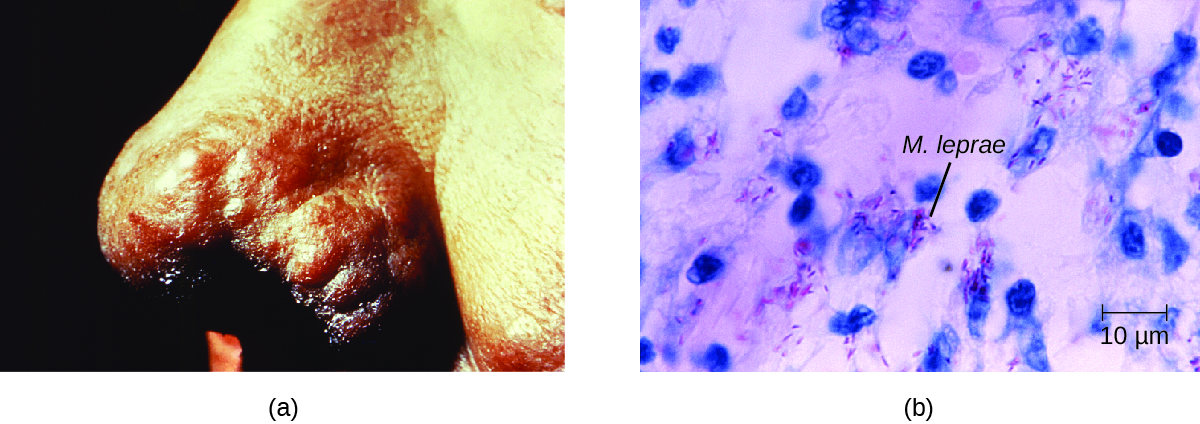
Ступінь захворювання пов'язана з імунною відповіддю пацієнта. Початкові симптоми можуть з'являтися не так довго, як від 2 до 5 років після зараження. Вони часто починаються з невеликих, збліднених, онімілих ділянок шкіри. У більшості людей вони будуть вирішуватися спонтанно, але деякі випадки можуть прогресувати до більш серйозної форми захворювання. Туберкулоїдна (пауцибациллярна) хвороба Хансена відзначається наявністю відносно небагатьох (трьох або менше) плоских, бланшованих уражень шкіри з невеликими вузликами по краях і малою кількістю бактерій, присутніх в ураженні. Хоча ці ураження можуть зберігатися роками або десятиліттями, бактерії контролюються ефективною імунною відповіддю, включаючи цитотоксичність, опосередковану клітинами. Особи, які не в змозі стримати інфекцію, можуть пізніше розвинутися лепроматозна (мультибацилярна) хвороба Хансена. Це прогресуюча форма захворювання, що характеризується вузликами, заповненими кислотостійкими бацилами і макрофагами. Порушення функції інфікованих клітин Шванна призводить до пошкодження периферичних нервів, що призводить до втрати чутливості, що призводить до виразок, деформацій та переломів. Пошкодження ліктьового нерва (в зап'ясті) M. leprae є однією з найпоширеніших причин каліки кисті. У деяких випадках хронічне пошкодження тканин може в кінцевому підсумку призвести до втрати пальців рук або ніг. При залученні тканин слизової також можуть виникати спотворюючі ураження носа і обличчя (рис.\(\PageIndex{7}\)).
Хвороба Хансена діагностується на підставі клінічних ознак і симптомів захворювання, і підтверджується наявністю кислотостійких бацил на мазках шкіри або в зразках біопсії шкіри (рис.\(\PageIndex{7}\)). M. leprae не росте in vitro на будь-яких відомих лабораторних середовищах, але його можна ідентифікувати шляхом культивування in vivo на підкладках лабораторних мишей або броненосців. При необхідності для діагностики та епідеміології може проводитися ПЛР та генотипування ДНК M. leprae в інфікованій тканині людини.
Хвороба Хансена добре піддається лікуванню і, якщо діагностувати та лікувати рано, не викликає інвалідності. У Сполучених Штатах більшість пацієнтів із хворобою Хансена лікуються в амбулаторних клініках великих міст за програмою Національної хвороби Хансена, єдиною установою в США, виключно присвяченою хворобі Хансена. З 1995 року ВООЗ зробила мультимедикаментозну терапію хвороби Хансена безкоштовною для всіх пацієнтів у всьому світі. Як результат, глобальна поширеність хвороби Хансена знизилася з приблизно 5,2 мільйона випадків у 1985 році до приблизно 176,000 у 2014 році. 15 Мультимедикаментозна терапія складається з дапсона і рифампіцину для всіх пацієнтів і третього препарату, клофазиміну, для пацієнтів з мультибацилярною хворобою.
В даний час не існує загальноприйнятої вакцини від хвороби Хансена. Індія і Бразилія використовують вакцину проти хвороби Хансена через те, що обидва захворювання викликаються видами Mycobacterium. Однак ефективність цього методу сумнівна, оскільки, схоже, вакцина працює в одних популяціях, але не в інших.
Вправа\(\PageIndex{4}\)
- Що перешкоджає прогресуванню від туберкулоїдної до прокази проматусу?
- Чому хвороба Хансена зазвичай вражає нерви кінцівок?
Колонії прокажених
Спотворюючи, смертельні захворювання, такі як проказа, історично були стигматизовані в багатьох культурах. До того, як проказу зрозуміли, жертви часто ізолювалися в колоніях прокажених, що часто згадується в стародавніх текстах, включаючи Біблію. Але колонії прокажених - це не просто артефакт стародавнього світу. На Гаваях колонія прокажених, створена в кінці дев'ятнадцятого століття, зберігалася до середини ХХ століття, її жителі змушені жити в жалюгідних умовах. 16 Хоча проказа є інфекційною хворобою, вона не вважається заразною (легко заразною), і вона, безумовно, не становить достатньої загрози, щоб виправдати постійну ізоляцію своїх жертв. Сьогодні ми зберігаємо практику ізоляції та карантину для пацієнтів з більш небезпечними захворюваннями, такими як Ебола або бактерії, стійкі до декількох лікарських засобів, такі як Mycobacterium tuberculosis та Staphylococcus aureus. Етичний аргумент цієї практики полягає в тому, що ізоляція інфікованих пацієнтів необхідна для запобігання передачі та розповсюдження сильно заразних захворювань - навіть коли це суперечить бажанням пацієнта.
Звичайно, набагато легше виправдати практику тимчасового, клінічного карантину, ніж постійну соціальну сегрегацію, як це сталося в колоніях прокажених. У 1980-х роках деякі групи закликали створити табори для людей, інфікованих СНІДом. Хоча ця ідея ніколи насправді не була реалізована, вона напрошується питання - де ми проводимо лінію? Чи є постійно ізоляційні табори чи колонії коли-небудь медично чи соціально виправдані? Припустимо, стався спалах смертельного, заразного захворювання, лікування якого немає. Чи було б виправдано нав'язувати соціальну ізоляцію тим, хто страждає хворобою? Як би ми збалансували права заражених з ризиком, який вони представляють для інших? Якою мірою суспільство має очікувати, що люди ризикують власним здоров'ям заради гуманного ставлення до інших?
Бактеріальні інфекції нервової системи
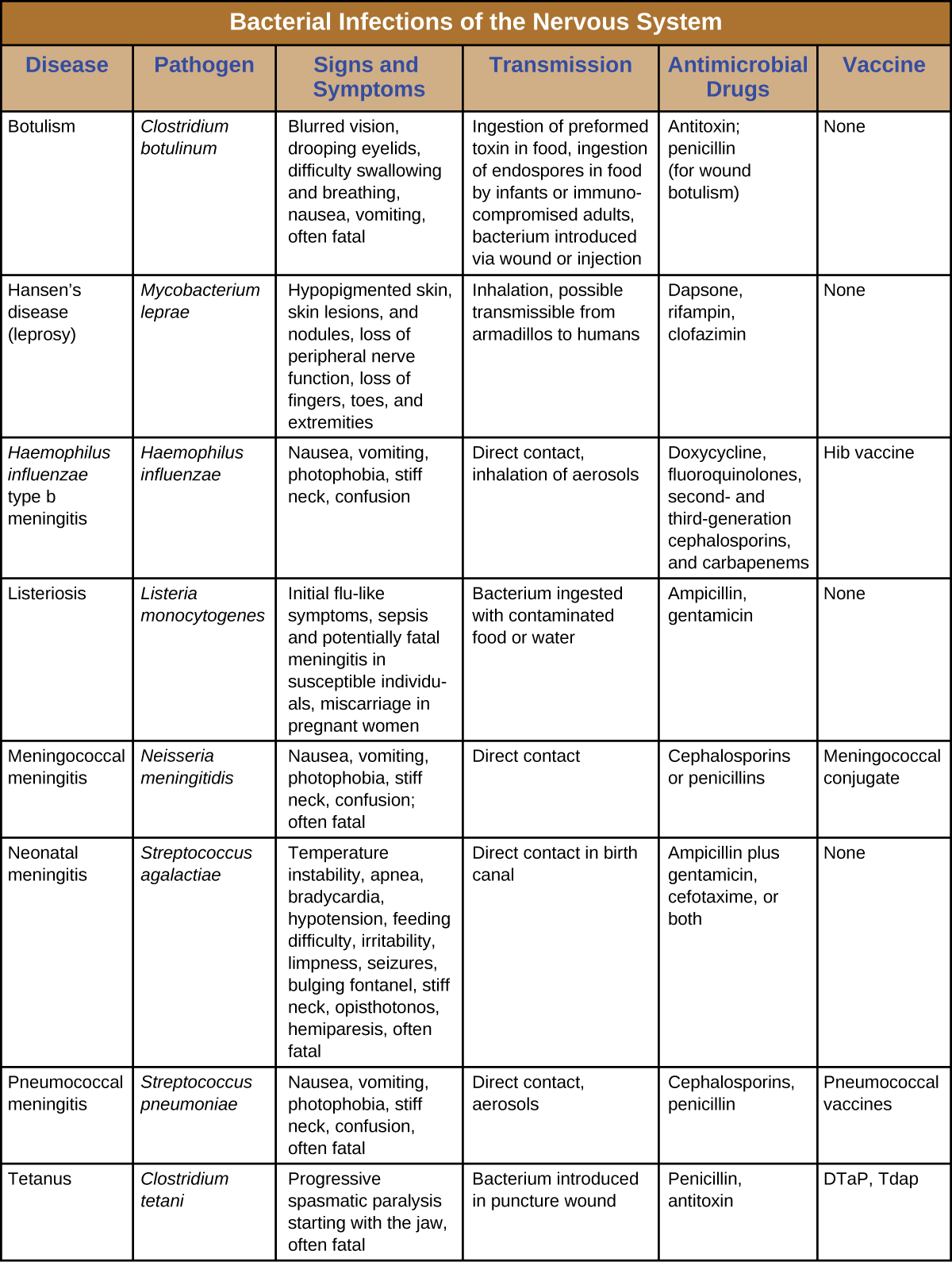
Незважаючи на грізні захисні сили, що захищають нервову систему, ряд бактеріальних збудників, як відомо, викликають серйозні інфекції ЦНС або ПНС. На жаль, ці інфекції часто є серйозними і небезпечними для життя. Малюнок\(\PageIndex{8}\) підсумовує деякі важливі інфекції нервової системи.
Ключові поняття та резюме
- Бактеріальний менінгіт може бути викликаний декількома видами інкапсульованих бактерій, включаючи Haemophilus influenzae, Neisseria meningitidis, Streptococcus pneumoniae та Streptococcus agalactiae (стрептококи групи В). H. influenzae вражає в першу чергу маленьких дітей і новонароджених, N. meningitidis є єдиним інфекційним збудником і в основному вражає дітей і молодих людей, S. pneumoniae вражає переважно маленьких дітей, а S. agalactiae вражає новонароджених під час або коротко після народження.
- Симптоми бактеріального менінгіту включають лихоманку, скутість шиї, головний біль, сплутаність свідомості, судоми, кому та смерть.
- Діагностика бактеріального менінгіту проводиться шляхом спостережень і посіву організмів в лікворі. Бактеріальний менінгіт лікується антибіотиками. H. influenzae та N. meningitidis мають доступні вакцини.
- Види Clostridium викликають неврологічні захворювання, включаючи ботулізм та правець, виробляючи потужні нейротоксини, які перешкоджають вивільненню нейромедіаторів. Зазвичай уражається ПНС. Лікування інфекції Clostridium ефективно тільки шляхом ранньої діагностики з введенням антибіотиків для контролю інфекції та антитоксинів для нейтралізації ендотоксину до їх потрапляння в клітини.
- Listeria monocytogenes є харчовим збудником, який може інфікувати ЦНС, викликаючи менінгіт. Інфекція може поширюватися через плаценту до плоду. Діагностика здійснюється через посів крові або ліквору. Лікування проводиться антибіотиками і вакцини немає.
- Хвороба Хансена (проказа) викликається внутрішньоклітинним паразитом Mycobacterium leprae. Інфекції викликають деміленацію нейронів, що призводить до зниження чутливості в периферичних придатках і ділянках тіла. Лікування проводиться мультимедикаментозною антибіотикотерапією, і не існує загальновизнаної вакцини.
Виноски
- 1 Тігпен, Майкл К., Синтія Уїтні, Ненсі Е. Мессоннієр, Елізабет Зелл, Рут Лінфілд, Джеймс Лі Хедлер, Лі Харрісон та ін., «Бактеріальний менінгіт у Сполучених Штатах, 1998—2007,» New England Journal of Medicine 364, no. 21 (2011): 2016-25.
- 2 Попович, Т., та ін. Всесвітня організація охорони здоров'я, «Лабораторний посібник з діагностики менінгіту, спричиненого Neisseria meningitidis, Streptococcus pneumoniae та гемофільного грипу», 1999.
- 3 Центри США з контролю та профілактики захворювань, «Менінгококова хвороба», 5 серпня 2015 року. Доступ 28 червня 2015. www.cdc.gov/менінгококкал/сур... nce/index.html.
- 4 Центри США з контролю та профілактики захворювань, «Рекомендований графік імунізації для осіб віком від 0 до 18 років, США, 2016,» 1 лютого 2016 року. Доступ 28 червня 2016 року. www.cdc.gov/вакцини/графік... dolescent.html.
- 5 Національна асоціація менінгіту, «Спалахи менінгококової хвороби серогрупи B в кампусах коледжів США», 2016. Доступ до 28 червня 2016 року. http://www.nmaus.org/disease-prevent...ase/outbreaks/.
- 6 Міністерство охорони здоров'я та соціальних служб США, «Hib (Haemophilus Influenzae типу B),» Доступ 28 червня 2016 року. http://www.vaccines.gov/diseases/hib/ #.
- 7 Центри США з контролю та профілактики захворювань, «Менінгококова хвороба, тенденції захворювань», 2015. Доступ до вересня 13, 2016. www.cdc.gov/менінгококкал/сур... nce/index.html.
- 8 Тігпен, Майкл К., Синтія Уїтні, Ненсі Е. Мессоннієр, Елізабет Зелл, Рут Лінфілд, Джеймс Лі Хедлер, Лі Харрісон та ін., «Бактеріальний менінгіт у Сполучених Штатах, 1998—2007,» New England Journal of Medicine 364, no. 21 (2011): 2016-25.
- 9 Тігпен, Майкл К., Синтія Уїтні, Ненсі Е. Мессонніє, Елізабет Р. Целл, Рут Лінфілд, Джеймс Л.Хедлер, Лі Гаррісон та ін., «Бактеріальний менінгіт у Сполучених Штатах, 1998—2007,» Нова Англія Журнал медицини 364, № 21 (2011): 2016-25; Хіт, Пол Т., Гейл Бальфур, Еббі М. Вайснер, Андрулла Ефстратіу, Тереза Ламагні, Хелен Тіге, Ліам А.Ф. О'Коннелл та ін., «Стрептококова хвороба групи В у Великобританії та ірландських немовлят молодше 90 днів» Ланцет 363, № 9405 (2004): 292-4.
- 10 ЮНФПА, ЮНІСЕФ ВООЗ, «Ліквідація правця матері та новонароджених до 2005 року», 2000. www.unicef.org/imnunization/f... tegy_paper.pdf.
- 11 Центри США з контролю та профілактики захворювань, «Вакцинація проти правця», 2013. Доступ до 29 червня 2016 року. http://www.cdc.gov/tetanus/vaccination.html.
- 12 Скаллан, Елейн, Роберт М. Хокстра, Фредерік Дж. Ангуло, Роберт В. Таукс, Марк-Ален Віддоусон, Шерон Л. Рой, Джеффрі Л.Джонс, і Патрісія М. Гріффін, «Харчові хвороби, придбані в Сполучених Штатах - основні патогени», «Нові інфекційні захворювання 17, № 1 (2011): 7-15.
- 13 Центри США з контролю та профілактики захворювань, «Спалахи лістерії», 2016. Доступ до 29 червня 2016 року. https://www.cdc.gov/listeria/outbreaks/index.html.
- 14 Шарма, Рахул, Пушпендра Сінгх, У. Дж. Лоурі, Дж. Мітчелл Локхарт, Баррі Інман, Малкольм С. Дюті, Марія Т. Пена та ін., «Зоонозна проказа на південному сході США», «Нові інфекційні захворювання 21, № 12 (2015): 2127-34.
- 15 Всесвітня організація охорони здоров'я, «Лист фактів прокази», 2016. Доступ до 13 вересня 2016 року. http://www.who.int/mediacentre/factsheets/fs101/en/.
- 16 Служба національних парків, «Коротка історія Калаупапи», Доступ до лютого 2, 2016. www.nps.gov/kala/learn/histor... -kalaupapa.htm.
