25.2: Бактеріальні інфекції кровоносної та лімфатичної систем
- Page ID
- 4034
Цілі навчання
- Визначте та порівняйте бактерії, які найчастіше викликають інфекції кровоносної та лімфатичної систем
- Порівняйте основні характеристики специфічних бактеріальних захворювань, що вражають кровоносну і лімфатичну системи
Бактерії можуть потрапляти в кровоносну та лімфатичну системи через гострі інфекції або порушення шкірного бар'єру або слизової оболонки. Порушення можуть відбуватися через досить поширені явища, такі як укуси комах або невеликі рани. Навіть акт чищення зубів, який може викликати невеликі розриви ясен, може занести бактерії в кровоносну систему. У більшості випадків бактеріємія, яка виникає внаслідок таких поширених впливів, є тимчасовою і залишається нижче порогу виявлення. У важких випадках бактеріємія може призвести до септицемії з небезпечними ускладненнями, такими як токсикоз, сепсис та септичний шок. У цих ситуаціях часто імунна відповідь на інфекцію призводить до клінічних ознак та симптомів, а не самих мікробів.
Бактеріальний сепсис, септичний і токсичний шок
При низьких концентраціях прозапальні цитокіни, такі як інтерлейкін 1 (IL-1) та фактор некрозу пухлини-α (TNF-α), відіграють важливу роль в імунному захисті господаря. Однак, коли вони циркулюють системно у більшій кількості, результуюча імунна відповідь може бути небезпечною для життя. ІЛ-1 індукує вазодилатацію (розширення кровоносних судин) і зменшує щільні з'єднання між судинними ендотеліальними клітинами, що призводить до поширеного набряку. У міру просування рідини з кровообігу в тканини починає знижуватися артеріальний тиск. Якщо не контролювати, артеріальний тиск може впасти нижче рівня, необхідного для підтримки належної функції нирок та дихання, стан, відомий як септичний шок. Крім того, надмірне виділення цитокінів під час запальної реакції може привести до утворення тромбів. Втрата артеріального тиску та виникнення тромбів може призвести до поліорганної недостатності та смерті.
Бактерії є найбільш поширеними збудниками, пов'язаними з розвитком сепсису, і септичного шоку. 1 Найпоширенішою інфекцією, пов'язаною з сепсисом, є бактеріальна пневмонія (див. Бактеріальні інфекції дихальних шляхів), що становить близько половини всіх випадків, за якими слідують внутрішньочеревні інфекції (бактеріальні інфекції шлунково-кишкового тракту) та сечовивідні інфекції трактів (бактеріальні інфекції сечовидільної системи). 2 Інфекції, пов'язані з поверхневими ранами, укусами тварин та постійними катетерами, також можуть призвести до сепсису та септичного шоку.
Ці спочатку незначні, локалізовані інфекції можуть бути викликані широким спектром різних бактерій, включаючи стафілокок, стрептокок, синьогнійна, пастерелла, ацинетобактер та члени Enterobacteriaceae. Однак, якщо їх не лікувати, інфекції цими грампозитивними та грамнегативними збудниками потенційно можуть прогресувати до сепсису, шоку та смерті.
Синдром токсичного шоку та стрептококовий токсичний шок-подібний синдром
Токсемія, пов'язана з інфекціями, викликаними золотистим стафілококом, може викликати синдром стафілококового токсичного шоку (ТСС). Деякі штами S. aureus виробляють суперантиген, званий синдромом токсичного шоку токсин-1 (TSST-1). ТСС може виникати як ускладнення інших локалізованих або системних інфекцій, таких як пневмонія, остеомієліт, синусит і шкірні рани (хірургічні, травматичні або опіки). Ті, хто схильний до найвищого ризику стафілококового ТСС, - це жінки з раніше існуючою колонізацією піхви S. aureus, які залишають тампони, протизаплідні губки, діафрагми або інші пристрої у піхві довше рекомендованого часу.
Стафілококовий ТСС характеризується раптовим початком блювоти, діареї, міалгії, температури тіла вище 38,9° C (102,0° F) і швидкої гіпотензії з систолічним артеріальним тиском менше 90 мм рт.ст. для дорослих; дифузна еритематозна висип, що призводить до лущення і осипання шкіри через 1-2 тижні після початок; і додаткове залучення трьох і більше систем органів. 3 Рівень смертності, пов'язаний зі стафілококовим ТСС, становить менше 3% випадків.
Діагностика стафілококової ТСС ґрунтується на клінічних ознаках, симптомах, серологічних тестах для підтвердження видів бактерій та виявленні вироблення токсину зі стафілококових ізолятів. Культури шкіри і крові часто негативні; менше 5% є позитивними у випадках стафілококової ТСС. Лікування стафілококової ТСС включає дезактивацію, знезараження, вазопресори для підвищення артеріального тиску та антибіотикотерапію кліндаміцином плюс ванкоміцином або даптоміцином в очікуванні результатів сприйнятливості.
Синдром з ознаками і симптомами, схожими на стафілококовий ТСС, може бути викликаний Streptococcus pyogenes. Цей стан, званий стрептококовим токсичним ударно-подібним синдромом (STSS), характеризується більш важкою патофізіологією, ніж стафілококовий ТСС, у 4 при цьому близько 50% хворих розвиваються S. pyogenes bacteremia і некротизуючий фасциит. На відміну від стафілококової ТСС, СТСС частіше викликає гострий респіраторний дистрес-синдром (ГРДС), швидко прогресуюче захворювання, що характеризується накопиченням рідини в легенях, що гальмує дихання і викликає гіпоксемію (низький рівень кисню в крові). STSS асоціюється з більш високим рівнем смертності (20% — 60%) навіть при агресивній терапії. STSS зазвичай розвивається у пацієнтів із стрептококовою інфекцією м'яких тканин, такою як бактеріальний целюліт, некротичний фасциит, піоміозит (утворення гною в м'язах, викликане інфекцією), недавня інфекція грипу А або вітрянка.
Вправа\(\PageIndex{1}\)
Як велика кількість прозапальних цитокінів може призвести до септичного шоку?
Клінічна спрямованість: Частина 2
Незважаючи на терапію оксациліном, стан Барбари продовжував погіршуватися протягом наступних кількох днів. Її лихоманка зросла до 40,1° C (104,2° F), і вона почала відчувати озноб, прискорене дихання та сплутаність свідомості. Її лікар запідозрив бактеріємію препаратостійкою бактерією і прийняв Барбару до лікарні. Культури місця операції і крові виявили золотистий стафілокок. Тестування на чутливість до антибіотиків підтвердило, що ізолят був стійким до метициліну S. aureus (MRSA). У відповідь лікар Барбари змінив антибіотикотерапію на ванкоміцин і організував видалення порту та венозного катетера.
Вправа\(\PageIndex{2}\)
- Чому інфекція Барбари не відповіла на терапію оксациліном?
- Чому лікар видалив порт і катетер?
- Виходячи з описаних ознак та симптомів, які можливі діагнози стану Барбари?
післяпологовий сепсис
Тип сепсису, який називається післяпологовим сепсисом, також відомий як післяпологова інфекція, післяпологова лихоманка або лихоманка дитячого ліжка, - це внутрішньолікарняна інфекція, пов'язана з періодом післяпологового періоду - час після пологів, під час якого репродуктивна система матері повертається до невагітного стану. Такі інфекції можуть виникати в статевих шляхах, молочній залозі, сечовивідних шляхах або хірургічній рані. Спочатку інфекція може обмежуватися маткою або іншим місцевим місцем інфекції, але вона може швидко поширюватися, що призводить до перитоніту, септицемії та смерті. До роботи Ігнаца Земмельвейса 19 століття та широкого прийняття теорії мікробів (див. Сучасні основи клітинної теорії) післяпологовий сепсис був основною причиною смертності серед новонароджених матерів у перші кілька днів після пологів.
Піродеральний сепсис часто асоціюється з Streptococcus pyogenes, але багато інших бактерій також можуть бути відповідальними. Приклади включають грампозитивні бактерії (наприклад, Streptococcus spp., Staphylococcus spp. та Enterococcus spp.), грамнегативні бактерії (наприклад, Chlamydia spp., Escherichia coli, Klebsiella spp. та Proteus spp.), як а також анаероби, такі як Peptostreptococcus spp., Bacteroides spp., і Clostridium spp. У випадках, викликаних S. pyogenes, бактерії приєднуються до тканин господаря за допомогою білка М і виробляють вуглеводну капсулу, щоб уникнути фагоцитозу. S. pyogenes також виробляє різноманітні екзотоксини, такі як стрептококові пірогенні екзотоксини А і В, які пов'язані з вірулентністю і можуть функціонувати як суперантигени.
Діагностика післяпологової лихоманки ґрунтується на терміні та ступеня лихоманки та ізоляції та ідентифікації етіологічного агента у зразках крові, рани або сечі. Оскільки існує безліч можливих причин, для визначення найкращого антибіотика для лікування необхідно використовувати тестування на сприйнятливість до протимікробних препаратів. Внутрішньолікарняна частота післяпологової лихоманки може бути значно знижена завдяки застосуванню антисептиків під час пологів та суворому дотриманню протоколів миття рук лікарями, акушерками та медсестрами.
Інфекційний артрит
Також називається септичним артритом, інфекційний артрит може бути як гострим, так і хронічним станом. Інфекційний артрит характеризується запаленням суглобових тканин і найчастіше викликається бактеріальними збудниками. Більшість випадків гострого інфекційного артриту є вторинними по відношенню до бактеріємії, з швидким початком помірного до сильного болю в суглобах і набряку, що обмежує рух ураженого суглоба. У дорослих і маленьких дітей інфекційний збудник найчастіше вводиться безпосередньо через травму, наприклад, рану або місце хірургічного втручання, і приносять до суглоба через кровоносну систему. Гострі інфекції можуть виникнути і після операції із заміщення суглоба. Гострий інфекційний артрит часто виникає у пацієнтів з порушенням імунної системи іншими вірусними та бактеріальними інфекціями. S. aureus є найбільш частою причиною гострого септичного артриту у загальної популяції дорослих і маленьких дітей. Neisseria gonorrhoeae є важливою причиною гострого інфекційного артриту у сексуально активних осіб.
Хронічний інфекційний артрит відповідає за 5% всіх випадків інфекційного артриту і частіше зустрічається у пацієнтів з іншими захворюваннями або станами. До групи ризику відносяться ті, хто має ВІЛ-інфекцію, бактеріальну або грибкову інфекцію, протезування суглобів, ревматоїдний артрит (РА) або хто проходить імуносупресивну хіміотерапію. Початок часто в одному суглобі; може бути мало або взагалі не біль, ниючий біль, який може бути м'яким, поступовий набряк, м'яке тепло, і мінімальне або відсутнє почервоніння області суглоба.
Діагностика інфекційного артриту вимагає аспірації невеликої кількості синовіальної рідини з ураженого суглоба. Для виявлення потенційного збудника використовують безпосередню мікроскопічну оцінку, посів, антимікробну чутливість, аналіз на полімеразну ланцюгову реакцію (ПЛР) синовіальної рідини. Типове лікування включає прийом відповідних протимікробних препаратів на основі тестування на чутливість до антимікробних препаратів. Для нестійких до лікарських препаратів штамів бактерій при стафілококових інфекціях часто призначають β-лактами, такі як оксацилін і цефазолін. Цефалоспорини третього покоління (наприклад, цефтриаксон) використовуються для дедалі поширеніших β-лактам-резистентних інфекцій Neisseria. Інфекції Mycobacterium spp. або грибами лікуються відповідною тривалою антимікробною терапією. Навіть при лікуванні прогноз часто поганий для інфікованих. Близько 40% пацієнтів з негонококовим інфекційним артритом зазнають постійних пошкоджень суглобів, а рівень смертності коливається від 5% до 20%. 5 Показники смертності вище серед людей похилого віку. 6
Остеомієліт
Остеомієліт - це запалення кісткових тканин, найчастіше викликане інфекцією. Ці інфекції можуть бути гострими або хронічними і можуть включати безліч різних бактерій. Найпоширенішим збудником остеомієліту є S. aureus. Однак M. tuberculosis, Pseudomonas aeruginosa, Streptococcus pyogenes, S. agalactiae, види в Enterobacteriaceae та інші мікроорганізми також можуть викликати остеомієліт, в залежності від того, які кістки задіяні. У дорослих бактерії зазвичай отримують прямий доступ до кісткових тканин через травму або хірургічну процедуру за участю протезування суглобів. У дітей бактерії часто впроваджуються з кровотоку, можливо, поширюючись від вогнищевих інфекцій. Довгі кістки, такі як стегнова кістка, частіше уражаються у дітей через більш велику васкуляризацію кісток у молодих. 7
Ознаки та симптоми остеомієліту включають лихоманку, локалізований біль, набряк через набряки, а також виразки в м'яких тканині поблизу місця зараження. Отримане запалення може призвести до пошкодження тканин і втрати кісток. Крім того, інфекція може поширитися на суглоби, в результаті чого виникає інфекційний артрит, або поширюватися в кров, в результаті чого виникає сепсис і тромбоз (утворення тромбів). Як і септичний артрит, остеомієліт зазвичай діагностується за допомогою комбінації рентгенографії, візуалізації та ідентифікації бактерій з культур крові або з кісткових культур, якщо культури крові негативні. Парентеральна антибіотикотерапія зазвичай використовується для лікування остеомієліту. Через кількість різних можливих етіологічних агентів, однак, різні препарати можуть бути використані. Антибактеріальні препарати широкого спектру дії, такі як нафцилін, оксацилін або цефалоспорин, зазвичай призначаються при гострому остеомієліті, а ампіцилін і піперацилін/тазобактам - при хронічному остеомієліті. У випадках резистентності до антибіотиків іноді потрібно лікування ванкоміцином для боротьби з інфекцією. У серйозних випадках може знадобитися операція з видалення місця зараження. Інші форми лікування включають гіпербаричну кисневу терапію (див. Використання фізичних методів боротьби з мікроорганізмами) та імплантацію антибіотичних кульок або насосів.
Вправа\(\PageIndex{3}\)
Яка бактерія найпоширеніша причина як септичного артриту, так і остеомієліту?
Ревматична лихоманка
Інфекції S. pyogenes мають різноманітні прояви та ускладнення, які зазвичай називають наслідками. Як уже згадувалося, бактерія може викликати гнійні інфекції, такі як післяпологова лихоманка. Однак цей мікроб також може спричинити негнійні наслідки у вигляді гострої ревматичної лихоманки (ГРФ), яка може призвести до ревматичних захворювань серця, впливаючи тим самим на кровоносну систему. Ревматична лихоманка виникає переважно у дітей мінімум через 2-3 тижні після епізоду нелікованого або неадекватно лікуваного фарингіту (див. Бактеріальні інфекції дихальних шляхів). Свого часу ревматична лихоманка була головним вбивцею дітей в США; однак сьогодні вона рідко зустрічається в США через ранню діагностику та лікування стрептококового фарингіту антибіотиками. У куточках світу, де діагностика та лікування недоступні, гостра ревматична лихоманка та ревматична хвороба серця все ще є основними причинами смертності у дітей. 8
Ревматична лихоманка характеризується різноманітними діагностичними ознаками та симптомами, спричиненими негнойним, імуноопосередкованим пошкодженням внаслідок перехресної реакції між антитілами пацієнта до бактеріальних поверхневих білків та подібними білками, виявленими на серцевій, нейрональній та синовіальній тканині. Пошкодження нервової тканини або суглобів, що призводить до болю в суглобах і набряклості, є оборотним. Однак пошкодження серцевих клапанів може бути незворотним і погіршується повторними епізодами гострої ревматичної лихоманки, особливо протягом перших 3-5 років після першого нападу ревматичної лихоманки. Запалення клапанів серця, викликане перехресно реагуючими антитілами, призводить до рубцювання і жорсткості стулок клапана. Це, в свою чергу, виробляє характерний серцевий шум. Пацієнти, у яких раніше розвинулася ревматична лихоманка і у яких згодом розвивається рецидивуючий фарингіт через S. pyogenes, піддаються високому ризику повторних нападів ревматичної лихоманки.
Американська асоціація серця рекомендує 9 схему лікування, що складається з бензатинбензилпеніциліну кожні 3 або 4 тижні, залежно від ризику повторного зараження пацієнта. Додаткове профілактичне лікування антибіотиками може бути рекомендовано залежно від віку пацієнта та ризику повторного зараження.
Бактеріальний ендокардит і перикардит
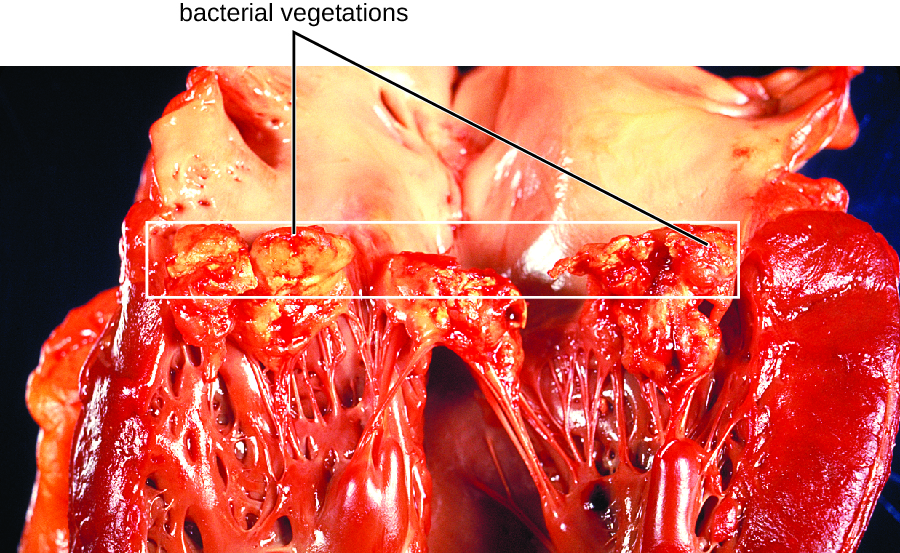
Ендокард - це тканинний шар, який вирівнює м'язи і клапани серця. Ця тканина може заразитися різними бактеріями, включаючи грампозитивні коки, такі як золотистий стафілокок, стрептококи viridans та Enterococcus faecalis, а також грамнегативні так звані бацили HACEK: Haemophilus spp., Actinobacillus актиноміцетемкомітани, кардіобактерії гомініс, Eikenella corordens та Кінгела кінгае. Виникаюче запалення називається ендокардит, який можна охарактеризувати як гострий, так і підгострий. Збудники зазвичай потрапляють у кров під час випадкових або навмисних порушень нормальної бар'єрної захисту (наприклад, стоматологічні процедури, пірсинг тіла, катетеризація, рани). Особи з раніше існуючими пошкодженнями серця, протезами клапанів та іншими серцевими пристроями, а також особи з ревматичною лихоманкою в анамнезі мають більший ризик розвитку ендокардиту. Це захворювання здатне швидко руйнувати серцеві клапани і при відсутності лікування привести до смерті всього за кілька днів.
При підгострому бактеріальному ендокардиті пошкодження серцевого клапана відбувається повільно протягом декількох місяців. За цей час в серці утворюються тромби, і вони захищають бактерії від фагоцитів. Ці ділянки тканин асоційованих бактерій називаються рослинністю. Отримане пошкодження серця, частково в результаті імунної відповіді, що викликає фіброз серцевих клапанів, може спричинити необхідність заміни серцевого клапана (рис.\(\PageIndex{1}\)). Зовнішні ознаки підгострого ендокардиту можуть включати лихоманку.
Діагностика інфекційного ендокардиту визначається за допомогою комбінації посівів крові, ехокардіограми, клінічних симптомів. Як при гострому, так і при підгострому ендокардиті лікування зазвичай включає відносно високі дози внутрішньовенних антибіотиків, що визначаються тестуванням на чутливість до антимікробних препаратів. Гострий ендокардит часто лікується комбінацією ампіциліну, нафциліну та гентаміцину для синергетичного покриття Staphylococcus spp. та Streptococcus spp. Протезно-клапанний ендокардит часто лікують комбінацією ванкоміцину, рифампіну, гентаміцину. Рифампін необхідний для лікування осіб з інфекцією протезних клапанів або інших чужорідних тіл, оскільки рифампін може проникати в біоплівку більшості збудників, які заражають ці пристрої.
Staphylcoccus spp. і Streptococcus spp. також можуть інфікувати і викликати запалення в тканині, що оточують серце, стан, який називається гострим перикардит. Перикардит відзначається болем у грудях, утруднене дихання, сухий кашель. У більшості випадків перикардит є самообмежуючим і клінічне втручання не потрібно. Діагноз ставиться за допомогою рентгенограми грудної клітини, електрокардіограми, ехокардіограми, аспірату перикардіальної рідини або біопсії перикарда. Антибактеріальні препарати можуть бути призначені при інфекціях, пов'язаних з перикардит; однак перикардит може бути викликаний і іншими збудниками, включаючи віруси (наприклад, еховірус, вірус грипу), гриби (наприклад, Histoplasma spp., Coccidioides spp.) та еукаріотичні паразити (наприклад, Токсоплазма spp.).
Вправа\(\PageIndex{4}\)
Порівняйте гострий і підгострий бактеріальний ендокардит.
Газова гангрена
Травматичні ушкодження або певні медичні стани, такі як діабет, можуть спричинити пошкодження кровоносних судин, що перериває приплив крові до ділянки тіла. Коли кровотік переривається, тканини починають відмирати, створюючи анаеробне середовище, в якій можуть процвітати анаеробні бактерії. Такий стан називається ішемією. Ендоспори анаеробної бактерії Clostridium perfringens (поряд з низкою інших Clostridium spp. з кишечника) можуть легко проростати в ішемічних тканині і колонізувати анаеробні тканини.
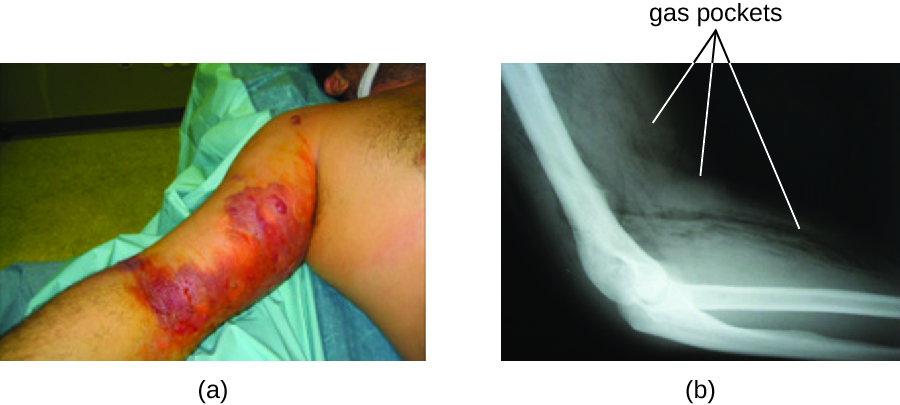
Отримана інфекція, звана газовою гангреною, характеризується швидко поширюється міонекрозом (відмиранням м'язової тканини). Хворий відчуває раптовий початок болісних болів в місці зараження і швидкий розвиток погано пахне рани, що містить бульбашки газу і тонкі жовтуваті виділення з відтінком невеликої кількості крові. У міру прогресування інфекції утворюються набряки і шкірні пухирі, що містять синювато-фіолетову рідину. Заражена тканина розріджується і починає лущитися. Перемежа між некротичною та здоровою тканиною часто досягає декількох дюймів на годину навіть при антибіотикотерапії. Септичний шок і органна недостатність часто супроводжують газову гангрену; коли у пацієнтів розвивається сепсис, смертність перевищує 50%.
α-токсин і тета (θ) токсин є основними факторами вірулентності C. perfringens, задіяних в газовій гангрені. α-токсин - ліпаза, відповідальна за руйнування клітинних мембран; він також викликає утворення тромбів (тромбів) в кровоносних судибах, сприяючи поширенню ішемії. пори в клітинних мембранах пацієнта, що викликають лізис клітин. Газ, пов'язаний з газовою гангреною, виробляється шляхом бродіння Clostridium масляної кислоти, яка виробляє водень і вуглекислий газ, які виділяються в міру розмноження бактерій, утворюючи кишені газу в тканині (рис.\(\PageIndex{2}\)).
Газова гангрена спочатку діагностується на підставі наявності клінічних ознак і симптомів, описаних раніше в цьому розділі. Діагноз може бути підтверджений за допомогою фарбування Грама та анаеробного культивування ранового ексудату (дренажу) та зразків тканин на агарі крові. Лікування, як правило, включає хірургічне очищення будь-якої некротичної тканини; запущені випадки можуть вимагати ампутації. Хірурги також можуть використовувати вакуумне закриття (VAC), хірургічний метод, в якому вакуумний дренаж використовується для видалення крові або серозної рідини з рани або хірургічного місця для прискорення відновлення. Найбільш поширені методи лікування антибіотиками включають пеніцилін G і кліндаміцин. Деякі випадки також лікуються гіпербаричною кисневою терапією, оскільки Clostridium spp. не здатні виживати в середовищах, багатих киснем.
Туляремія
Зараження грамнегативною бактерією Francisella tularensis викликає туляремію (або кролячу лихоманку), зоонозну інфекцію у людини. F. tularensis - факультативний внутрішньоклітинний паразит, який в першу чергу викликає хвороби у кроликів, хоча велика кількість одомашнених тварин також схильні до зараження. Люди можуть бути заражені через проковтування забрудненого м'яса або, що більш зазвичай, обробки інфікованих тканин тварин (наприклад, зняття шкіри зараженого кролика). Туляремія також може передаватися укусами заражених членистоногих, включаючи собачого кліща (Dermacentor variabilis), самотнього зіркового кліща (Amblyomma americanum), деревного кліща (Dermacentor andersoni) та оленячих мух (Chrysops spp.). Хоча хвороба безпосередньо не заразиться між людьми, вплив аерозолів F. tularensis може призвести до небезпечних для життя інфекцій. F. tularensis дуже заразний, з інфекційною дозою всього 10 бактеріальних клітин. Крім того, легеневі інфекції мають 30% - 60% летальності, якщо їх не лікувати. 10 З цих причин F. tularensis в даний час класифікується і повинен розглядатися як організм рівня біобезпеки 3 (BSL-3) і як потенційний біологічний бойовий агент.
Після введення через розрив шкіри бактерії спочатку переміщаються в лімфатичні вузли, куди потрапляють в організм фагоцитами. Після виходу з фагосоми бактерії ростуть і розмножуються внутрішньоклітинно в цитоплазмі фагоцитів. Пізніше вони можуть поширюватися через кров до інших органів, таких як печінка, легені та селезінка, де вони виробляють маси тканини, звані гранульомами (рис.\(\PageIndex{3}\)). Після інкубаційного періоду близько 3 днів на місці зараження розвиваються ураження шкіри. Інші ознаки та симптоми включають лихоманку, озноб, головний біль та набряклі та хворобливі лімфатичні вузли.
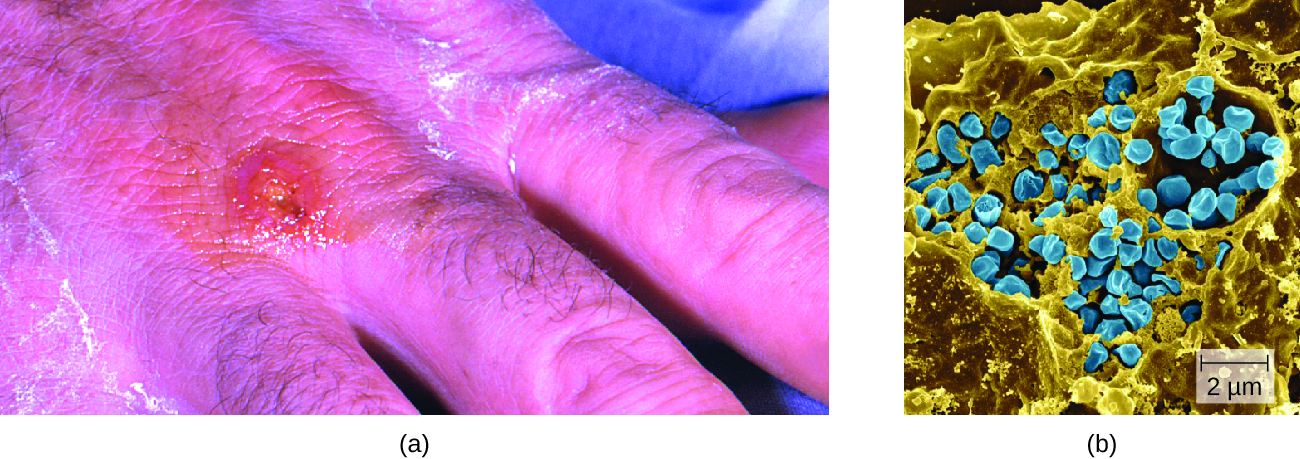
Прямий діагноз туляремії є складним завданням, оскільки вона настільки заразна. Після встановлення передбачуваного діагнозу туляремії потрібно спеціальне поводження для збору та обробки зразків пацієнтів для запобігання зараженню медичних працівників. Зразки, підозрювані в містять F. tularensis, можуть оброблятися лише лабораторіями BSL-2 або BSL-3, зареєстрованими в Федеральній програмі Select Agent, а особи, які обробляють зразок, повинні носити захисні засоби та використовувати кабінет біологічної безпеки класу II.
Туляремія зустрічається відносно рідко в США, і її ознаки та симптоми схожі з безліччю інших інфекцій, які, можливо, доведеться виключити, перш ніж поставити діагноз. Пряме мікроскопічне дослідження флуоресцентно-антитіл (ДФА) з використанням антитіл, специфічних для F. tularensis, дозволяє швидко підтвердити наявність цього збудника. Вирощування цього мікроба важко через його потребу в амінокислоті цистеїну, яка повинна поставлятися як додаткова поживна речовина в культурних середовищах. Серологічні тести доступні для виявлення імунної відповіді проти бактеріального збудника. У пацієнтів з підозрою на інфекцію необхідні зразки сироватки гострої та реконвалесцентної фази для підтвердження активної інфекції. Тести на основі ПЛР також можуть бути використані для клінічної ідентифікації прямих зразків з рідин або тканин організму, а також культивованих зразків. У більшості випадків діагностика ґрунтується на клінічних результатах та ймовірних інцидентах впливу бактерії. Антибіотики стрептоміцин, гентаміцин, доксициклін та ципрофлоксацин ефективні при лікуванні туляремії.
Бруцельоз
Види в роду Brucella є грамнегативними факультативними внутрішньоклітинними збудниками, які з'являються у вигляді коккобацил. Кілька видів викликають зоонозні інфекції у тварин та людини, чотири з яких мають значну патогенність людини: B. abortus від великої рогатої худоби та буйволів, B. canis від собак, B. suis від свиней та B. melitensis від кіз, овець та верблюдів. Інфекції цими збудниками називаються бруцельозом, також відомим як хвиляста лихоманка, «середземноморська лихоманка» або «мальтійська лихоманка». Вакцинація тварин зробила бруцельоз рідкісним захворюванням в США, але він все ще поширений в Середземномор'ї, Південній і Центральній Азії, Центральній і Південній Америці, Карибському басейні. Інфекції людини в першу чергу пов'язані з прийомом всередину м'яса або непастеризованих молочних продуктів від заражених тварин. Зараження може відбуватися також при вдиханні бактерій в аерозолі при поводженні з продуктами тваринного походження, або при безпосередньому контакті з шкірними ранами. У США більшість випадків бруцельозу виявляють у осіб з великим впливом потенційно інфікованих тварин (наприклад, працівників бійні, ветеринари).
Двома важливими факторами вірулентності, що виробляються Brucella spp. є уреаза, яка дозволяє потрапляння всередину бактерій уникнути руйнування шлунковою кислотою, і ліпополісахарид (ЛПС), який дозволяє бактеріям виживати всередині фагоцитів. Після отримання потрапляння в тканини бактерії фагоцитуються нейтрофілами господаря і макрофагами. Потім бактерії рятуються з фагосоми і ростуть всередині цитоплазми клітини. Бактерії, фагоцитарні макрофагами, поширюються по всьому організму. Це призводить до утворення гранульоми в межах багатьох ділянок тіла, включаючи кістки, печінку, селезінку, легені, сечостатеві шляхи, мозок, серце, очі та шкіру. Гострі інфекції можуть призвести до хвилястої (рецидивуючої) лихоманки, але неліковані інфекції переростають у хронічне захворювання, яке зазвичай проявляється як гостре гарячкове захворювання (лихоманка 40—41° C [104—105.8° F]) з повторюваними грипоподібними ознаками та симптомами.
Бруцела надійно виявляється в крові лише під час стадії гострої лихоманки; її важко діагностувати шляхом культивування. Крім того, Бруцелла вважається збудником BSL-3 і небезпечна для обробки в клінічній лабораторії без захисного одягу та принаймні шафи біологічної безпеки класу II. Аглютинаційні тести найчастіше використовуються для серодіагностики. Крім того, для визначення впливу на організм доступні імуноферментні аналізи (ІФА). Антибіотики доксициклін або ципрофлоксацин зазвичай призначаються в комбінації з рифампіном; гентаміцин, стрептоміцин та триметоприм-сульфаметоксазол (ТМП-СМЗ) також ефективні проти бруцеллових інфекцій і можуть бути використані при необхідності.
Вправа\(\PageIndex{5}\)
Порівняйте патогенез туляремії і бруцельозу.
Захворювання котячих подряпин
Зоонозна хвороба котячих подряпин (ХСД) (або лихоманка котячих подряпин) - це бактеріальна інфекція, яка може бути занесена в лімфатичні вузли при укусі або подряпанні кішкою людини. Викликається факультативною внутрішньоклітинної грамнегативною бактерією Bartonella henselae. Кішки можуть заразитися від фекалій бліх, що містить B. henselae, який вони ковтають під час догляду. Люди заражаються, коли в місці укусу або подряпини вводяться фекалії бліх або котячої слини (від кігтів або облизування), що містять B. henselae. Після введення в рану B. henselae заражає еритроцити.
B. henselae інвазії еритроцитів сприяють адгезини, пов'язані з білками зовнішньої мембрани, і системою секреції, яка опосередковує транспорт факторів вірулентності в клітину-господаря. Свідчення про зараження показані, якщо в місці подряпини утворюється невеликий вузлик з гноєм через 1 - 3 тижні після початкової травми. Потім бактерії мігрують до найближчих лімфатичних вузлів, де викликають набряк і біль. Ознаки та симптоми можуть також включати лихоманку, озноб та втому. Більшість інфекцій легкі і, як правило, самообмежуються. Однак у пацієнтів з ослабленим імунітетом може розвинутися бацилярний ангіоматоз (БА), що характеризується проліферацією кровоносних судин, в результаті чого утворюються пухлиноподібні маси в шкірі і внутрішніх органах; або бацилярний пеліоз (АТ), що характеризується множинними кістоподібними, заповненими кров'ю порожнинами в печінці і селезінка. Більшість випадків ХСД можна запобігти, утримуючи кішок від бліх і своєчасно очистивши котячу подряпину милом і теплою водою.
Діагноз ХСД складний, оскільки бактерія не росте легко в лабораторії. При необхідності для ідентифікації видів бактерій можуть бути проведені імунофлюоресценція, серологічні тести, ПЛР та секвенування генів. З огляду на обмежений характер цих інфекцій, антибіотики в нормі не призначаються. Для пацієнтів з ослабленим імунітетом рифампін, азитроміцин, ципрофлоксацин, гентаміцин (внутрішньом'язово) або ТМП-СМЗ, як правило, є найбільш ефективними варіантами.
Лихоманка укусу щура
Лихоманка укусу щура зоонозної інфекції може бути викликана двома різними грамнегативними бактеріями: Streptobacillus moniliformis, яка частіше зустрічається в Північній Америці, та Spirillum minor, яка частіше зустрічається в Азії. Через сучасні зусилля з санітарії укуси щурів рідкісні в США. Однак контакт з фомітами, їжею або водою, забрудненими фекаліями щурів або рідинами організму, також може спричинити інфекції. Ознаки та симптоми лихоманки укусу щура включають лихоманку, блювоту, біль у м'язах (біль у м'язах), біль у суглобах (біль у суглобах) та макулопапульозний висип на руках і ногах. Також в місці укусу може утворитися виразка разом з деяким набряком прилеглих лімфатичних вузлів. У більшості випадків інфекція самообмежується. Про фактори вірулентності, які сприяють цим ознакам і симптомам захворювання, відомо мало.
Культура клітин, мас-спектрометрія MALDI-TOF, ПЛР або ІФА можуть бути використані для ідентифікації Streptobacillus moniliformis. Діагноз Spirillum minor може бути підтверджений прямим мікроскопічним спостереженням збудників у крові за допомогою плям Гімса або Райта або мікроскопії темного поля. Серологічні тести можуть бути використані для виявлення імунної відповіді господаря на збудники приблизно через 10 днів. Найбільш часто використовуваними антибіотиками для лікування цих інфекцій є пеніцилін або доксициклін.
Чума
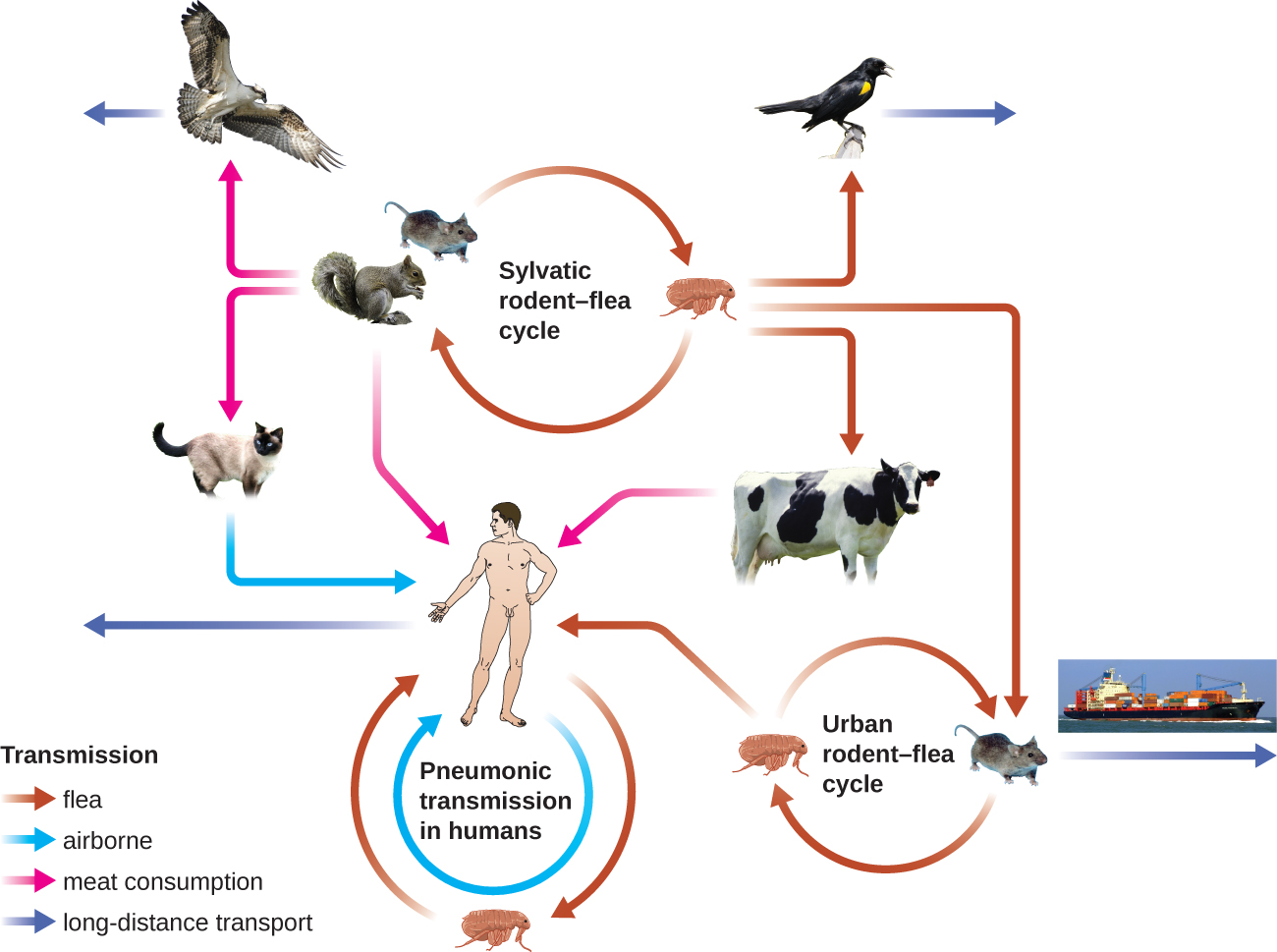
Грамнегативна паличка Yersinia pestis викликає чуму зоонозної інфекції. Ця бактерія викликає гостре гарячкове захворювання у тварин, як правило, гризунів або інших дрібних ссавців, і людини. Захворювання пов'язане з високим рівнем смертності, якщо його не лікувати. Історично Y. pestis був відповідальним за кілька руйнівних пандемій, що призвело до мільйонів смертей (див. Мікрозв'язки: Історія чуми). Існує три форми чуми: бубонна чума (найпоширеніша форма, що становить близько 80% випадків), легенева чума та септицемічна чума. Ці форми диференціюються за способом передачі і початковим місцем зараження. Малюнок\(\PageIndex{4}\) ілюструє ці різні способи передачі та зараження між тваринами та людьми.
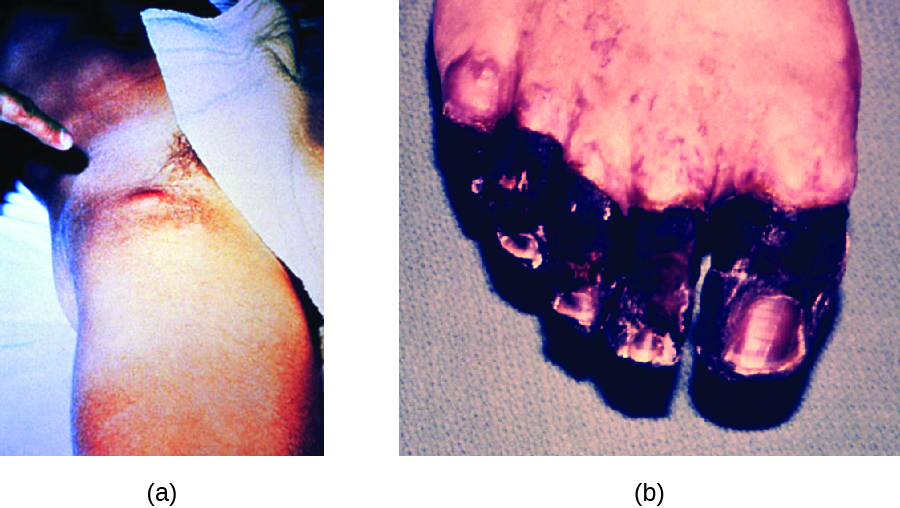
При бубонної чумі Y. pestis переноситься укусом заражених бліх. Оскільки більшість укусів бліх відбувається на ногах і щиколотках, Y. pestis часто впроваджується в тканини і кровообіг в нижніх кінцівках. Після інкубаційного періоду від 2 до 6 днів у пацієнтів спостерігається різка лихоманка (39,5—41° C [103,1—105,8° F]), головний біль, гіпотонія та озноб. Збудник локалізується в лімфатичних вузлах, де викликає запалення, набряк і крововилив, в результаті чого з'являються фіолетові бубони (рис.\(\PageIndex{5}\)). Бубої часто утворюються в лімфатичних вузлах паху спочатку тому, що це вузли, пов'язані з нижніми кінцівками; врешті-решт, через циркуляцію крові та лімфи, лімфатичні вузли по всьому тілу інфікуються і утворюють бубони. Середній рівень смертності від бубонної чуми становить близько 55% при відсутності лікування та близько 10% при лікуванні антибіотиками.
Септицемічна чума виникає, коли Y. pestis безпосередньо впроваджується в кров через поріз або рану і циркулює по тілу. Інкубаційний період септицемічної чуми становить від 1 до 3 днів, після чого у пацієнтів розвивається лихоманка, озноб, крайня слабкість, біль у животі, шок. Також може відбуватися дисеміноване внутрішньосудинне згортання (ДВС-синдром), в результаті чого утворюються тромби, які перешкоджають кровоносним судинам і сприяють ішемії і некрозу в навколишніх тканині (рис.\(\PageIndex{5}\)). Некроз найчастіше виникає в кінцівках, таких як пальці рук і ніг, які почорніють. Септична чума може швидко призвести до смерті, при цьому рівень смертності близько 100%, коли її не лікувати. Навіть при лікуванні антибіотиками смертність становить близько 50%.
Пневмонічна чума виникає, коли Y. pestis викликає інфекцію легенів. Це може відбуватися при вдиханні аерозольних крапель від інфікованої людини або коли інфекція поширюється на легені з інших місць тіла у пацієнтів з бубонної або септицемічної чумою. Після інкубаційного періоду від 1 до 3 днів ознаки та симптоми включають лихоманку, головний біль, слабкість та швидко розвивається пневмонію із задишкою, болем у грудях та кашлем, що виробляє кров'янисту або водянисту слиз. Пневмонія може призвести до швидкої дихальної недостатності та шоку. Пневмонічна чума - єдина форма чуми, яка може поширюватися від людини до людини інфекційною аерозольною крапелькою. При відсутності лікування смертність близько 100%; при лікуванні антибіотиками смертність становить близько 50%.
Високий рівень смертності від чуми частково є наслідком того, що вона надзвичайно добре оснащена факторами вірулентності. На сьогоднішній день існує щонайменше 15 різних основних факторів вірулентності, які були ідентифіковані з Y. pestis, і з них вісім беруть участь у прихильності до клітин господаря. Крім того, компонент F1 капсули Y. pestis є фактором вірулентності, що дозволяє бактерії уникнути фагоцитозу. F1 виробляється у великих кількостях під час зараження ссавців і є найбільш імуногенним компонентом. 11 Успішне використання факторів вірулентності дозволяє бацилам поширюватися з області укусу в регіонарні лімфатичні вузли і в кінцевому підсумку всю кров'яну і лімфатичну системи.
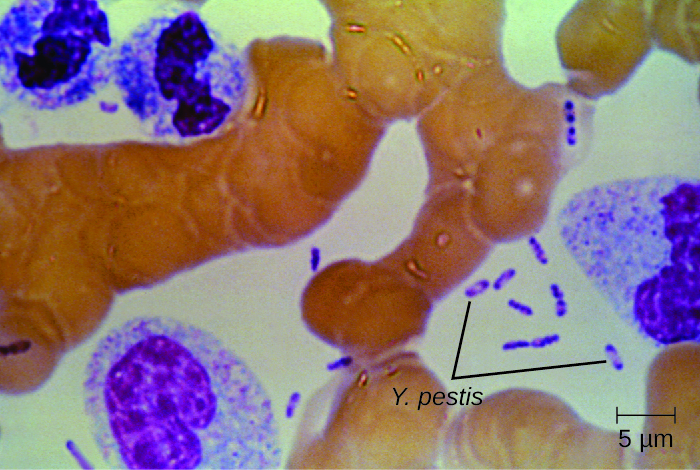
Культивування та пряме мікроскопічне дослідження зразка рідини з бубо, крові або мокротиння - найкращий спосіб ідентифікувати Y. pestis та підтвердити передбачуваний діагноз чуми. Зразки можуть бути забарвлені за допомогою техніки фарбування Грама, Гімса, Райта або Вейсона (рис.\(\PageIndex{6}\)). Бактерії демонструють характерний біполярний малюнок фарбування, що нагадує шпильки, що полегшує передбачувану ідентифікацію. Для підтвердження діагнозу можуть бути використані прямі флуоресцентні тести на антитіла (експрес-тест антигенів зовнішньої мембрани) та серологічні тести, такі як ІФА. Підтверджуючим методом ідентифікації ізолятів Y. pestis в США є лізис бактеріофагів.
Оперативна антибіотикотерапія може вирішити більшість випадків бубонної чуми, але септицемічну та легеневу чуму важче піддаються лікуванню через їх більш короткі інкубаційні стадії. Виживання часто залежить від раннього і точного діагнозу і відповідного вибору антибіотикотерапії. У США найпоширенішими антибіотиками, що застосовуються для лікування пацієнтів з чумою, є гентаміцин, фторхінолони, стрептоміцин, левофлоксацин, ципрофлоксацин та доксициклін.
Вправа\(\PageIndex{6}\)
Порівняйте бубонну чуму, септицемічну чуму та легеневу чуму.
Перша зафіксована пандемія чуми, чума Юстиніана, сталася в шостому столітті нашої ери. Вважається, що він зародився в Центральній Африці і поширився до Середземного моря торговими шляхами. На піку свого піку в одному лише Константинополі за добу гинуло понад 5 тисяч осіб. Зрештою, третина населення цього міста піддалася чумі. 12 Вплив цього спалаху, ймовірно, сприяв пізнішому падінню імператора Юстиніана.
Друга велика пандемія, яка отримала назву Чорна смерть, сталася протягом 14 століття. Цього разу вважається, що інфекції виникли десь в Азії, перш ніж їх перевезли до Європи торгівлею, солдатами та військовими біженцями. Цей спалах вбив приблизно чверть населення Європи (25 мільйонів, насамперед у великих містах). Крім того, принаймні ще 25 мільйонів, як вважають, були вбиті в Азії та Африці. 13 Ця друга пандемія, пов'язана зі штамом Yersinia pestis biovar Medievalis, тривала ще 300 років у Європі та Великобританії, а в 1660-х роках називалася Великою чумою.
Найновіша пандемія сталася в 1890-х роках з Yersinia pestis biovar Orientalis. Цей спалах виник у провінції Юньнань Китаю і поширився по всьому світу через торгівлю. Саме в цей час чума пробралася в США. Етіологічний збудник чуми був виявлений Олександром Єрсіном (1863—1943) також під час цього спалаху. Загальна кількість смертей була нижчою, ніж у попередніх спалахах, можливо, через поліпшення санітарії та медичної підтримки. 14 Більшість смертей, пов'язаних з цією остаточною пандемією, сталися в Індії.
Відвідайте це посилання, щоб побачити статтю, яка описує, наскільки геном бактерії Чорної Смерті схожий на сьогоднішні штами бубонної чуми.
Зоонозні фебрильні захворювання
Найрізноманітніші зоонозні фебрильні захворювання (захворювання, що викликають лихоманку) викликаються хвороботворними бактеріями, яким потрібні членистоногі переносники. Цими збудниками є або облігатні внутрішньоклітинні види Анаплазма, Бартонелла, Ерліхія, Орієнтія і Рікетсія, або спірохети в роду Borrelia. Виділення та ідентифікація патогенів цієї групи найкраще проводити в лабораторіях BSL-3 через низьку інфекційну дозу, пов'язану із захворюваннями.
Анаплазмоз
Зоонозна кліщова хвороба гранулоцитарний анаплазмоз людини (HGA) викликається облігатним внутрішньоклітинним збудником Anaplasma phagocytophilum. HGA є ендемічним в основному в центральній і північно-східній частині США, а також в країнах Європи та Азії.
HGA, як правило, є легким гарячковим захворюванням, яке викликає грипоподібні симптоми у імунокомпетентних пацієнтів; однак симптоми досить важкі, щоб вимагати госпіталізації щонайменше у 50% інфекцій, і з цих пацієнтів менше 1% помре від HGA. 15 Дрібних ссавців, таких як білоногі миші, бурундуки та полівки, були ідентифіковані як резервуари A. phagocytophilum, який передається укусом іксодового кліща. П'ять основних факторів вірулентності 16 було зареєстровано в Анаплазмі; три - фактори прихильності, а два - фактори, які дозволяють збуднику уникнути імунної відповіді людини. Діагностичні підходи включають виявлення внутрішньоклітинних мікроколоній Анаплазми шляхом мікроскопічного дослідження нейтрофілів або еозинофілів, забарвлених плямою Гімса або Райта, ПЛР для виявлення A. phagocytophilum та серологічні тести для виявлення титрів антитіл проти збудників. Первинним антибіотиком, який використовується для лікування, є доксициклін.
Ерліхіоз
Моноцитотропний ерліхіоз людини (HME) - зоонозне кліщове захворювання, спричинене BSL-2, облігатним внутрішньоклітинним збудником Ehrlichia chaffeensis. В даний час географічне поширення HME - це насамперед східна половина США, причому кілька випадків зареєстровано на Заході, що відповідає відомому географічному розподілу первинного вектора, самотнього зіркового кліща (Amblyomma americanum). Симптоми ГМО схожі на грипоподібні симптоми, що спостерігаються при анаплазмозі, але висип зустрічається частіше, причому у 60% дітей і менше 30% дорослих розвиваються петехіальні, макулопапульозні висипання. 17 Фактори вірулентності дозволяють E. chaffeensis прилипати і інфікувати моноцити, утворюючи внутрішньоклітинні мікроколонії в моноцитах, які є діагностичними для ГМО. Діагноз HME може бути підтверджений за допомогою ПЛР та серологічних тестів. Лікування першої лінії для дорослих і дітей різного віку з HME - доксициклін.
епідемічний висипний тиф
Захворювання епідемічний тиф викликається Rickettsia prowazekii і передається тілесними вошами, Pediculus humanus. Літаючі білки є резервуарами тварин R. prowazekii в Північній Америці, а також можуть бути джерелами вошей, здатних передавати збудника. Епідемічний тиф характеризується високою температурою і болями в тілі, які тривають близько 2 тижнів. Висип розвивається на животі і грудях і іррадіює в кінцівки. Важкі випадки можуть призвести до смерті від шоку або пошкодження тканин серця і мозку. Заражені люди є важливим резервуаром для цієї бактерії, оскільки R. prowazekii є єдиною рикетсією, яка може встановити хронічний стан носія у людини.
Епідемічний тиф зіграв важливу роль в історії людства, викликаючи великі спалахи з високим рівнем смертності під час війни або негараздів. Під час Першої світової війни епідемічний висипний тиф вбив понад 3 мільйони людей на Східному фронті. 18 З появою ефективних інсектицидів і поліпшеною особистою гігієною епідемічний тиф зараз зустрічається досить рідко в США. Однак у країнах, що розвиваються, епідемії можуть призвести до смертності до 40% за відсутності лікування. 19 Останніми роками більшість спалахів відбулося в Бурунді, Ефіопії та Руанді. Наприклад, спалах у таборах біженців Бурунді в 1997 році призвів до 45 000 захворювань серед населення близько 760 000 осіб. 20
Швидка діагностика утруднена через схожість первинних симптомів з симптомами багатьох інших захворювань. Молекулярні та імуногістохімічні діагностичні тести є найбільш корисними методами встановлення діагнозу під час гострої стадії хвороби, коли терапевтичні рішення є критичними. ПЛР для виявлення відмінних генів з R. prowazekii може бути використана для підтвердження діагнозу епідемічного тифу поряд з імунофлюоресцентним фарбуванням зразків біопсії тканин. Серологію зазвичай використовують для виявлення рикетсіальних інфекцій. Однак адекватні титри антитіл займають до 10 днів для розвитку. Антибактеріальну терапію зазвичай починають до завершення діагностики. Найпоширенішими препаратами, що застосовуються для лікування пацієнтів з епідемічним тифом, є доксициклін або хлорамфенікол.
Мишачий (ендемічний) Тиф
Мишачий тиф (також відомий як ендемічний тиф) викликається Rickettsia typhi і передається укусом щурячої блохи, Xenopsylla cheopis, з інфікованими щурами в якості основного резервуара. Клінічні ознаки і симптоми мишачого тифувключають висип і озноб, що супроводжуються головним болем і лихоманкою, які тривають близько 12 днів. Деякі пацієнти також проявляють кашель і пневмонію, схожі на симптоми. Важке захворювання може розвиватися у пацієнтів з ослабленим імунітетом, з судомами, комою, нирковою та дихальною недостатністю.
Клінічний діагноз мишачого тифу може бути підтверджений за зразком біопсії з висипу. Діагностичні тести включають фарбування непрямими імунофлюоресцентними антитілами (IFA), ПЛР на R. typhi та гострий та реконвалесцентний серологічний аналіз. Первинне лікування - доксициклін, другий вибір - хлорамфенікол.
Скелясті гори плямиста лихо
Хвороба плямиста лихоманка Скелястих гір (RMSF) викликається Rickettsia rickettsii і передається укусом твердотілого кліща, такого як американський собачий кліщ (Dermacentor variabilis), деревний кліщ Скелястих гір (D. andersoni) або коричневий собачий кліщ ( Рипіцефал сангвінеус).
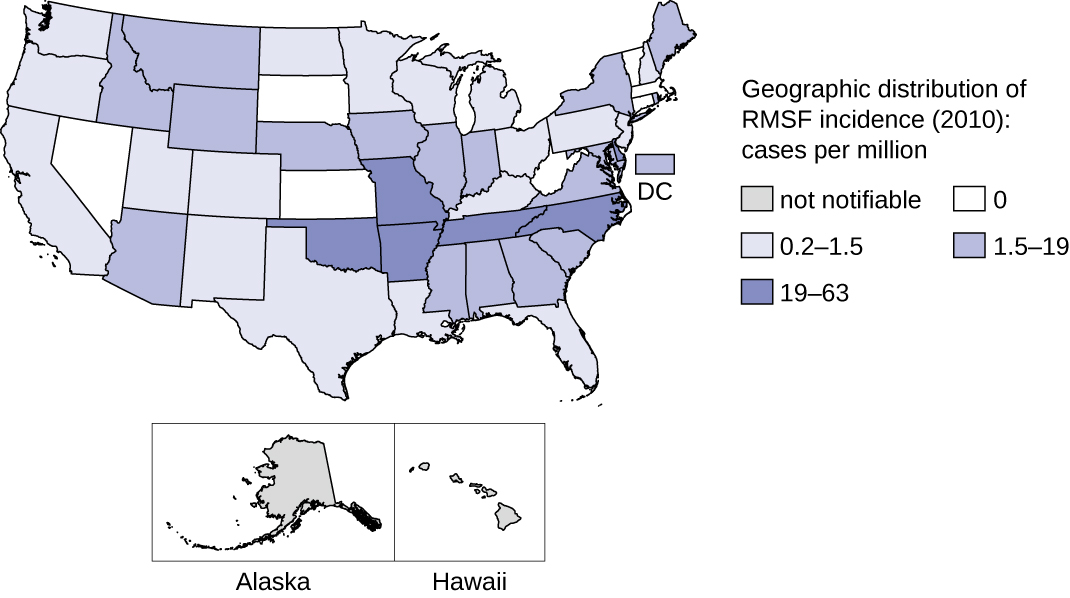
Це захворювання є ендемічним в Північній і Південній Америці, і його захворюваність збігається з діапазоном переносників членистоногих. Незважаючи на свою назву, більшість випадків у США трапляються не в регіоні Скелястих гір, а на південному сході; Північна Кароліна, Оклахома, Арканзас, Теннессі та Міссурі становлять понад 60% усіх випадків. 21 Карта на малюнку\(\PageIndex{7}\) показує розподіл поширеності в США в 2010 році.
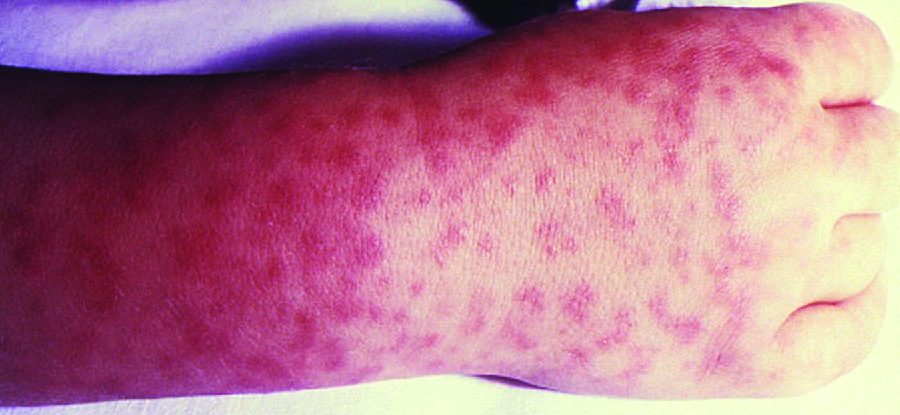
Ознаки та симптоми RMSF включають високу температуру, головний біль, болі в тілі, нудоту та блювоту. Петехіальна висип (схожа за зовнішнім виглядом на кір) починається на руках і зап'ястях, і поширюється на тулуб, обличчя, кінцівки (рис.\(\PageIndex{8}\)). Якщо не лікувати, RMSF є серйозним захворюванням, яке може призвести до летального результату в перші 8 днів навіть у інших здорових пацієнтів. В ідеалі лікування слід починати до розвитку петехій, оскільки це ознака прогресування до важкого захворювання; однак висип зазвичай з'являється лише на 6 день або пізніше після появи симптомів і виникає лише у 35% - 60% пацієнтів з інфекцією. Підвищена проникність судин, пов'язана з утворенням петехій, може призвести до летальності 3% або більше, навіть за наявності клінічної підтримки. Більшість смертей обумовлені гіпотонією та зупинкою серця або ішемією після згортання крові.
Діагностика може бути складною, оскільки хвороба імітує кілька інших захворювань, які є більш поширеними. Діагноз RMSF ставиться на основі симптомів, флуоресцентного фарбування антитіл зразка біопсії з висипу, ПЛР для рикетсії рикетсії та гострого та реконвалесцентного серологічного тестування. Первинне лікування - доксициклін, другий вибір - хлорамфенікол.
Хвороба Лайма
Хвороба Лайма викликається спірохета Borrelia burgdorferi, яка передається укусом твердого чорноногого кліща Ixodes. I. scapularis - біологічний вектор, що передає B. burgdorferi в східній і північно-центральній частині США і I. pacificus передає B. burgdorferi в західній частині США (рис.\(\PageIndex{10}\)). Різні види кліщів Ixodes відповідають за передачу B. burgdorferi в Азії та Європі. У США хвороба Лайма є найбільш часто зареєстрованим переносним захворюванням. У 2014 році це була п'ята найпоширеніша національна хвороба. 22
Іксодові кліщі мають складні життєві цикли і в якості водойм можуть виступати олені, миші, і навіть птахи. За 2 роки кліщі проходять чотири стадії розвитку і вимагають кров'яної їжі від господаря на кожному етапі. Навесні з яєць кліщів вилуплюються шестиногими личинками. Ці личинки спочатку не переносять B. burgdorferi. Вони можуть придбати спірохету, коли вони приймають першу кров'яну їжу (як правило, від миші). Потім личинки зимують і линяють у восьминогих німф наступної весни. Німфи приймають кров'яну їжу в першу чергу від дрібних гризунів, але можуть харчуватися і людьми, зариваючись в шкіру. Період годування може тривати від декількох днів до тижня, і, як правило, для зараженої німфи потрібно 24 години, щоб передати достатньо B. burgdorferi, щоб викликати інфекцію у господаря людини. Німфи в кінцевому підсумку дозрівають у дорослих кліщів чоловічої та жіночої статі, які, як правило, харчуються більшими тваринами, такими як олені або, іноді, люди. Потім дорослі особини спаровуються і виробляють яйцеклітини для продовження циклу (рис.\(\PageIndex{9}\)).
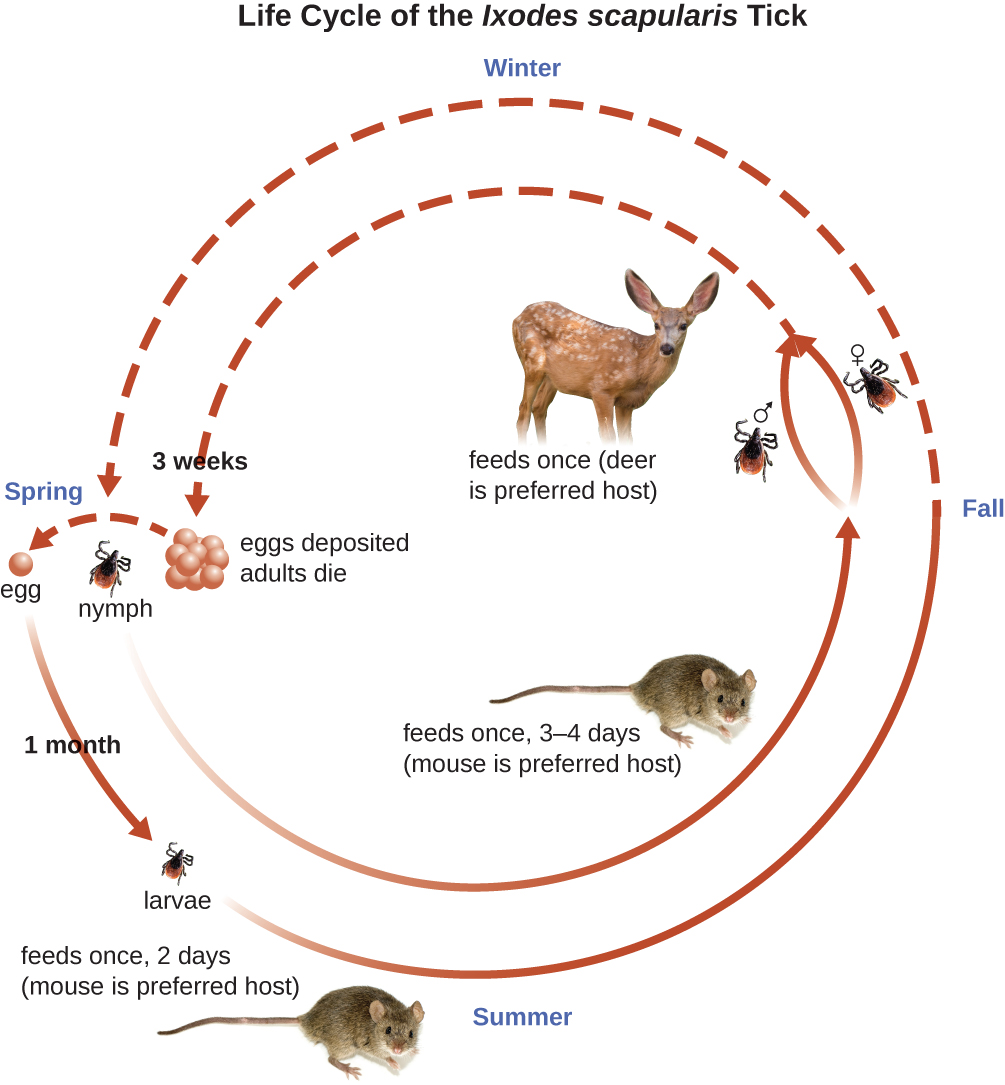
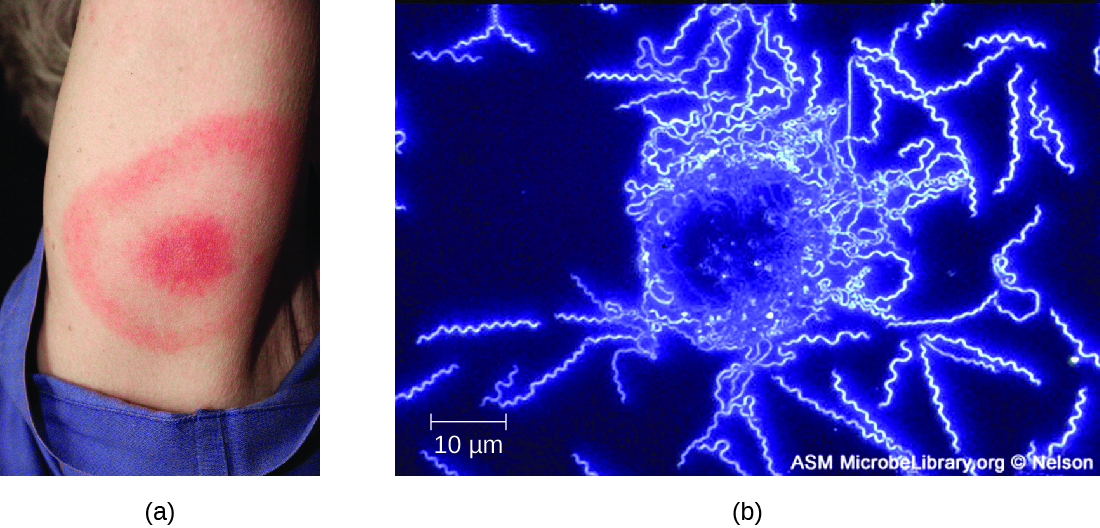
Симптоми хвороби Лайма слідують за трьома стадіями: ранньою локалізованою, ранньою дисемінованою та пізньою стадією. Під час ранньо-локалізованої стадії приблизно в 70% — 80% 23% випадків може характеризуватися висипом бичачого ока, званої еритемою мігранс, в місці початкового укусу кліща. Висип утворюється через 3 - 30 днів після укусу кліща (7 днів - середнє значення) і також може бути теплою на дотик (рис.\(\PageIndex{10}\)). 24 Цей діагностичний ознака часто не помічається, якщо укус кліща відбувається на волосистій частині голови або іншому менш помітному місці. Інші ранні симптоми включають грипоподібні симптоми, такі як нездужання, головний біль, лихоманка та жорсткість м'язів. Якщо пацієнт не лікується, друга ранньо-дисемінована стадія захворювання настає через дні - тижні. Симптоми на цьому етапі можуть включати сильний головний біль, скутість шиї, параліч обличчя, артрит та кардит. Пізні стадії прояви захворювання можуть виникати через роки після впливу. Хронічне запалення викликає пошкодження, які з часом можуть спричинити важкий артрит, менінгіт, енцефаліт та змінені психічні стани. Захворювання може призвести до летального результату, якщо не лікувати.
Передбачуваний діагноз хвороби Лайма може бути поставлений виключно на підставі наявності яблучної висипки на місці зараження, якщо вона присутня, крім інших супутніх симптомів (рис.\(\PageIndex{10}\)). Крім того, непряме маркування імунофлюоресцентних антитіл (IFA) може використовуватися для візуалізації бактерій із зразків біопсії крові або шкіри. Серологічні тести, такі як ІФА, також можуть використовуватися для виявлення сироваткових антитіл, що виробляються у відповідь на інфекцію. Під час ранньої стадії зараження (близько 30 днів) ефективні антибактеріальні препарати, такі як амоксицилін і доксициклін. На пізніх стадіях внутрішньовенно можна вводити пеніцилін G, хлорамфенікол або цефтриаксон.
Рецидивуюча лихоманка
Borrelia spp. також може викликати рецидивуючу лихоманку. Два найпоширеніші види - B. recurrentis, який викликає епідемії рецидивуючої лихоманки, та B. hermsii, що викликає кліщові рецидивні лихоманки. Ці види Borrelia передаються тілесною вошею Pediculus humanus і м'якотілим кліщем Ornithodoros hermsi відповідно. Воші набувають спірохети з людських водойм, тоді як кліщі набувають їх з водойм гризунів. Спірохети заражають людей, коли боррелії в слині або виділеннях переносника швидко потрапляють в шкіру, коли вектор кусає.
Як у вошей, так і при кліщовій рецидивуючій лихоманці бактеріємія зазвичай виникає після початкового впливу, що призводить до раптової високої температури (39—43° C [102,2—109.4° F), як правило, супроводжується головним болем та м'язовими болями. Приблизно через 3 дні ці симптоми зазвичай стихають, лише щоб повернутися знову приблизно через тиждень. Ще через 3 дні симптоми знову стихають, але повертаються через тиждень, і цей цикл може повторитися кілька разів, якщо його не порушить лікування антибіотиками. Імунне ухилення через бактеріальну антигенну варіацію відповідає за циклічність симптомів при цих захворюваннях.
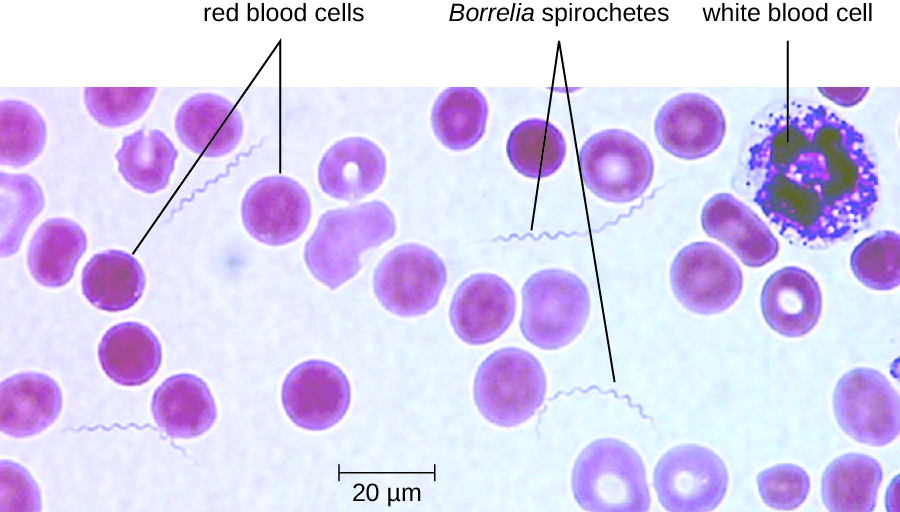
Діагноз рецидивуючої лихоманки може бути поставлений шляхом спостереження спірохет в крові, за допомогою темнопольової мікроскопії (рис.\(\PageIndex{11}\)). Для воші рецидивуючої лихоманки доксициклін або еритроміцин є антибіотиками першої лінії. Для кліщової рецидивуючої лихоманки тетрациклін або еритроміцин є антибіотиками першої лінії.
Траншейна лихоманка
Хвороба траншеї лихоманка вперше була охарактеризована як специфічне захворювання під час Першої світової війни, коли було заражено приблизно 1 мільйон солдатів. Сьогодні це в першу чергу обмежується районами світу, що розвиваються, де погана санітарія та гігієна призводять до зараження вошами (наприклад, перенаселені міські райони та табори біженців). Траншейна лихоманка викликана грамнегативною бактерією Bartonella quintana, яка передається, коли кал від інфікованих вошей, Pediculus humanus var corporis, втирається в укус воші, потерту шкіру або кон'юнктиву. Симптоми зазвичай слідують 5-денний курс, який відзначається високою температурою, болями в тілі, кон'юнктивітом, очним болем, сильними головними болями та сильними болями в кістках у гомілках, шиї та спині. Діагноз можна поставити за допомогою посівів крові; серологічні тести, такі як ІФА, можуть бути використані для виявлення титрів антитіл до збудника, а також може використовуватися ПЛР. Антибіотики першого ряду - доксициклін, макролідні антибіотики та цефтріаксон.
Вправа\(\PageIndex{7}\)
- З яким переносником пов'язаний епідемічний висипний тиф?
- Опишіть життєвий цикл оленячого кліща і як він поширює хворобу Лайма.
Поради щодо галочок
Багато захворювань, розглянуті в цьому розділі, стосуються членистоногих переносників. З них кліщі, ймовірно, найбільш часто зустрічаються в США. Дорослі кліщі мають вісім ніг і два сегменти тіла, головогрудь і головку (рис.\(\PageIndex{12}\)). Зазвичай вони коливаються від 2 мм до 4 мм в довжину і харчуються кров'ю господаря, прикріплюючись до шкіри.
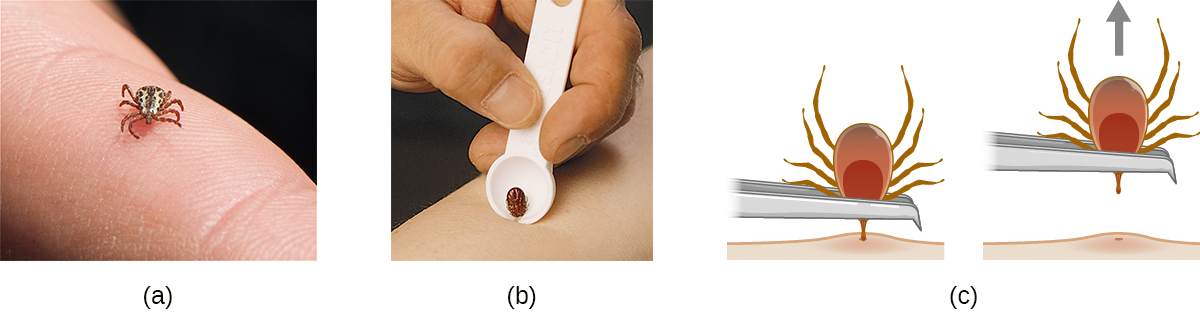
Неприкріплені кліщі слід видаляти і ліквідувати, як тільки вони будуть виявлені. Видаляючи кліща, який вже прикріпився, пам'ятайте про наступні рекомендації, щоб зменшити шанси на вплив хвороботворних мікроорганізмів:
- Тупим пінцетом акуратно потягніть біля місця кріплення до тих пір, поки кліщ не звільнить свою фіксацію на шкірі.
- Уникайте розчавлювання тіла кліща і не обробляйте кліща голими пальцями. Це може вивільнити бактеріальні патогени і фактично збільшити ваш вплив. Кліща можна вбити, втопивши у воді або спирті, або заморозити, якщо він може знадобитися пізніше для виявлення та аналізу.
- Ретельно продезінфікуйте ділянку, промазавши таким антисептиком, як ізопропанол.
- Стежити за місцем укусу на наявність висипань або інших ознак інфекції.
Багато непродумані домашні засоби для видалення кліщів стали популярними в останні роки, які поширюються соціальними медіа та псевдожурналістикою. Медичні працівники повинні перешкоджати пацієнтам вдаватися до будь-якого з наведених нижче методів, які НЕ рекомендуються:
- використовуючи хімічні речовини (наприклад, вазелін або лак для нігтів), щоб вибити прикріпленого кліща, оскільки це може призвести до виділення кліща рідини, що може збільшити ймовірність зараження
- використовуючи гарячі предмети (сірники або недопалки), щоб вибити прикріплену галочку
- здавлювання тіла кліща пальцями або пінцетом
Бактеріальні інфекції кровоносної та лімфатичної систем
Хоча кровоносна система є замкнутою системою, бактерії можуть потрапляти в кров кількома шляхами. Рани, укуси тварин або інші розриви шкіри та слизових оболонок можуть призвести до швидкого поширення бактеріальних збудників по всьому організму. Локалізовані інфекції також можуть поширюватися в кров, викликаючи серйозні і часто смертельні системні інфекції. Малюнок\(\PageIndex{13}\) і малюнок\(\PageIndex{14}\) узагальнюють основні характеристики бактеріальних інфекцій кровоносної та лімфатичної систем.
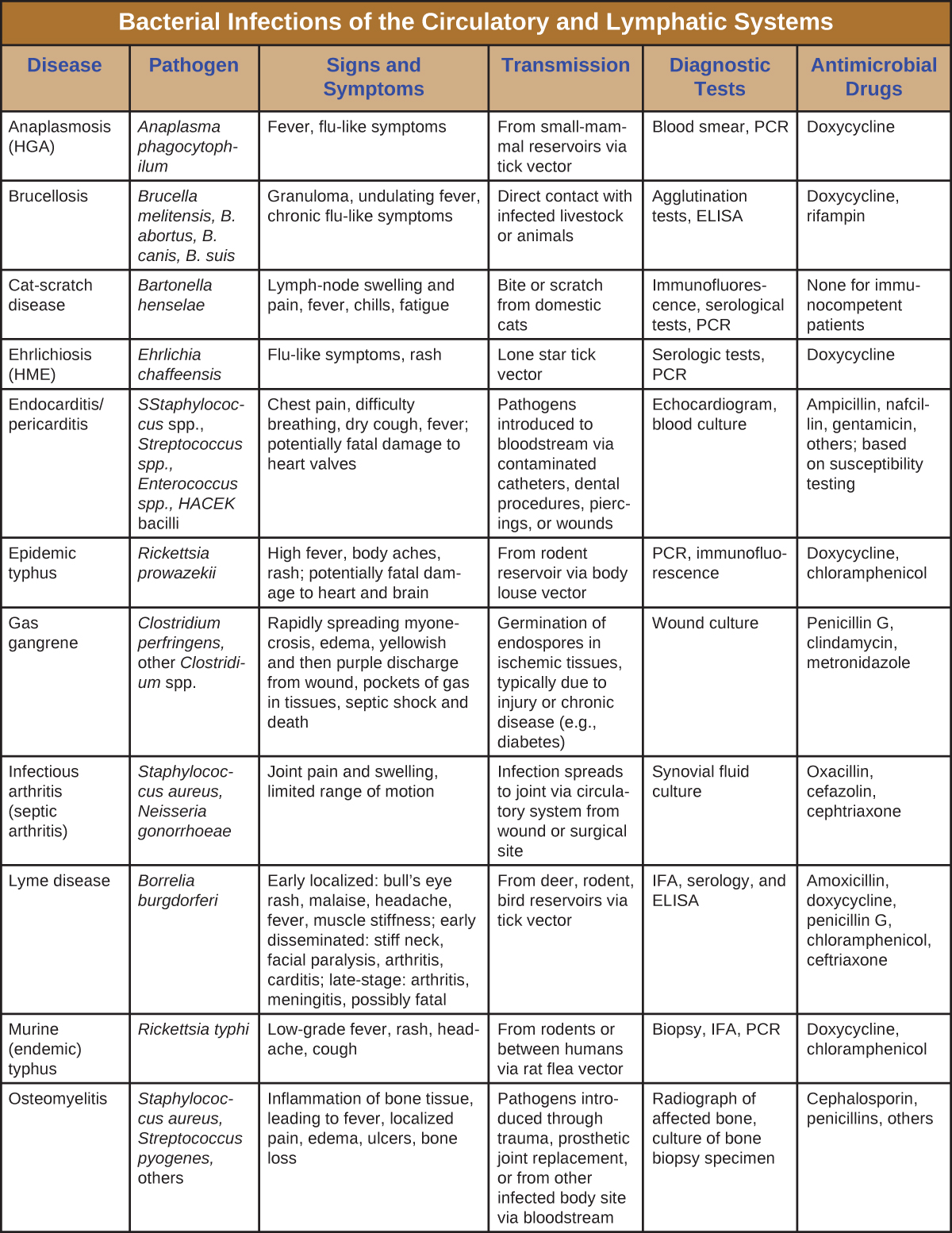
![Таблиця під назвою: Бактеріальні інфекції кровоносної та лімфатичної систем (продовження). Колонки: Хвороба, Збудник, Ознаки та симптоми, Передача, Діагностичні тести, Антимікробні препарати.Чума; Yersinia pestis; Бубонна: бубони, лихоманка, внутрішнє крововилив; септицемія: лихоманка, біль у животі, шок, ДВС-синдром, некроз кінцівок; пневмонічний: гостра пневмонія, дихальна недостатність, шок. Всі форми мають високий рівень смертності. Передається з резервуарів ссавців через переносники бліх або споживання інфікованої тварини; передача легеневої чуми між людьми через дихальні аерозолі; посів бактерій із зразків лімфи, крові або мокротиння; ДФА, ІФА; гентаміцин, фторхінолони та ін. Піродеральний сепсис; Streptococcus pyogenes, багато інших; Швидка лихоманка, шок і смерть; Збудники, що вводяться під час або відразу після пологів; Рана, сеча або аналіз крові; Як визначається тестуванням на сприйнятливість. Лихоманка укусу щура; Streptobacillus moniliformis, Spirillum minor; Лихоманка, біль у м'язах і суглобах, висип, виразка; Укус від зараженого щурів або вплив фекалій щурів або рідин організму в забрудненій їжі або воді; Спостереження організму за зразками та тестами на антитіла; Пеніцилін. Рецидивуюча лихоманка; Borrelia recurrentis, B. hermsii, інші Borrelia spp.; Повторювана лихоманка, головний біль, м'язові болі; Від гризуна або людського резервуара через тілесні воші або кліщовий вектор; Мікроскопія Даркфілда; Доксициклін, тетрациклін, еритроміцин. Ревматична лихоманка; Streptococcus pyogenes; Біль у суглобах і набряк, запалення і рубцювання клапанів серця, шум у серці; наслідки стрептококового фарингіту; Серологія, електрокардіограма, ехокардіограма; Бензатин бензилпеніцилін. Плямиста лихоманка Скелястих гір; Рікетсія рикетсія; Висока температура, головний біль, болі в тілі, нудота і блювота, петехіальний висип; потенційно смертельна гіпотензія та ішемія внаслідок згортання крові; Від резервуара гризунів через вектори кліщів; Біопсія, серологія, ПЛР; Доксициклін, хлорамфенікол. Синдром токсичного шоку (ТСС); золотистий стафілокок; Раптова висока температура, блювота, діарея, гіпотонія, смертьЗбудники від локалізованої інфекції поширюються в кров; збудники, що вводяться на тампони або інші інтравагінальні продукти; Серологія, ідентифікація токсинів з ізолятів; Кліндаміцин, ванкоміцин. Токсичний шокоподібний синдром (STSS); Streptococcus pyogenes; Раптова висока температура, блювота, діарея, гострий респіраторний дистрес-синдром (ГРДС), гіпоксемія, некротичний фасциїт, смерть; наслідки стрептококової шкіри або інфекції м'яких тканин; [ВІДСУТНЯ]; Пеніцилін, цефалоспорин. Траншейна лихоманка; Бартонелла Кінтана; Висока температура, кон'юнктивіт, біль у очах, головні болі, сильний біль у кістках гомілок, шиї та спини; Між людьми через вектор воші тіла; Культура крові, ІФА, ПЛР; Доксициклін, макролідні антибіотики, цефтриаксон. Туляремія (кроляча лихоманка); Francisella tularensis Ураження шкіри, лихоманка, озноб, головний біль, бубони; Вживання або поводження з зараженим кроликом; передача від зараженої тварини за допомогою кліща або мухи вектора; передача аерозолю (в лабораторії або як біозброя); ДФА; Стрептоміцин, гентаміцин та інші.](https://bio.libretexts.org/@api/deki/files/9163/OSC_Microbio_25_02_BactCircDP_Part2.jpg)
Ключові поняття та резюме
- Бактеріальні інфекції кровоносної системи практично повсюдно серйозні. Залишившись без лікування, більшість мають високий рівень смертності.
- Бактеріальні збудники зазвичай вимагають порушення імунного захисту для колонізації кровоносної системи. Найчастіше це включає в себе рану або укус членистоногого переносника, але це може виникати і в умовах стаціонару і закінчитися внутрішньолікарняними інфекціями.
- Сепсис як грамнегативних, так і грампозитивних бактерій, післяпологова лихоманка, ревматична лихоманка, ендокардит, газова гангрена, остеомієліт та синдром токсичного шоку зазвичай є результатом травми або впровадження бактерій медичним або хірургічним втручанням.
- Туляремія, бруцельоз, лихоманка котячих подряпин, щуряча лихоманка та бубонна чума - це зоонозні захворювання, що передаються біологічними переносниками
- Ерліхіоз, анаплазмоз, ендемічний і мишачий тиф, плямиста лихоманка Скелястих гір, хвороба Лайма, рецидивуюча лихоманка і траншейна лихоманка передаються членистоногими переносниками.
- Оскільки їх симптоми настільки схожі з симптомами інших захворювань, багато бактеріальні інфекції кровоносної системи важко діагностувати.
- Стандартні антибіотикотерапії ефективні для лікування більшості бактеріальних інфекцій кровоносної системи, якщо тільки бактерія не стійка, і в цьому випадку може знадобитися синергетичне лікування.
- Системна імунна відповідь на бактеріємію, яка передбачає виділення надмірної кількості цитокінів, іноді може бути більш згубною для господаря, ніж сама інфекція.
Виноски
- 1 С.П. ЛаРоса. «Сепсис». 2010 р. http://www.clevelandclinicmeded.com/...isease/sepsis/.
- 2 DC Ангус, Т. ван дер Poll. «Важкий сепсис і септичний шок». Медичний журнал Нової Англії 369, № 9 (2013) :840—851.
- 3 Центри з контролю та профілактики захворювань. «Синдром токсичного шоку (крім стрептококового) (TSS) 2011 Визначення випадку». https://wwwn.cdc.gov/nndss/condition...finition/2011/. Доступ до 25 липня 2016 року.
- 4 Центри з контролю та профілактики захворювань. «Синдром стрептококового токсичного шоку (STSS) (Streptococcus pyogenes) 2010 Визначення випадку». https://wwwn.cdc.gov/nndss/condition...finition/2010/. Доступ до 25 липня 2016 року.
- 5 M.E. Shirtliff, Мадер JT. «Гострий септичний артрит». Клінічна мікробіологія огляди 15 немає. 4 (2002) :527—544.
- 6 J.R. Манейро та ін. «Предиктори недостатності лікування та смертності при нативному септичному артриті». Клінічна ревматологія 34, № 11 (2015) :1961—1967.
- Васкес 7 М. «Остеомієліт у дітей». Сучасна думка в педіатрії 14, № 1 (2002) :112—115.
- 8 А. Бодуен та співавт. «Гостра ревматична лихоманка та ревматична хвороба серця серед дітей—Американське Самоа, 2011—2012 рр.» Щотижневий звіт про захворюваність та смертність 64 № 20 (2015) :555—558.
- 9 М.А. Гербер та ін. «Профілактика ревматичної лихоманки та діагностика та лікування гострого стрептококового фарингіту: наукова заява Американської асоціації серця з ревматичної лихоманки, ендокардиту та хвороби Кавасакі Комітету Ради з серцево-судинних захворювань у молодих, Міждисциплінарна рада з функціональних Геноміка та трансляційна біологія та Міждисциплінарна рада з якості допомоги та досліджень результатів: схвалено Американською академією педіатрії». Тираж 119, № 11 (2009) :1541—1551.
- 10 Всесвітня організація охорони здоров'я. «Керівні принципи ВООЗ щодо туларемії». 2007 р. http://www.cdc.gov/tularemia/resources/whotularemiamanual.pdf. Доступ до 26 липня 2016 року.
- 11 Ключова лабораторія системної біології патогенів МОЗ. «Фактори вірулентності патогенних бактерій, Yersinia». http://www.mgc.ac.cn/cgi-bin/VFs/gen...Genus=Yersinia. Доступ до 9 вересня 2016 року.
- 12 Розен, Вільям. Блоха Юстиніана: чума, імперія та народження Європи. Вікінг для дорослих; сторінка 3; ISBN 978-0-670-03855-8.
- 13 Бенедиктоу, Оле Дж. 2004. Чорна смерть 1346-1353: повна історія. Вудбрідж: Прес Бойделла.
- 14 Центрів контролю та профілактики захворювань. «Чума: Історія». http://www.cdc.gov/plague/history/. Доступ до 15 вересня 2016 року.
- 15 Дж.С. Баккен та ін. «Діагностика та лікування кліщових рикетсіальних захворювань: плямиста лихоманка Скелястих гір, ерліхіози та анаплазмоз - США. Практичний посібник для лікарів та інших працівників охорони здоров'я та охорони здоров'я». Рекомендації та звіти MMWR 55 немає. СР04 (2006) :1—27.
- 16 Ключова лабораторія системної біології патогенних мікроорганізмів МОЗ, «Фактори вірулентності патогенних бактерій, анаплазма» 2016. http://www.mgc.ac.cn/cgi-bin/VFs/jsif/main.cgi. Доступ до 26 липня 2016 року.
- 17 Центрів контролю та профілактики захворювань. «Ерліхіоз, симптоми, діагностика та лікування» 2016 р. https://www.cdc.gov/ehrlichiosis/symptoms/index.html. Доступ до 29 липня 2016 року.
- 18 Дралі, Р., Брукі, П. і Раулт, Д. «Тиф у Першій світовій війні» Мікробіологія Сьогодні 41 (2014) 2:58 —61.
- 19 Центрів контролю та профілактики захворювань. Інформація про здоров'я CDC для міжнародних подорожей 2014: Жовта книга. Преса Оксфордського університету, 2013. http://wwwnc.cdc.gov/travel/yellowbook/2016/infectious-diseases-related-to-travel/rickettsial-spotted-typhus-fevers-related-infections-anaplasmosis-ehrlichiosis. Доступ до 26 липня 2016 року.
- 20 Всесвітня організація охорони здоров'я. «Тиф». 1997. www.who.int/медіацентр/factsheets/fs162/uk/. Доступ до 26 липня 2016 року.
- 21 Центр контролю та профілактики захворювань. «Плямиста лихоманка Скелястих гір (RMSF): статистика та епідеміологія». http://www.cdc.gov/rmsf/stats/index.html. Доступ до 16 вересня 2016 року.
- 22 Центри з контролю та профілактики захворювань. «Хвороба Лайма. Дані та статистика» 2015 р. http://www.cdc.gov/lyme/stats/index.html. Доступ до 26 липня 2016 року.
- 23 Центри з контролю та профілактики захворювань. «Ознаки та симптоми нелікованої хвороби Лайма». 2015 рік. http://www.cdc.gov/lyme/signs_symptoms/index.html. Доступ до 27 липня 2016 року.
- 24 Центри з контролю та профілактики захворювань. «Кліщі. Симптоми кліщової хвороби». 2015 рік. http://www.cdc.gov/ticks/symptoms.html. Доступ до 27 липня 2016 року.
