2.1: Матерія
- Page ID
- 3042
Атоми, молекули та сполуки
На самому фундаментальному рівні життя складається з матерії. Матерія - це те, що займає простір і має масу. Вся матерія складається з елементів, речовин, які не можуть бути розщеплені або перетворені хімічно в інші речовини. Кожен елемент складається з атомів, кожен з яких має постійну кількість протонів і унікальні властивості. Всього було визначено 118 елементів; однак лише 92 відбуваються природним шляхом і менше 30 знаходяться в живих клітині. Решта 26 елементів нестабільні і тому не існують дуже довго або є теоретичними і ще не виявлені. Кожен елемент позначається своїм хімічним символом (наприклад, H, N, O, C і Na), і володіє унікальними властивостями. Ці унікальні властивості дозволяють елементам комбінувати і зв'язуватися один з одним конкретними способами.
Атом - найменший компонент елемента, який зберігає всі хімічні властивості цього елемента. Наприклад, один атом водню має всі властивості елемента водню, наприклад, він існує як газ при кімнатній температурі і він зв'язується з киснем для створення молекули води. Атоми водню не можна розбити на щось менше, зберігаючи при цьому властивості водню. Якби атом водню був розбитий на субатомні частинки, він більше не мав би властивостей водню. На самому базовому рівні всі організми складаються з комбінації елементів. Вони містять атоми, які об'єднуються разом, утворюючи молекули. У багатоклітинних організмах, таких як тварини, молекули можуть взаємодіяти, утворюючи клітини, які об'єднуються, утворюючи тканини, що складають органи. Ці комбінації тривають до тих пір, поки не утворюються цілі багатоклітинні організми.
Вся матерія, будь то скеля або організм, складається з атомів. Часто ці атоми об'єднуються, утворюючи молекули. Молекула - це хімічні речовини, виготовлені з двох або більше атомів, пов'язаних між собою. Деякі молекули дуже прості, як O2, який складається лише з двох атомів кисню. Деякі молекули, які використовуються організмами, такі як ДНК, складаються з багатьох мільйонів атомів. Всі атоми містять протони, електрони і нейтрони (рисунок\(\PageIndex{1}\) нижче). Виняток становить лише водень (Н), який зроблений з одного протона і одного електрона. Протон - це позитивно заряджена частинка, яка знаходиться в ядрі (ядрі атома) атома і має масу 1 і заряд +1. Електрон - це негативно заряджена частинка, яка подорожує в просторі навколо ядра. Іншими словами, він знаходиться поза ядром. Він має мізерно малу масу і має заряд -1. Нейтрони, як і протони, мешкають в ядрі атома. Мають масу 1 і без заряду. Позитивний (протони) і негативний (електрони) заряди врівноважують один одного в нейтральному атомі, який має чистий нульовий заряд.
Кожен елемент містить різну кількість протонів і нейтронів, надаючи йому свій атомний номер і масовий номер. Атомний номер елемента дорівнює кількості протонів, які містить елемент. Масове число - це кількість протонів плюс кількість нейтронів цього елемента. Тому визначити кількість нейтронів можна, віднімаючи атомний номер з числа маси.
Ізотопи - це різні форми одного і того ж елемента, які мають однакову кількість протонів, але різну кількість нейтронів. Деякі елементи, такі як вуглець, калій та уран, мають природні ізотопи. Вуглець 12, найпоширеніший ізотоп вуглецю, містить шість протонів і шість нейтронів. Тому він має масове число 12 (шість протонів і шість нейтронів) і атомний номер 6 (що робить його вуглецевим). Вуглець 14 містить шість протонів і вісім нейтронів. Тому він має масове число 14 (шість протонів і вісім нейтронів) і атомний номер 6, що означає, що це все ще елемент вуглецю. Ці дві альтернативні форми вуглецю - ізотопи. Деякі ізотопи нестабільні і втрачають протони, інші субатомні частинки або енергію для утворення більш стабільних елементів. Вони називаються радіоактивними ізотопами або радіоізотопами.
ЕВОЛЮЦІЯ В ДІЇ: Вуглецеві датування
Вуглець-14 (14С) - це природний радіоізотоп, який створюється в атмосфері космічними променями. Це безперервний процес, тому завжди створюється більше 14С. У міру розвитку живого організму відносний рівень 14С в його організмі дорівнює концентрації 14С в атмосфері. Коли організм помирає, він більше не ковтає 14C, тому співвідношення зменшиться. 14C розпадається до 14N процесом, який називається бета-розпадом; він виділяє енергію в цьому повільному процесі. Приблизно через 5,730 років лише половина початкової концентрації 14C буде перетворена на 14N. Час, необхідний для половини початкової концентрації ізотопу розпаду до більш стабільної форми називається його період напіврозпаду.
Оскільки період напіврозпаду 14C довгий, він використовується для старіння раніше живих об'єктів, таких як скам'янілості. Використовуючи співвідношення концентрації 14С, знайденої в об'єкті, до кількості 14С, виявленої в атмосфері, можна визначити кількість ізотопу, який ще не розпався. Виходячи з цієї кількості, вік викопного може бути розрахований приблизно до 50 000 років (малюнок\(\PageIndex{2}\) нижче). Ізотопи з більш тривалим періодом напіврозпаду, такі як калій-40, використовуються для розрахунку віку старих скам'янілостей. Завдяки використанню вуглецевого датування вчені можуть реконструювати екологію та біогеографію організмів, що живуть протягом останніх 50 000 років.
Хімічні зв'язки
Те, як елементи взаємодіють один з одним, залежить від кількості електронів і того, як вони розташовані. Коли атом не містить рівних чисел протонів і електронів, його називають іоном. Оскільки кількість електронів не дорівнює кількості протонів, кожен іон має чистий заряд. Наприклад, якщо натрій втрачає електрон, він тепер має 11 протонів і лише 10 електронів, залишаючи його із загальним зарядом +1. Позитивні іони утворюються при втраті електронів і називаються катіонами. Негативні іони утворюються при отриманні електронів і називаються аніонами. Елементарні аніонні імена змінені, щоб закінчуватися на -ide. Як приклад, коли хлор стає іоном, його називають хлоридом.
Іонні і ковалентні зв'язки - це міцні зв'язки, утворені між двома атомами. Ці зв'язки утримують атоми разом у відносно стабільному стані. Іонні зв'язки утворюються між двома протилежно зарядженими іонами (аніон і катіон). Оскільки позитивні та негативні заряди притягуються, ці іони тримаються разом так само, як два протилежно заряджені магніти злипаються. Ковалентні зв'язки утворюються, коли електрони діляться між двома атомами. Кожен атом розділяє один зі своїх електронів, який потім обертається навколо ядер обох атомів, утримуючи два атоми разом. Ковалентні зв'язки є найміцнішою і найпоширенішою формою хімічного зв'язку в організмах. На відміну від більшості іонних зв'язків, ковалентні зв'язки не дисоціюються у воді.
Ковалентні зв'язки бувають двох різновидів: полярні і неполярні. Неполярний ковалентний зв'язок виникає, коли електрони поділяються порівну між двома атомами. Полярні ковалентні зв'язки утворюються, коли електрони діляться нерівномірно. Чому це відбувається? Кожен елемент має відому електронегативність: міру їх спорідненості до електронів. Деякі елементи, такі як кисень, дуже електронегативні, оскільки сильно притягують електрони від інших атомів. Водень, тим часом, має низьку електронегативність і, таким чином, слабо притягує електрони, в порівнянні. Полярні ковалентні зв'язки утворюються, коли два задіяні атоми мають значно різну електронегативність. У біологічних системах це відбувається при зв'язках кисню з воднем і при азотних (теж досить електронегативних) зв'язках з воднем.
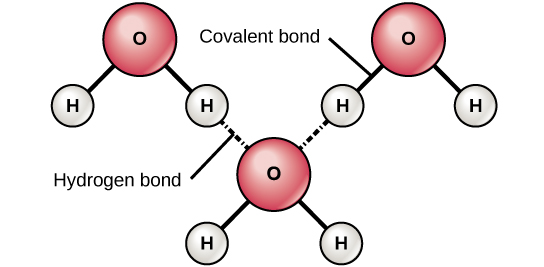
Наприклад, коли кисень і водневий зв'язок, спільні електрони тягнуться сильніше до кисню і, таким чином, далі від ядра водню. Оскільки електрони віддаляються від водню, він стає трохи позитивно зарядженим (Δ+). Кисень стає трохи негативно зарядженим, коли електрони стають ближче до нього (δ—). Якщо дві молекули з полярними ковалентними зв'язками наближаються один до одного, вони можуть взаємодіяти через тяжіння протилежних електричних зарядів. Наприклад, незначний позитивний заряд водню в молекулі води може притягуватися до невеликого негативного заряду кисню в іншій молекулі води (рис.\(\PageIndex{3}\)). Ця взаємодія між двома полярними молекулами називається водневим зв'язком. Цей тип зв'язку дуже поширений у організмів. Примітно, що водневі зв'язки надають воді унікальні властивості, які підтримують життя. Якби не водневий зв'язок, вода була б газом, а не рідиною кімнатної температури.
ВОДА МАЄ ВИРІШАЛЬНЕ ЗНАЧЕННЯ ДЛЯ ПІДТРИМКИ ЖИТТЯ
Ви коли-небудь замислювалися, чому вчені витрачають час на пошуки води на інших планетах? Це тому, що вода є важливою для життя; навіть незначні сліди її на іншій планеті можуть свідчити про те, що життя могло або існувало на цій планеті. Вода - одна з найбагатших молекул в живих клітині і найбільш критична для життя, як ми її знаємо. Приблизно 60-70 відсотків вашого тіла складається з води. Без неї життя просто не існувало б.
- Вода полярна. Атоми водню та кисню в молекулах води утворюють полярні ковалентні зв'язки. Спільні електрони проводять більше часу, пов'язаного з атомом кисню, ніж з атомами водню. Загального заряду молекули води немає, але є невеликий позитивний заряд на кожному атомі водню і невеликий негативний заряд на атомі кисню. Через ці заряди трохи позитивні атоми водню відштовхуються один від одного і утворюють унікальну форму. Кожна молекула води притягує інші молекули води через позитивні і негативні заряди в різних частинок молекули. Вода також приваблює інші полярні молекули (наприклад, цукри), які можуть розчинятися у воді і називаються гідрофільними («водолюбними»).
- Вода стабілізує температуру. Водневі зв'язки у воді дозволяють їй поглинати і виділяти теплову енергію повільніше, ніж багато інших речовин. Температура - це міра руху (кінетичної енергії) молекул. Зі збільшенням руху енергія стає вищою і, таким чином, температура вище. Вода поглинає багато енергії до підвищення її температури. Підвищена енергія порушує водневі зв'язки між молекулами води. Оскільки ці зв'язки можуть створюватися і порушуватися швидко, вода поглинає збільшення енергії і зміни температури лише мінімально. Це означає, що вода помірковує зміни температури всередині організмів і в їх середовищах.
- Вода є відмінним розчинником. Оскільки вода полярна, з невеликими позитивними і негативними зарядами, іонні сполуки і полярні молекули можуть легко розчинятися в ній. Отже, вода називається розчинником - речовиною, здатною розчиняти іншу речовину. Заряджені частинки утворюватимуть водневі зв'язки з навколишнім шаром молекул води.
- Вода згуртована. Ви коли-небудь доливали склянку води до самого верху, а потім повільно додавали ще кілька крапель? Перш ніж вона переливається, вода фактично утворює куполоподібну форму над обідком скла. Ця вода може залишатися над склом через властивість згуртованості. У згуртованості молекули води притягуються один до одного (через водневий зв'язок), утримуючи молекули разом на межі розділу рідина-повітря (газ), хоча в склі більше немає місця. Згуртованість породжує поверхневий натяг, здатність речовини протистояти розриву при розміщенні під напругою або напругою. Коли ви опускаєте невеликий клаптик паперу на крапельку води, папір плаває поверх крапельки води, хоча предмет щільніше (важче), ніж вода. Це відбувається через поверхневого натягу, яке створюється молекулами води. Згуртованість і поверхневий натяг зберігають молекули води недоторканими, а елемент плаває зверху. Можна навіть «спливати» сталевою голкою поверх склянки води, якщо розташувати її акуратно, не порушуючи поверхневого натягу. Ці сили зчеплення також пов'язані з властивістю води адгезії або тяжіння між молекулами води та іншими молекулами. Це спостерігається, коли вода «піднімається» вгору соломинкою, поміщеною в склянку з водою. Ви помітите, що вода, здається, вище з боків соломи, ніж посередині. Це пояснюється тим, що молекули води притягуються до соломи і тому прилипають до неї. Згуртовані та адгезійні сили важливі для підтримки життя. Наприклад, через цих сил вода може стікати від коренів до верхівок рослин, щоб підгодувати рослину.
Буфери, рН, кислоти та основи
РН розчину є мірою його кислотності або лужності. Шкала рН коливається від 0 до 14. Зміна однієї одиниці за шкалою рН являє собою зміну концентрації іонів водню в 10 разів, зміна двох одиниць являє собою зміну концентрації іонів водню в 100 разів. Таким чином, невеликі зміни рН представляють великі зміни концентрацій іонів водню. Чиста вода нейтральна. Він не є ні кислим, ні основним і має рН 7,0. Все, що нижче 7,0 (від 0,0 до 6,9) є кислим, і все, що вище 7,0 (від 7,1 до 14,0) є лужним. Кров у ваших венах слаболужна (рН = 7,4). Навколишнє середовище у вашому шлунку дуже кисле (рН = 1 до 2). Апельсиновий сік м'яко кислий (рН = приблизно 3,5), тоді як харчова сода є основною (рН = 9,0).
Кислоти - це речовини, які забезпечують іони водню (H+) і знижують рН, тоді як основи забезпечують гідроксидні іони (OH—) і підвищують рН. Чим сильніше кислота, тим охочіше вона жертвує H+. Наприклад, соляна кислота і лимонний сік дуже кислі і легко відмовляються від Н+ при додаванні в воду. І навпаки, основи - це ті речовини, які легко здають OH—. OH— іони поєднуються з Н + для отримання води, що підвищує рН речовини. Гідроксид натрію та багато побутових очищувачів дуже лужні і швидко відмовляються від OH— при розміщенні у воді, тим самим підвищуючи рН.
Як це так, що ми можемо ковтати або вдихати кислі або основні речовини і не вмирати? Буфери - це ключ. Буфери легко поглинають надлишок H + або OH—, зберігаючи рН тіла ретельно підтримується у вищезгаданому вузькому діапазоні. Вуглекислий газ є частиною видатної буферної системи в організмі людини; він підтримує рН в належному діапазоні. Ця буферна система включає вугільну кислоту (H 2 CO 3) та бікарбонат (HCO 3 -) аніон. Якщо в організм надходить занадто багато Н+, бікарбонат з'єднається з Н+, щоб створити вугільну кислоту і обмежити зниження рН. Так само, якщо занадто багато OH— введено в систему, вугільна кислота буде поєднуватися з нею, щоб створити бікарбонат і обмежити збільшення рН. Хоча вугільна кислота є важливим продуктом у цій реакції, її присутність швидкоплинна, оскільки вугільна кислота виділяється з організму як вуглекислий газ кожного разу, коли ми дихаємо. Без цієї буферної системи рН у наших тілах коливався би занадто сильно, і ми не змогли б вижити.
біологічні молекули
Крім води, молекули, необхідні для життєдіяльності, є органічними. Органічні молекули - це ті, які містять вуглець, ковалентно пов'язаний з воднем. Крім того, вони можуть містити кисень, азот, фосфор, сірку та додаткові елементи.Існує чотири основні класи органічних молекул: вуглеводи, ліпіди, білки та нуклеїнові кислоти. Кожен є важливим компонентом клітини і виконує широкий спектр функцій.
Часто говорять, що життя «на основі вуглецю». Це означає, що атоми вуглецю, пов'язані з іншими атомами вуглецю або іншими елементами, утворюють фундаментальні компоненти багатьох молекул, унікальних у живих істотах. Інші елементи відіграють важливу роль у біологічних молекулах, але вуглець, безумовно, кваліфікується як «основний» елемент для молекул живих істот. Саме зв'язуючі властивості атомів вуглецю відповідають за його важливу роль.
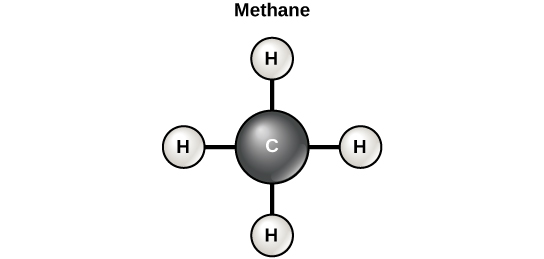
Вуглець може утворювати чотири ковалентні зв'язку з іншими атомами або молекулами. Найпростіша молекула органічного вуглецю - метан (СН4), в якому чотири атома водню зв'язуються з атомом вуглецю (рис.\(\PageIndex{5}\)). Вуглеводи включають те, що зазвичай називають простими цукрами, такими як глюкоза, і складні вуглеводи, такі як крохмаль. Хоча багато видів вуглеводів використовуються для отримання енергії, деякі використовуються для структури більшістю організмів, включаючи рослини і тварини. Наприклад, клітковина - це складний вуглевод, який додає жорсткості і міцності клітинним стінкам рослин. Суфікс «-ose» позначає вуглевод, але зверніть увагу, що не всі вуглеводи були дані цей суфікс при назвах (наприклад, крохмаль).
Ліпіди включають різноманітну групу сполук, які об'єднані спільною ознакою. Ліпіди гідрофобні («бояться води»), або нерозчинні у воді, оскільки є неполярними молекулами (молекулами, які містять неполярні ковалентні зв'язки). Ліпіди виконують безліч різних функцій в клітині. Клітини зберігають енергію для тривалого використання у вигляді ліпідів, званих жирами. Ліпіди також забезпечують ізоляцію з навколишнього середовища для рослин і тварин. Наприклад, вони допомагають утримувати водних птахів та ссавців сухими через їх водовідштовхуючий характер. Ліпіди також є будівельними блоками багатьох гормонів і є важливою складовою клітинних мембран. Ліпіди включають жири, масла, воски, фосфоліпіди, і стероїди.
Білки є однією з найпоширеніших органічних молекул в живих системах і мають найрізноманітніший спектр функцій всіх макромолекул. Всі вони є полімерами амінокислот. Функції білків дуже різноманітні, оскільки існує 20 різних хімічно відмінних амінокислот, які утворюють довгі ланцюги, а амінокислоти можуть бути в будь-якому порядку. Білки можуть функціонувати як ферменти, гормони, скоротливі волокна, цитоскелетні стрижні і багато іншого. Ферменти життєво важливі для життя, оскільки вони діють як каталізатор в біохімічних реакціях (як травлення). Кожен фермент специфічний для субстрату (реагента, який зв'язується з ферментом), на який він діє. Ферменти можуть функціонувати для розриву молекулярних зв'язків, переставляти зв'язки або утворювати нові зв'язки.
Нуклеїнові кислоти - це дуже великі молекули, які важливі для безперервності життя. Вони несуть генетичний план клітини і, отже, інструкції щодо її функціональності. Два основних типи нуклеїнових кислот - дезоксирибонуклеїнова кислота (ДНК) і рибонуклеїнова кислота (РНК). ДНК - генетичний матеріал, знайдений у всіх організмах, починаючи від одноклітинних бактерій і закінчуючи багатоклітинними ссавцями. Інший тип нуклеїнової кислоти, РНК, в основному бере участь в синтезі білка. Молекули ДНК ніколи не залишають ядра, а замість цього використовують посередник РНК для зв'язку з рештою клітини. Інші типи РНК також беруть участь в синтезі білка і його регуляції. ДНК та РНК складаються з невеликих будівельних блоків, відомих як нуклеотиди. Нуклеотиди поєднуються між собою, утворюючи полінуклеотид: ДНК або РНК. Кожен нуклеотид складається з трьох компонентів: азотистої основи, пентози (п'ятивуглецевого) цукру і фосфату. ДНК має красиву подвійну спіральну структуру (рис.\(\PageIndex{6}\)).
Додаткові ресурси:

Атрибуція
- Концепції біології OpenStax ліцензовані відповідно до CC BY 4.0. Змінено з оригіналу Метью Р. Фішер.
