1.2: Стилі життя та основна хімія
- Page ID
- 6697
Життя отримує енергію кількома різними способами: (1) від сонячного світла (фототрофія); (2) від хімічних реакцій з неорганічною речовиною (літотрофія); (3) від розриву органічних молекул на неорганічні молекули, як правило, вуглекислий газ та воду (органотрофія). Щоб зробити своє тіло, живі істоти отримують будівельні блоки або шляхом (а) від засвоєння вуглекислого газу (автотрофія), або від інших живих істот (гетеротрофія).
Ці способи поєднуються в шести способах життя. Наприклад, рослини за\(_1\) визначенням фотоавтотрофи. Більшість рослин також\(_2\) є фотоавтотрофами, але бувають винятки: повні паразити (див. Вище). М'ясоїдні рослини (такі як росичка, дросера або Венерина мухоловка, Діонея) - все це фотоавтотрофи. Вони «їдять» тварин з метою отримання азоту і фосфору, тому мертві тіла служать не їжею, а добривом. Зверніть увагу, що рослини також є органогетеротрофами, як тварини, оскільки крім фотосинтезу, всі рослинні клітини можуть дихати.
Щоб зрозуміти життя рослин, необхідні базові знання хімії. Сюди входять знання атомів (і його компонентів, таких як протони, нейтрони та електрони), атомну масу, ізотопи, елементи, періодичну таблицю, хімічні зв'язки (іонні, ковалентні та водневі), валентність, молекули та молекулярну масу. Наприклад, важливо знати, що протони мають заряд\(+1\), нейтрони не мають заряду, а електрони мають заряд\(-1\). Атомна маса дорівнює масі протонів і нейтронів. Ізотопи мають однакову кількість протонів, але різну кількість нейтронів; деякі ізотопи нестабільні (радіоактивні).
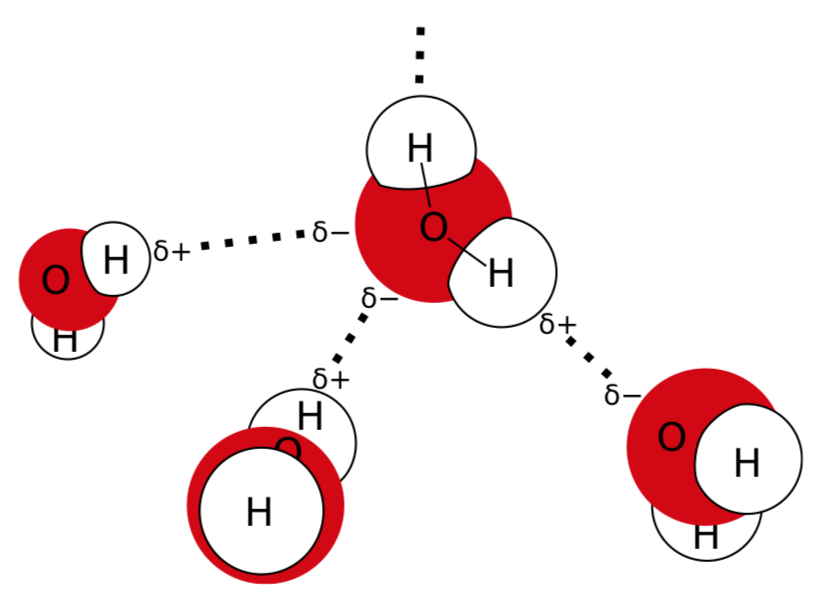
Однією з найвидатніших молекул є вода. Теоретично вода повинна кипіти при набагато більш низькій температурі, але вона закипає при 100\(^\circ\) С тільки через водневих зв'язків, що герметизують молекули води. Ці зв'язки виникають через те, що молекула води полярна: водні трохи позитивно заряджені, а кисень трохи негативно заряджений (рис.\(\PageIndex{1}\)).
Ще одне важливе поняття, пов'язане з водою - кислотність. Якщо в розчині води молекула виводить протон (Н\(^+\)), то це кислота. Одним із прикладів цього може бути соляна кислота (HCl), яка дисоціює на H\(^+\) і Cl\(^-\). Якщо молекула виводить ОН\(^-\) (гідроксид-іон), це основа.
Прикладом цього може бути гідроксид натрію (NaOH), який дисоціює на Na\(^+\) та гідроксид-іон.
Щоб правильно спланувати хімічні реакції, нам потрібно знати про молярну масу та молярну концентрацію. Молярна маса - це грамовий еквівалент молекулярної маси. Це означає, що (наприклад) молекулярну масу солі (NaCl) можна оцінити як\(23 + 35\), що дорівнює 58 одиницям. Отже, одна моль солі становить приблизно 58 грам. Один моль будь-якої речовини (молекулярної структури) завжди містить\(6.02214078 \times 10^{23}\) молекули (число Авогадро).
Щільність розчиненого речовини - це концентрація. Якщо в 1 літрі дистильованої води розведено 58 грам солі, маємо 1М (одну молярну) концентрацію солі. Концентрація не зміниться, якщо ми візьмемо будь-яку кількість цієї рідини (ложка, крапля або півлітра).
Залежно від концентрації протонів в речовині розчин може бути дуже кислим. Кислотність розчину можна визначити за допомогою рН. Наприклад, якщо концентрація протонів становить 0,1 М (\(1 \times 10^{-1}\)що 0,1 грама протонів в 1 літрі води), це надзвичайно кислий розчин. РН його становить всього 1 (негативний логарифм, або негативний ступінь десяти концентрації протонів). Інший приклад - дистильована вода. Концентрація протонів там дорівнює\(1 \times 10^{-7}\) М, а тому рН дистильованої води дорівнює 7. Дистильована вода набагато менш кисла, оскільки молекули води дисоціюють рідко.
Коли два або більше атомів вуглецю з'єднані, вони утворюють вуглецевий скелет. Всі органічні молекули складаються з якогось органічного скелета. Крім С, елементи беруть участь в органічних молекулах (біогенних елементів) є H, O, N, P і S. Ці шість елементів утворюють чотири типи біомолекул: (1) ліпіди - гідрофобні органічні молекули, які не легко розчиняються у воді; (2) вуглеводи або цукру, такі як глюкоза (родзинки містять багато глюкози) і фруктоза (мед); за визначенням вуглеводи мають множинну групу\(-\) OH, є також полімерні вуглеводи (полісахариди), такі як целюлоза і крохмаль; (3) амінокислоти (компоненти білків), які завжди містять N, C, O і H; і (4) нуклеотиди, об'єднані з вуглецевого циклу з азотом ( гетероцикл), цукор та фосфорна кислота; полімерні нуклеотиди - це нуклеїнові кислоти, такі як ДНК та РНК.
