1.5: Властивості матеріалів
- Page ID
- 29412
макроскопічні властивості
Щоб зрозуміти пристрої перетворення енергії, нам потрібно розуміти матеріали як мікроскопічно в атомному масштабі, так і макроскопічно у великих масштабах. Макроскопічна властивість - це властивість, яка застосовується до великих шматків матеріалу на відміну від шматків мікроскопічного розміру.
Один із способів класифікації матеріалів базується на їх стані речовини. Матеріали можна класифікувати як тверді речовини, рідини, гази або плазми. А плазма - це іонізований газ. Існують інші більш незвичайні стани матерії, такі як конденсати Босе Ейнштейна, але вони не будуть обговорюватися в цій книзі.
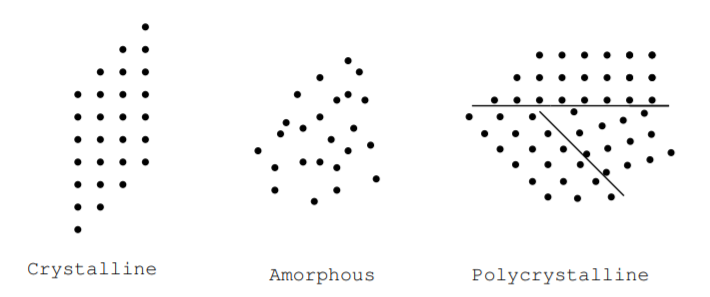
Ми можемо додатково класифікувати тверді речовини як кристалічні, полікристалічні або аморфні виходячи з регулярності їх атомної структури [9]. Малюнок\(\PageIndex{1}\) ілюструє ці терміни. У кристалі розташування атомів періодичне. Атоми можуть бути розташовані в кубічному масиві, гексагональному масиві або якимось іншим способом, але вони розташовані періодично в трьох вимірах. В аморфному матеріалі розташування атомів не є періодичним. Термін аморфний означає склоподібний. Полікристалічний матеріал складається з дрібних кристалічних областей. Ці визначення можуть застосовуватися до матеріалів, виготовлених з окремих елементів або матеріалів, виготовлених з декількох елементів. Багато пристроїв перетворення енергії виготовляються з дуже чистих кристалічних, аморфних або полікристалічних матеріалів. Наприклад, аморфний телурид кадмію використовується для виготовлення сонячних елементів, а кристалічний кремній - для виготовлення пристроїв з ефектом Холла. Багато матеріалів, включаючи як кремній, так і діоксид кремнію, можна знайти у всіх трьох цих формах при кімнатній температурі. У кристалічному і аморфному кремнію, наприклад, атоми кремнію можуть мати однакову кількість найближчих сусідів, а щільність атомів в обох матеріалах може бути однаковою, але середнього порядку в аморфному матеріалі немає. Електричні властивості кристалічної, аморфної та полікристалічної форм матеріалу можуть відрізнятися. Електрони можуть легше протікати через чистий кристалічний матеріал, тоді як електрони, швидше за все, будуть розсіяні або поглинені, коли вони протікають через аморфний матеріал, кристалічні матеріали з домішками або кристалічний матеріал з кристалічними дефектами.
Далі можна класифікувати кристали як ізотропні або анізотропні [10, с. 210]. Кристал є ізотропним, якщо його макроскопічна структура і властивості матеріалу однакові в кожному напрямку. Кристал анізотропний, якщо макроскопічна структура і властивості матеріалу різні в різних напрямках.
Ми також можемо класифікувати матеріали виходячи з того, як вони поводяться при подачі напруги на матеріал [11]. У провіднику електрони легко протікають при наявності прикладеної напруги або електричного поля. В ізоляторі, який також називають діелектриком, електрони не протікають при наявності прикладеної напруги або електричного поля. При наявності невеликого зовнішнього напруги або електричного поля напівпровідник виступає ізолятором, а при наявності сильного напруги або електричного поля провідником виступає напівпровідник. Як тверді речовини, так і рідини можуть бути провідниками, а як тверді речовини, так і рідини можуть бути ізоляторами. Наприклад, мідь є твердим провідником, а солона вода - рідким провідником.
мікроскопічні властивості
Конфігурація електронів перераховує енергетичні рівні, зайняті електронами навколо атома. Конфігурація електронів може описувати нейтральні або іонізовані атоми, і вона може описувати атоми в найнижчому енергетичному стані або збуджені атоми. Наприклад, електронна конфігурація нейтрального атома алюмінію в найнижчому енергетичному стані є\(1s^{2}2s^{2}2p^{6}3s^{2}3p^{1}\). Електронна конфігурація\(^{+}\) іона алюмінію Al в найнижчому енергетичному стані є\(1s^{2}2s^{2}2p^{6}3s^{2}\), і електронну конфігурацію нейтрального атома алюмінію з збудженим електроном можна записати як\(1s^{2}2s^{2}2p^{6}3s^{2}4s^{1}\).
Електрони маркуються чотирма квантовими числами: принциповим квантовим числом, азимутальним квантовим числом, магнітним квантовим числом та спіновим квантовим числом [6] [12]. Жодні два електрони навколо атома не можуть мати однаковий набір квантових чисел. Принцип квантового числа приймає цілочисельні значення, 1, 2, 3 і так далі. Кажуть, що всі електрони з однаковим принципом квантового числа знаходяться в одній оболонці. Великі числа в електронній конфігурації відносяться до принципових квантових чисел. Нейтральний атом алюмінію в найнижчому енергетичному стані має два електрони в оболонці 1, вісім електронів в оболонці 2 і три електрони в оболонці 3. Для більшості атомів, особливо атомів з невеликою кількістю електронів, електрони з нижчими принциповими квантовими числами обидва знаходяться просторово ближче до ядра і вимагають найбільшої енергії для видалення. Однак є винятки з цієї ідеї для деяких електронів навколо більших атомів [13] [14].
Азимутальні квантові числа є цілими числами, і ці значення визначають підоболонки. Для оболонок з принциповим квантовим числом\(\mathfrak{n}\) азимутальне квантове число може приймати значення від 0 до\(\mathfrak{n}-1\). В електронній конфігурації значення цього квантового числа позначаються малими літерами:\(s =0\),\(p =1\),\(d =2\),\(f =3\), і так далі. Магнітні квантові числа також є цілими числами, і ці значення визначають орбіталі. Для підоболонки з азимутальним квантовим\(l\) числом магнітне квантове число приймає значення від\(-l\) до\(l\). В електронній конфігурації надрядкові числа вказують на магнітне квантове число. Спінові квантові числа електронів можуть приймати значення\(\frac{1}{2}\) і\(\frac{-1}{2}\). Вони явно не позначаються в електронній конфігурації.
Розглянемо знову нейтральний атом алюмінію в найнижчому енергетичному стані. Цей атом має електрони з принциповими квантовими числами\(\mathfrak{n}\) = 1, 2 і 3. Для електронів з принциповим квантовим числом 1 єдино можливі значення як для азимутального квантового числа, так і для магнітного квантового числа - нуль. Спінове квантове число може приймати значення\(\frac{1}{2}\) і\(\frac{-1}{2}\). Тільки два електрони можуть займати 1 оболонку, і ці електрони позначаються\(1s^{2}\) терміном електронної конфігурації. Для електронів з принциповим квантовим числом 2 азимутальне квантове число може бути 0 або 1. Два електрони можуть займати\(2s\) орбіту, а шість електронів можуть займати\(2p\) орбіталь. Для оболонки 3 азимутальне квантове число може приймати три можливих значення:\(s =0\),\(p =1\), і\(d =2\). Однак оскільки алюміній має лише 13 електронів, електрони не мають всіх цих можливих значень, тому оболонка 3 заповнена лише частково. Атоми в крайньому правому стовпці таблиці Менделєєва мають повністю заповнені оболонки. Вони рідко беруть участь у хімічних реакціях, оскільки додавання електронів, видалення електронів або формування хімічних зв'язків вимагало б занадто багато енергії.
Валентні електрони - це електрони, які найлегше зірвані з атома. Валентні електрони - це електрони, що беруть участь в хімічних реакціях, а електричний струм - потік валентних електронів. Інша, внутрішня оболонка, електрони можуть бути залучені в хімічні реакції або електричний струм тільки у випадках незвично великих прикладних енергій, і ці ситуації не будуть обговорюватися в цьому тексті. Валентні електрони займають підоболонку або підоболонки з найвищими квантовими числами, а валентні електрони не входять до складу повністю заповнених оболонок. Для прикладу нейтрального атома алюмінію в найнижчому енергетичному стані три електрони в оболонці 3 є валентними електронами.
Де знаходяться електрони навколо атома просторово? Це питання цікавить і хіміків, і фізиків, і інженерів-електриків. Якщо ми знаємо орбіталь електрона, ми маємо деяку інформацію про те, де електрон, ймовірно, буде знайдений просторово навколо атома. Однак визначити місце розташування електрона з будь-яким ступенем точності важко з кількох причин. По-перше, атоми крихітні, приблизно\(10^{-10}\) m в діаметрі. По-друге, при будь-якій температурі вище абсолютного нуля атоми і електрони постійно знаходяться в русі. По-третє, електрони мають як частинкоподібними, так і хвилеподібними властивостями. По-четверте, згідно з принципом невизначеності Гейзенберга, положення та імпульс електрона не можуть бути одночасно відомі з повною точністю. У кращому випадку можна сказати, що електрон, швидше за все, знаходиться в якомусь регіоні і рухається з деяким діапазоном швидкості. По-п'яте, у багатьох матеріалах, включаючи провідники та напівпровідники, валентні електрони діляться багатьма атомами, а не пов'язані з окремим атомом [10, с. 544].
