6.3: Молекулярні орбіталі
- Page ID
- 31755
На жаль, навіть коли ми застосовуємо наближення Борна-Оппенгеймера і тримаємо ядерні координати фіксованими, рішення рівняння Шредінгера (Equation (6.2.5)) є надзвичайно складним у всіх, крім найпростіших молекул. Зазвичай віддають перевагу числовим методам. Але деяке концептуальне розуміння можна отримати, припускаючи, що молекулярні орбіталі є лінійними комбінаціями атомних орбіталів, тобто ми пишемо:
\[ \varphi = \sum_{r} c_{r}\phi_{r} \nonumber \]
де\(\varphi\) молекулярна орбіталь і\(\phi\) атомна орбіталь. Заповнена молекулярна орбіталь з меншою енергією, ніж складові атомні орбіталі, стабілізує молекулу і відома як хімічний зв'язок.
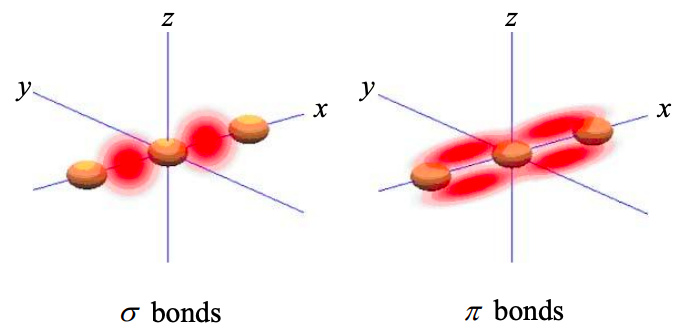
Ми можемо визначити два типи молекулярних орбіталів, побудованих з атомних орбіталів s та p:
\(\sigma\)молекулярні орбіталі: Вони локалізуються між атомами і є інваріантними щодо обертань навколо міжядерної осі. Якщо ми можемо взяти вісь x як міжядерну вісь, то в\(sigma\) молекулярних орбіталах можуть брати участь як s, так і\(p_{x}\) атомні орбіталі. \(p_{y}\)і\(p_{z}\) атомні орбіталі не можуть сприяти s молекулярних орбіталів, оскільки кожен з них має нульову щільність ймовірності на осі x.
\(\pi\)молекулярні орбіталі: Електрони на\(\pi\) молекулярних орбіталах легше поділяються між атомами. Щільність ймовірності не така локалізована, як в\(\sigma\) молекулярній орбіталі. \(\pi\)Молекулярна орбіталь також не інваріантна щодо обертань навколо міжядерної осі. лінійні комбінації\(p_{y}\) і\(p_{z}\) атомні орбіталі утворюють\(\pi\) молекулярні орбіталі.