19: Підкислення
Цілі навчання
Після завершення цієї глави ви зможете:
- Опишіть найважливіші хімічні інгредієнти опадів і поясніть, які з них можуть спричинити розвиток кислотності.
- Визначте просторові закономірності кислотних опадів у Північній Америці та визначте фактори, що впливають на цей розподіл.
- Поясніть різницю між вологим і сухим відкладенням підкислюючих речовин і як змінюються їх норми.
- Опишіть, як впливає хімія води, коли опади взаємодіють з рослинністю та ґрунтом, та поясніть наслідки для поверхневих вод.
- Визначте фактори, які роблять прісні води вразливими до підкислення.
- Опишіть вплив підкислення на прісноводні організми.
- Обговоріть роль вапнування та запліднення в меліорації підкислених озер.
- Поясніть важливість скорочення викидів сірки та азотних газів для пом'якшення підкислення поверхневих вод.
Вступ
Підкислення - це процес, який характеризується збільшенням концентрації іонів водню (Н +) в грунті або воді. Це може спричинити іонізацію металів та їх сполук, виробляючи іони (такі як Al 3+) у концентраціях, достатньо високих, щоб бути токсичними для рослин, тварин та мікроорганізмів. Отже, збільшення підкислення зазвичай трактується як погіршення якості навколишнього середовища. Закислення викликано багатьма впливами, як природними, так і антропогенними, але найбільш поширені проблеми пов'язані з явищем, яке зазвичай називають кислотними дощами.
Кислотні дощі були важливою проблемою в деяких районах Північної Америки принаймні з 1950-х років, але це не стало гучним питанням до початку 1970-х років. Ця досить раптова увага стала результатом відкриття того, що кислотні дощі були поширеною проблемою в Західній Європі, і усвідомлення того, що ті ж умови, ймовірно, мали місце в Північній Америці. Ця обізнаність стимулювала дослідження в Канаді та Сполучених Штатах, які продемонстрували, що кислотні дощі спричиняють широке підкислення озер та струмків, і, можливо, ґрунту. Закислення водних екосистем призвело до значної екологічної шкоди, включаючи втрату багатьох популяцій риб. Будинки та інші матеріали також були пошкоджені, оскільки кислотність розмиває метали, фарбу та деякі види видобутого каменю.
Строго кажучи, термін «кислотний дощ» відноситься тільки до кислотних опадів, які поряд зі снігопадом припадають на вологе осадження. Однак підкислюючі хімічні речовини також осідають з атмосфери, коли не йде дощ або сніг, через сухе осадження певних газів і твердих частинок. Відповідною фразою для визначення цього комплексу процесів є «відкладення підкислюючих речовин з атмосфери», або простіше кажучи, підкислююче осадження. У цьому розділі ми розглядаємо природні та антропогенні причини закислення екосистем. Ми зосереджуємось на хімічних якостях кислих опадів та сухого осадження, їх впливі на наземні та водні екосистеми та те, як можна уникнути або пом'якшити підкислення.
Детально 19.1: Кислоти та основи
Кислота визначається як речовина, яка дарує протони (іони водню, Н +) під час хімічних реакцій. Водний розчин кислий, якщо його концентрація Н + більше 1 × 10 -7 молів на літр. На відміну від цього, основа (луг) дарує гідроксильні іони (OH—) в хімічних реакціях. Розчин є основним, якщо його концентрація ОН - перевищує 1 × 10 -7 моль/л. (Моль є фундаментальною одиницею, яка вимірює кількість речовини і дорівнює 6,02 × 10 23 молекул, атомів або іонів. Це число відоме як константа Авогадро, і воно походить від кількості атомів вуглецю, що містяться в 12 г (1 моль) вуглецю-12.)
Кислоти та основи вступають в реакцію разом, утворюючи воду та нейтральну сіль. Якщо присутні рівні числа молів кожного, розчин має як нульову кислотність, так і нульову лужність - концентрації Н + і ОН - рівно 1 × 10 -7 моль/л, такий розчин вважається нейтральним.
Оскільки надзвичайно широкі діапазони концентрацій H + і OH — зустрічаються в природі та в лабораторіях, кислотність вимірюється в логарифмічних одиницях, які називаються рН (абревіатура від «потенціал водню»). pH визначається як —log 10 H +], або негативний логарифм до основи 10 водної концентрації іона водню, виражений в одиницях молів на літр. Кислі розчини мають рН менше 7,0, тоді як лужні розчини мають рН більше 7,0. Відзначимо, що одноодинична різниця рН має на увазі 10-кратну різницю в концентрації водневих або гідроксильних іонів. Шкала, проілюстрована нижче, показує рН деяких часто зустрічаються речовин.
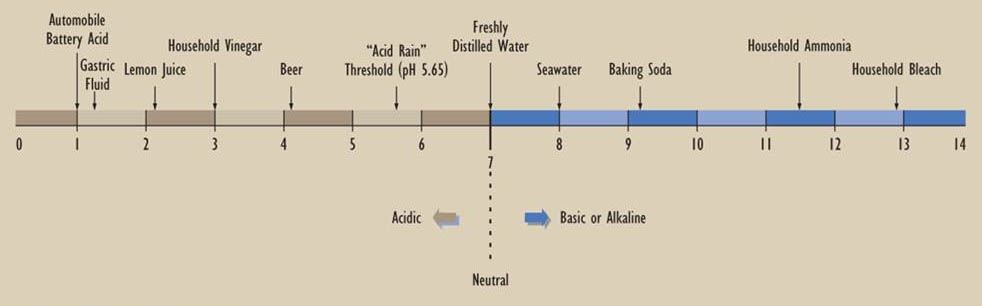
Хімія опадів
Вчені прийняли функціональне визначення кислотних опадів як мають рН менше 5,65. Це було обрано в якості відсічення, оскільки при рН 5,65 водний розчин вугільної кислоти (H 2 CO 3) знаходиться в рівновазі з атмосферним СО 2, наступним чином:
CO2+H2O−⇀↽−H2CO3−⇀↽−H++HCO−3−⇀↽−⇌2H++CO2−3
Дане визначення передбачає, що «некислі» опади - це по суті дистильована вода, в якій кислотність визначається тільки атмосферною концентрацією СО 2 і кількістю вуглекислоти, яка згодом розвивається. Саме тому поріг, нижче якого опади вважаються «кислими», встановлюється при слабокислому рН 5,65, а не при суворому рН нульової кислотності 7,0 (див. Докладно 19.1).
Однак занадто спрощено вважати атмосферну вологу, що складається лише з дистильованої води в рівновазі рН з газоподібним СО 2. Додаткові хімічні речовини також присутні в мікроконцентраціях в опадах. Наприклад, у вітряні дні в атмосферу видувається пил, що містить кальцій і магній, і опади, що містять ці елементи, можуть розвинути рН вище 5,65. Особливо це стосується сільськогосподарських та прерійних ландшафтів, де поверхня землі часто оголена рослинним покривом, а частинки ґрунту можуть легко вивітрюватися в атмосферу. У деяких інших регіонах відносно висока концентрація природного сульфату в атмосфері може призвести до опадів, що мають рН менше 5,65.
Найбільш поширеними катіонами (позитивно зарядженими іонами) в осадженні є іон водню (H +), амоній (NH 4 +), кальцій (Ca 2+), магній (Mg 2+) та натрій (Na +). Найбільш поширеними аніонами (негативно зарядженими іонами) є сульфат (SO 4 2-), хлорид (Cl -) і нітрат (NO 3 -). Інші іони також присутні, але тільки в слідових кількостях, які мало впливають на рН (див. Докладно 19.2).
Детально 19.2: Збереження електрохімічної нейтральності
Принцип збереження електрохімічної нейтральності говорить, що в будь-якому електрично нейтральному розчині (тому, що не несе електричний заряд) загальна кількість позитивних зарядів, пов'язаних з катіонами, має дорівнювати загальному числу негативних зарядів аніонів. Для цілей розрахунку зарядового балансу концентрації іонів вимірюються в одиницях, відомих як еквіваленти. Вони розраховуються як молярна концентрація, помножена на кількість зарядів на іоні. (При роботі з опадами або поверхневими водами мікроеквіваленти, або мкекв, як правило, одиниці повідомляються.)
Цей принцип має відношення до підкислення води. Концентрацію Н + можна визначити як різницю концентрацій суми всіх аніонних еквівалентів мінус сума всіх катіонів, відмінних від Н +. Тому, якщо сумарні еквіваленти аніонів перевищують сумарні еквіваленти катіонів, відмінних від іона водню, то Н + повинен піти в розчин, щоб збалансувати катіонний «дефіцит», наступним чином:
H + = (SO 4 2- + НІ 3 — + Сл —) — (Na + NH 4 + Са 2+ + Mg 2+)
Вищевказане рівняння виявилося корисним при дослідженнях кислотних опадів. Приблизно до 1955 року вимірювання рН було дещо неточним. Однак були проведені достовірні аналізи інших важливих іонів у поверхневих водах та опадах. У таких випадках рівняння може бути використано для обчислення значень рН до 1955 року, надаючи важливі дані для досліджень історичного рН у водах, чутливих до підкислення.
Один з найтриваліших записів хімії опадів - з дослідницького майданчика в Хаббард-Брук, штат Нью-Гемпшир, в регіоні, що піддається інтенсивному підкислювальному осадженню. Протягом 1967-1971 років, коли кислотні дощі були відносно сильними, середній рН опадів у Хаббард-Брук становив 4,1. Цей рівень кислотності потім дещо послабився до рН 4,9 в 1991-1995 роках через зменшення промислових викидів, особливо кислотоутворюючого газу SO 2, а потім ще більше в 2009-2013 роках через подальше зниження викидів SO 2 (Таблиця 19.1; див. Детально 19.2 для пояснення еквіваленти). Сульфат і нітрат є найважливішими аніонами в опадах, а з 1967-1971 років на них припадало 88% аніонних еквівалентів. Протягом 2009-2013 років ці двоє все ще сприяли 87% аніонних еквівалентів, хоча їх загальна кількість була значно меншою. Ці дані свідчать про те, що більша частина кислотності в опадах відбувається у вигляді розведених розчинів сірчаної і азотної кислот. Події опадів у Хаббард-Брук, які є найбільш кислими, пов'язані зі штормами, які пройшли над великими столичними регіонами Бостона, Нью-Йорка та Нью-Джерсі. Ці райони мають величезні викиди SO 2 та NO x, які є газами-попередниками більшої частини SO 4 2- та NO 3 - у кислих опадах.
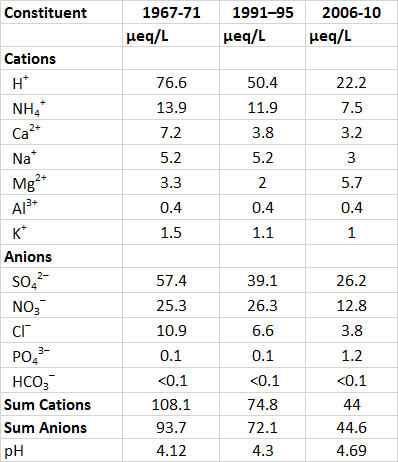
Просторові візерунки
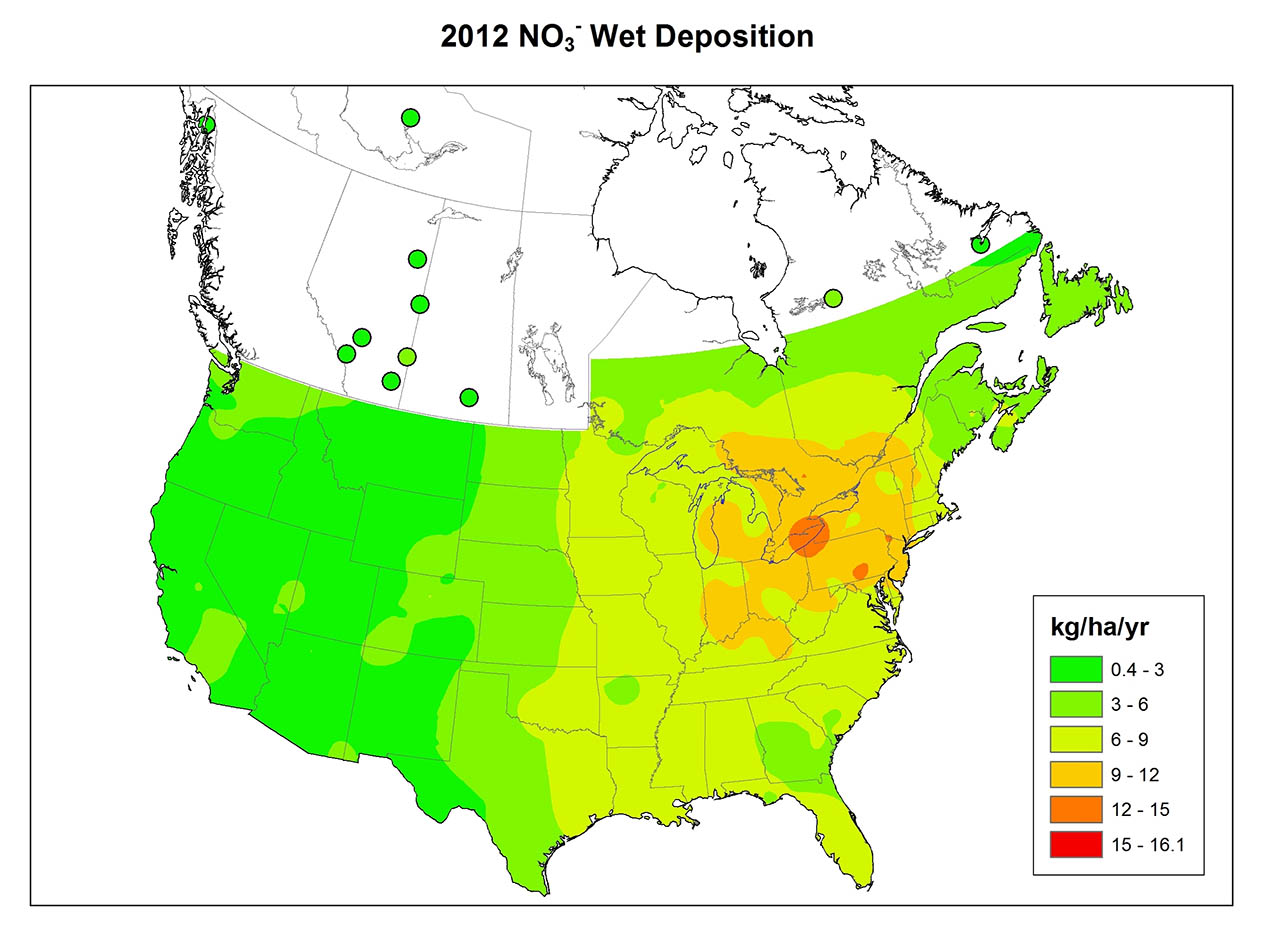
Кислі опади - поширене явище на сході Північної Америки (рис. 19.1), Європі, східній Азії та інших країнах. У східній Північній Америці до середини 1950-х років опади з рН нижче 4,6 впливали лише на відносно місцеві райони, переважно на півдні Онтаріо, Нью-Йорку, Пенсільванії та Новій Англії. З тих пір, однак, ця область значно розширилася. В даний час більша частина південно-східної Канади та східних Сполучених Штатів відчуває кислі опади. Схоже, що просторова картина в Північній Америці існувала до 1950-х років, але з тих пір явище набуло більшого поширення і його інтенсивність зросла. Одним з найважливіших аспектів кислих опадів є величезний розмір територій, на які він впливає.
Хімія опадів сильно різниться між регіонами (рис. 19.1). Варіація відображає закономірності викиду SO 2 та NO x, ступінь окислення цих газів до SO 4 2- та NO 3 -, переважний напрямок, який рухається забрудненими повітряними масами, та кількість кислотно-нейтралізуючого пилу в атмосфері. Атмосферний пил особливо важливий там, де рослинний покрив рідкісний, наприклад, в сільськогосподарських регіонах, де крихітні частинки ґрунту легко вивітрюються в атмосферу сильними вітрами, що дме над голими полями. Грунтові дороги також є важливим джерелом атмосферного пилу.
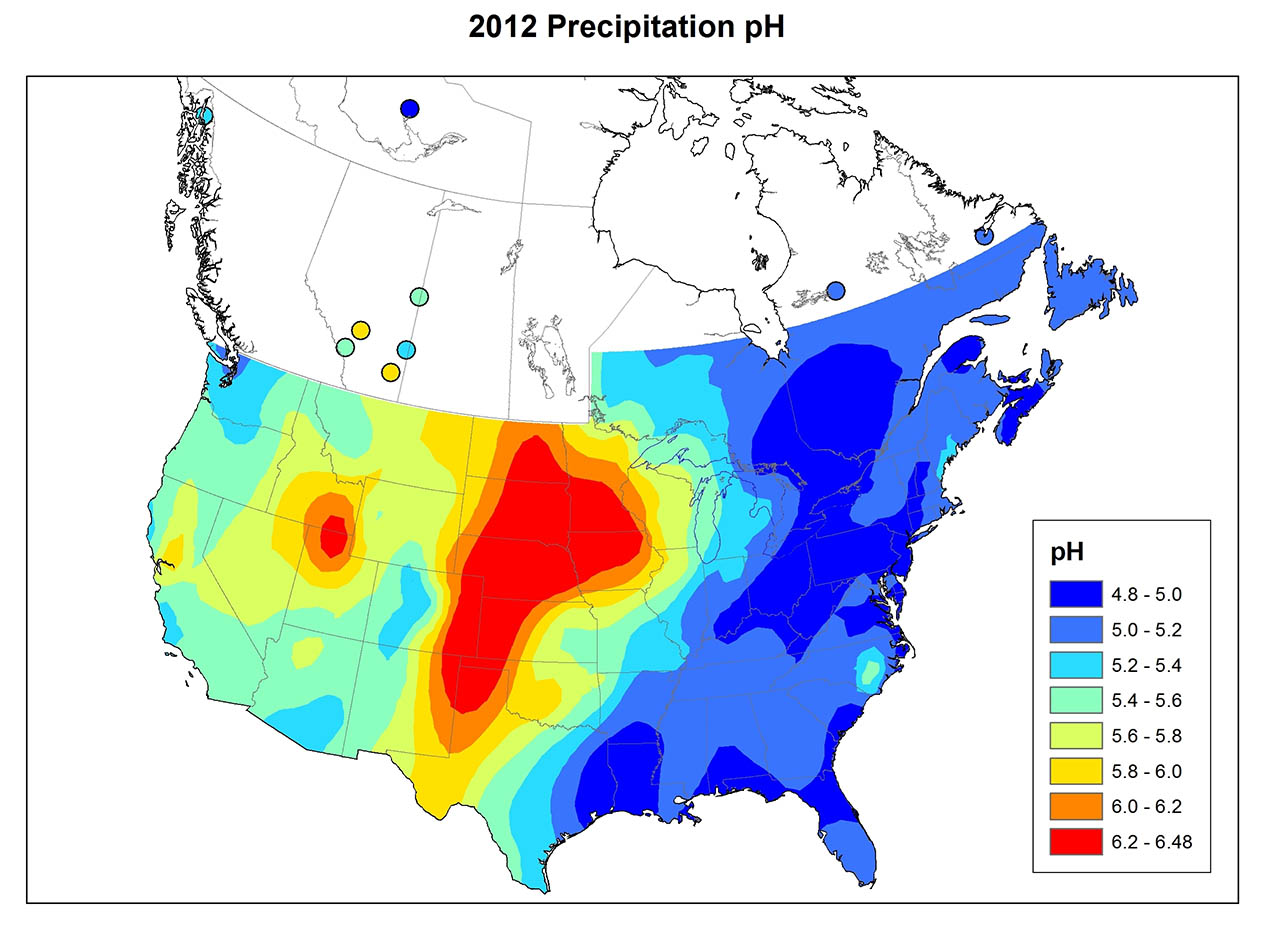
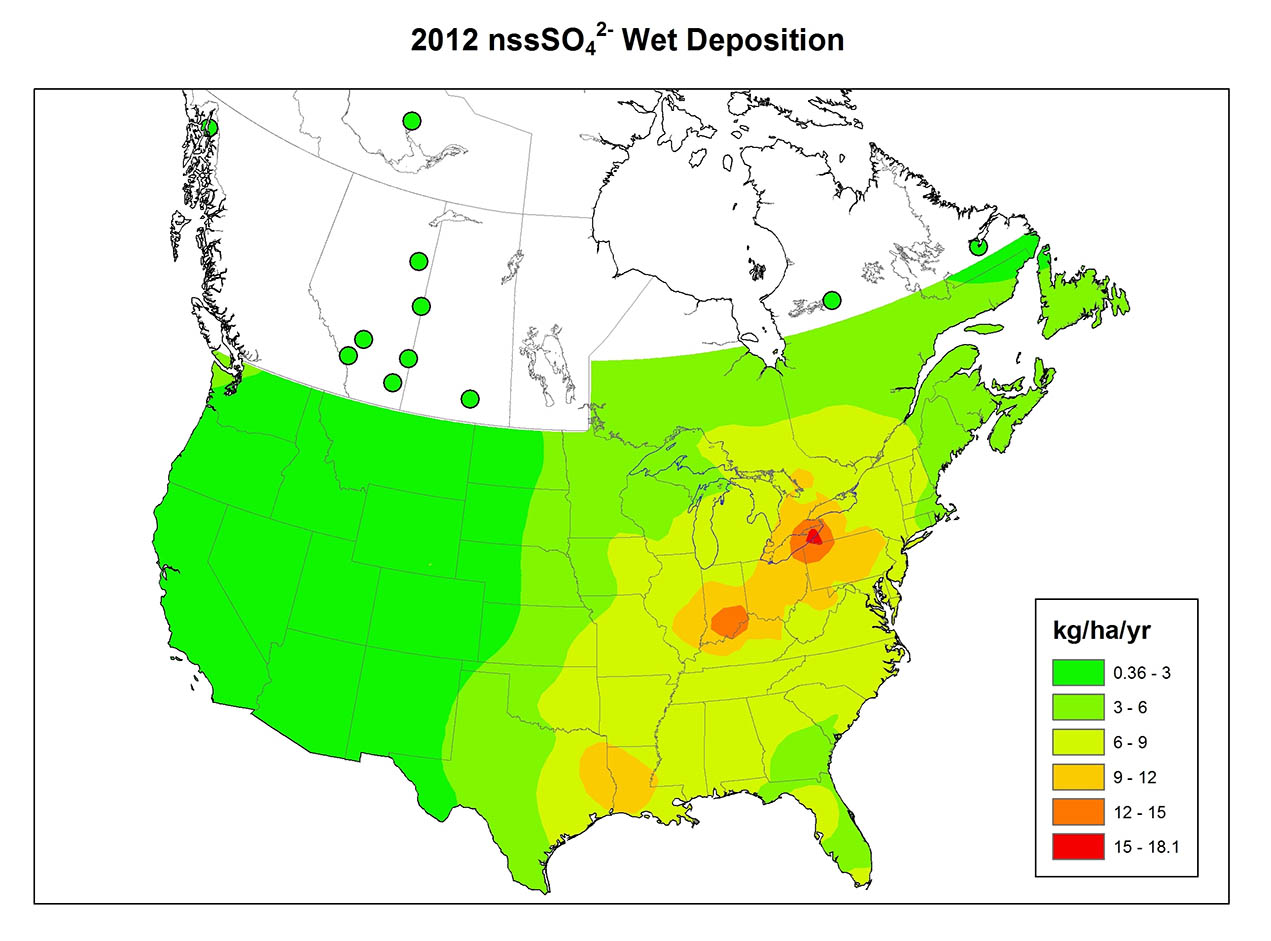
Інформація про хімію опадів на чотирьох широко розділених канадських ділянках зведена в таблиці 19.2. Дорсет розташований у сільській місцевості на південь від центральної частини Онтаріо, але недалеко на північ від густонаселеного регіону Великого Торонто (зазначено як «населений континентальний» в таблиці, оскільки це внутрішня ділянка, близька до великих населених пунктів на півдні). Місцевість знаходиться під твердими породами докембрійського щита, такими як граніт, гнейс і кварцит, а рослинний покрив в основному ліс. Опади висококислі в регіоні Дорсет, із середнім рН 4,1 та високими концентраціями SO 4 2- та NO 3 -, що говорить про те, що кислотність обумовлена головним чином розбавленими сірчаною та азотною кислотами. Значна частина сульфату та нітрату в опадах отримується з SO 2 та NO x, що викидаються промисловостями та автомобілями на південь, які потім транспортуються в атмосфері, перш ніж відкладатися як підкислювальне осадження в регіоні Дорсет.
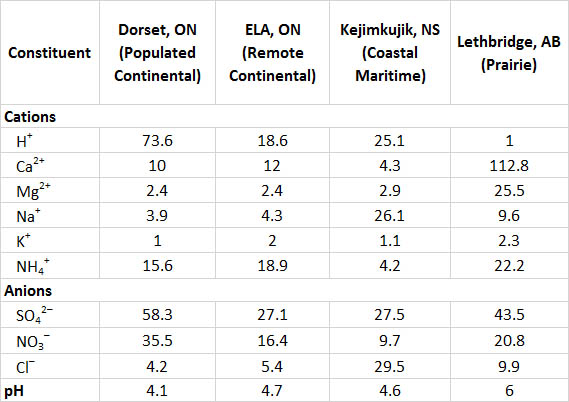
Сайт ELA (Експериментальний район озер) знаходиться у віддаленому районі північно-західного Онтаріо поблизу Кенори (див. Канадський фокус 20.1). Як і Дорсет, ELA знаходиться в значній мірі лісовому ландшафті докембрійського щита, де основа і грунт складаються з твердих мінералів, таких як граніт і гнейс. Однак на ділянку ELA набагато менше впливають повітряні маси, постраждалі від антропогенних викидів (позначені як «віддалений континентальний»), тому його опади не такі кислі (середній рН 4,7), ніж у Дорсета і мають менше нітратів і сульфатів.
Сайт Kejimkujik у західній частині Нової Шотландії також підкладений твердою гранітною породою, а прилегла місцевість лісиста. Ця ділянка віддалена від великих джерел викидів SO 2 і NO x, але в нього часто надходять повітряні маси, які пройшли над густонаселеними районами на північному сході США і східній частині Канади. Однак до того часу, коли штормові системи досягають Кеджимкуджіка, значна частина їх кислого матеріалу пішла дощ, тому місцеві опади лише помірно кислі (середній рН 4,6). На Kejimkujik також впливають океанічні погодні системи, тому його опади мають високі концентрації натрію та хлориду, які отримують з морського спрею. Океанічна солона вода має рН близько 8,0 через наявність таких хімічних речовин, як бікарбонат, тому морські аерозолі мають кислотно-нейтралізуючий вплив на опади в прибережних регіонах.
Летбридж розташований в ландшафті змішаних трав'яних прерій на півдні Альберти. Опади там некислі (середній рН 6,0) через нейтралізуючий вплив багатих кальцієм і магнієм частинок, які відносно рясні в атмосфері. Вони походять від пилу, підірваного з сільськогосподарських полів та доріг. Цей пил також припадає на рясні Ca 2+ та Mg 2+ в опадах.
Швидкі зміни хімії опадів можуть відбуватися на кордоні між лісовим ландшафтом та районами, де переважають прерії або сільськогосподарські угіддя. Дослідження на півдні Онтаріо вивчало опади у восьми місцях в лісовій місцевості з тонким ґрунтом та докембрійською породою, а також на трьох ділянках на південь від Щита в сільськогосподарській місцевості з багатим кальцієм ґрунтом (Dillon et al., 1977). Середній показник рН опадів серед ділянок Щита склав 4,1-4,2, тоді як на ділянках на південь - 4,8-5,8. Опади були менш кислими в сільськогосподарській місцевості через локальний нейтралізуючий вплив пилу, підірваного з полів і доріг.

Ще однією важливою характеристикою кислих опадів є те, що, на відміну від SO 2 і металевих частинок, його інтенсивність не збільшується ближче до великих точкових джерел викидів, таких як вугільна електростанція або плавильний завод. Наприклад, опади не є більш кислими, близькими до суперстека в Садбері, ніж у більшому регіоні, але це найбільші точкові джерела SO 2 в Канаді. Більше того, коли цей завод був закритий страйком у 1979 році, кислотність місцевих опадів не змінилася - вона в середньому становила pH 4,49 під час семимісячного страйку порівняно з pH 4,52 протягом попередніх семи місяців, коли були великі викиди SO 2 (Scheider et al., 1980).
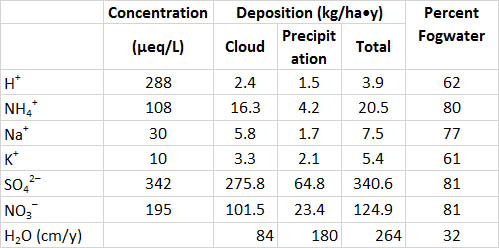
Волога туману також може бути досить кислою у східній Північній Америці та інших місцях. Туманна вода, зібрана на високих висотах і в прибережних місцях, зазвичай більш кисла, ніж рН 4,0, і вона може бути такою ж кислою, як рН 2,5-3,0. На лісистих ділянках, де туман є звичайним явищем, великі кількості кислотності та інших хімічних речовин фільтруються з атмосфери деревами. Це відбувається тому, що крихітні підвішені краплі води зливаються на поверхні листя та кори, коли туман проходить через лісовий навіс, процес, який видаляє більшу частину туманної води з атмосфери. Це явище проілюстровано в таблиці 19.3 для хвойного лісу на горі, який часто відчуває туманні умови. Загальний запас атмосферної вологи в цей ліс становив 264 см/рік, при цьому дощ і сніг становили 68%, а туманні води 32% (туман був присутній 40% часу). Однак концентрації багатьох хімічних речовин набагато вищі в туманній воді, ніж в опадах - оскільки підвішені краплі води крихітні, розчинені хімічні речовини менше «розбавляються» їх водною матрицею. В результаті темпи відкладення розчинених речовин в ліс можуть бути вище, ніж від опадів. У цьому конкретному місці туманна вода становила 62% осадження H + та 81% входів SO 4 2- та NO 3-.
Транскордонне забруднення повітря
Підкислюючі речовини і їх газоподібні попередники часто транспортуються на великі відстані в атмосфері, далеко від джерел їх викиду. Підкислюючі хімічні речовини не поважають політичних кордонів, тому викиди, що відбуваються в одній країні, можуть погіршити екосистеми та цінні ресурси в інших країнах. Цей транскордонний контекст допоміг зосередити увагу урядів на проблемі підкислення осадження з атмосфери.
У Західній Європі, наприклад, скандинави виправдано стверджували, що більша частина підкислювального осадження, яке вплинуло на великі регіони їхнього ландшафту, стала результатом викидів SO 2 та NO x у Німеччині та Англії. Цей міжнародний європейський контекст був першим добре продемонстрованим випадком так званого LRTAP, абревіатури для переносу атмосферних забруднювачів на великі відстані.
Подібні транскордонні обставини відбуваються в інших місцях У східній Північній Америці є великі популяції та промислові центри на північному сході США. Викиди SO 2 та NO x з цих районів часто потрапляють у східну Канаду, погіршуючи шкоду, спричинену там місцевими викидами. Американські викиди відповідають за близько 90% мокрого осадження підкислювальних сполук азоту на сході Канади, поряд з 63% вологого осадження сполук сірки, 43% сухого осадження азоту та 24% сухого осадження сірки (Shannon and Lecht, 1986). Канада також експортує частину своїх викидів до США, хоча канадські викиди становлять менше 5% від загального осадження сполук сірки та азоту в східних штатах. Загалом Канада отримує близько 4 млн тонн SO 2 на рік з США (Environment Canada, 1999).
Сухе осадження
Сухе осадження відбувається в проміжки між подіями опадів, і воно включає в себе наступне:
- пряме поглинання газоподібних SO 2 та NO x рослинністю, ґрунтом та водою
- гравітаційне осідання більших частинок
- фільтрація зважених частинок рослинністю
Сухе відкладення відбувається у всіх видах середовища існування, але ліс особливо ефективний для поглинання газів і частинок з атмосфери. Це пояснюється тим, що дерева мають таку велику і складну площу поверхні листя і кори, що значно підвищує швидкість сухого відкладення.
Сухе осадження може призвести до великих надходжень речовин з атмосфери, включаючи деякі, які генерують кислотність, коли вони хімічно перетворюються в екосистемі. Наприклад, атмосферний SO 2 легко розчиняється у поверхневих водах озер і струмків. Цей газ також вільно поглинається рослинами - він потрапляє в листя через крихітні рясні пори на поверхні, відомі як продихи, а потім розчиняється у вологій плівці води, яка покриває поверхню клітин в подустьянной порожнині. У цьому сенсі SO 2 поводиться так само, як CO 2, життєво важлива поживна речовина, яка також засвоюється рослинами таким чином. Поглинене SO 2 окислюється до аніонсульфіту (SO 3 2-), який швидко окислюється до сульфату (SO 4 2-). Оскільки сульфат збалансований електрохімічно переважно іонами водню, кислотність генерується перетворенням газу SO 2 в іон SO 4 2 (див. Рис.
Газ NO x може бути аналогічно сухим, а потім окислений до нітрату (NO 3 -), який також генерує еквівалентну кількість Н +. Газовий аміак (NH 3) та катіонний амоній (NH 4 +) також можуть бути сухими відкладеннями в грунт або воду, де вони можуть окислюватися бактеріями до нітратів плюс еквівалентні кількості Н +.
Швидкості сухого осадження сполук сірки та азоту найбільші, коли в атмосфері спостерігаються високі концентрації газоподібних NO x і SO 2. Такі умови зазвичай відбуваються в міських районах і поблизу великих промислових джерел викидів. У цих місцях сухе осадження припадає набагато більші витрати підкислюючих речовин, ніж вологе осадження. У більш віддалених, менш забруднених середовищах, далеко від джерел викидів, входи з опадами, як правило, більше, ніж сухе осадження.
У межах 40 км від найбільшого плавильного заводу в Садбері близько 55% атмосферного осадження сірки відбувається у вигляді сухого осадження (Chan et al., 1984). Близько 91% сухого осадження включає газоподібний SO 2, а решта - сульфатні частинки. Однак суперстек на цьому металургійному заводі, будучи надзвичайно високим (380 м), ефективний при диспергуванні своїх викидів SO 2. Отже, менше 1% SO 2, що виділяється цією точкою-джерелом, відкладається поблизу (у цьому випадку в межах 40 км). Швидше за все, майже всі SO 2 транспортуються набагато далі, перш ніж він відкладається в ландшафт.
Кислотність грунту
Кислотність грунту - важливий фактор, що впливає на ріст рослин. Підкислення ґрунту - це природний процес, який був продемонстрований дослідженнями спадкоємства в екосистемах.
Одне відоме дослідження було зроблено в Глейшер-Бей на Алясці. Танення льодовика в довгому фіорді викриває мінеральний субстрат till, який має рН близько 8,0 і містить до 10% карбонатних мінералів кальцію і магнію (Crocker and Major, 1955). Після впливу цей матеріал стає модифікованим шляхом колонізації рослин і кліматичних факторів. Опади особливо важливі, оскільки значна його частина просочується через грунт і вимиває розчинені хімічні речовини за межі глибини вкорінення рослин. Ці впливи призводять до підвищеної кислотності ґрунту, яка досягає приблизно рН 4,8 після 70 років поспіль, до цього часу встановлюється хвойний ліс. Підкислення супроводжується великим і прогресивним зниженням кількості Ca, Mg та карбонатів у ґрунті під час послідовності.
Частково підкислення викликане поглинанням поживних речовин Ca, Mg та K деревами та іншими рослинами, процесом, який супроводжується виведенням Н + та зниженням буферної здатності ґрунту (це пов'язано зі здатністю ґрунту протистояти подальшому закисленню). Вимивання кальцію та інших катіонів з грунту дощовою водою також сприяє підкисленню.
Різні хімічні зміни відбуваються, коли дощова вода просочується через ґрунт і взаємодіє з мінералами, органічними речовинами, мікробами та корінням:
- Коріння та мікроорганізми вибірково поглинають, виділяють та перетворюють хімічні речовини
- Іони обмінюються на поверхнях глинистих частинок, мінералів та органічних речовин
- Нерозчинні мінерали стають розчинними в результаті так званих процесів вивітрювання, включаючи реакції з кислотами
- Утворюються вторинні мінерали, такі як певні глини і нерозчинні опади оксидів заліза і алюмінію.
Ці реакції спричиняють важливі зміни в ґрунті, такі як підкислення, вилуговування кальцію та магнію та солюбілізація металів, особливо токсичних іонів алюмінію (наприклад, Al 3+; див. Розділ 18). Всі ці процеси відбуваються природним шляхом всюди, де надходження води з опадів перевищує кількість, що повертається в атмосферу шляхом випаровування, тому є надлишок, щоб просочуватися вниз через грунт. На ці реакції впливає і вид рослинності, що росте на ділянці. Наприклад, сосни, ялини та дуби, як правило, спричиняють закислення ґрунту. Крім того, відкладення підкислюючих речовин з атмосфери може потенційно збільшити швидкості деяких з цих процесів в грунті, і тим самим збільшити вимивання токсичних Al 3+ і H + в струмки і озера.
Фактори, що впливають на кислотність грунту
На кислотність грунту впливають численні хімічні перетворення і іонні обміни. Одні здійснюються організмами, а інші - небіологічними реакціями. Нижче наведені найважливіші фактори, що впливають на кислотність грунту.
- Вугільна кислота. У багатьох наземних екосистемах, таких як пасовища та ліс, поверхнева підстилка та верхній ґрунт багаті органічними речовинами та корінням. Розпад і дихання призводять до високих концентрацій СО 2 (часто перевищує 1%) в атмосфері всередині ґрунту. Високі концентрації CO 2 призводять до утворення в грунтовій воді вугільної кислоти (H 2 CO 3), що сприяє її підкисленню. Цей ефект найсильніший в грунті з рН більше приблизно 6,0, і він неважливий в кислому грунті з рН менше приблизно 5,5.
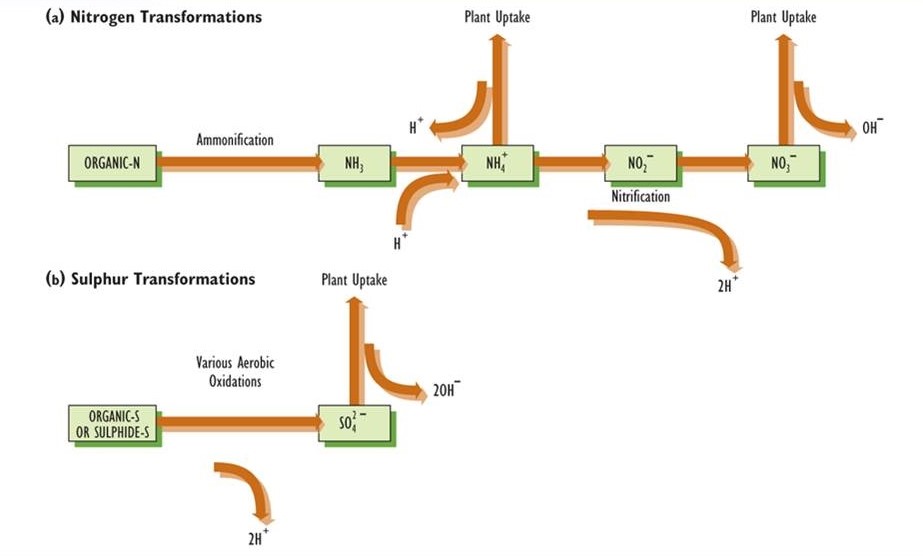
- Цикл азоту. На кислотність грунту також можуть впливати мікробні перетворення азотних сполук і їх поглинання і виділення рослинами (рис. 19.2). Амоній (NH 4 +) та нітрат (NO 3 -) особливо важливі, оскільки рослини повинні приймати одну або обидві ці необхідні поживні речовини, вибір в значній мірі залежить від кислотності ґрунту. У грунті з рН менше приблизно 5,5 майже весь неорганічний азот зустрічається як NH 4 +. NH 4 + може походити від амонізації органічного азоту з утворенням аміаку (NH 3), процесу, що здійснюється багатьма видами мікроорганізмів (див. Розділ 5). Аміак поглинає один Н + з утворенням амонію. Якщо іон NH 4 + поглинається коренем рослини, один Н + виділяється в грунт для підтримки електрохімічної нейтральності, тому немає чистої зміни кислотності. Однак якщо NH 4 + додають безпосередньо в грунт (наприклад, при атмосферному осадженні або внесенням добрива), то поглинання рослинами NH 4 +, що супроводжується виділенням Н +, має підкислювальну дію. У грунтах з рН більше 5,5 велика частина неорганічного азоту відбувається у вигляді NO 3 -, який виробляється окисленням NH 4 + в процесі нітрифікації (глава 5). Нітрифікація здійснюється бактеріями Nitrosomonas і Nitrobacter, які мають непереносимість кислотності. Окислення NH 4 + до NO 3 — генерує два Н + (рис. 19.2). Якщо NH 4 + походить від амоніфікації органічного азоту (який споживає по одному Н + для кожного виробленого NH 4 +), чистий ефект - виділення одного Н + для кожного NO 3 - виробленого з органічного азоту. Однак якщо NO 3 - потім поглинається коренем, один ОН - виводиться в грунт для підтримки електрохімічної нейтральності, що еквівалентно витраті одного Н +. У такому випадку чистий вплив на кислотність грунту дорівнює нулю. Фермерам і агрономам добре відомо, що додавання амонію в грунт може надавати сильно підкислюючий вплив. Це відбувається тому, що NH 4 + стає нітрифікованим в NO 3 -, що генерує велику кількість кислотності. Існує два основних типи входів амонію: обробка сільськогосподарських полів добривами, що містять неорганічний азот (наприклад, сечовину або аміачну селітру), та осадження газу NH 3 та NH 4 + з атмосфери.
- Цикл сірки. Значна частина сірки в ґрунті зустрічається в органічно зв'язаних формах. Мікробні процеси можуть перетворити цю органічну сірку в більш високо окислені сполуки, включаючи сульфіди та елементарну сірку, але якщо кисню багато, вони додатково окислюються до сульфату. В цілому при окисленні органічної сірки до SO 4 2- виділяється один еквівалент Н + на еквівалент SO 4 2- виробленого (це те саме, що два Н + на SO 4 2- SO 4 2- поглинається корінь, еквівалентна кількість ОН — виділяється для збереження електрохімічної нейтральності, тому немає чистого впливу на кислотність. Однак якщо атмосферне осадження викликає пряме введення SO 4 2- в грунт з подальшим поглинанням корінням рослин, чистий ефект - зниження кислотності. Крім того, якщо грунт має дефіцит кисню (анаеробний), як це зазвичай відбувається на вологих ділянках, то SO 4 2- може трансформуватися мікробами в сульфідне з'єднання, що призводить до споживання еквівалентної кількості Н + і зниження кислотності.
Реакції, пов'язані з циклом сірки, зазвичай мають менший вплив на кислотність ґрунту, ніж ті, що включають цикл азоту. Однак у певних ситуаціях цикл сірки є домінуючим. Наприклад, коли водно-болотна угіддя осушується, його раніше анаеробний осад стає аеробним. Це дозволяє бактеріям окислювати відновлені сульфідні сполуки в сульфат. Деякі осушені водно-болотні угіддя розвивають надзвичайно кислий стан, відомий як кислотний сульфатний грунт. Протягом 10 і більше років після того, як відбувається дренаж, зазвичай для освоєння сільськогосподарських угідь, рН може бути нижче 3,0. Це сильно погіршує ріст врожаю, хоча кислотність можна нейтралізувати додаванням в грунт карбонату кальцію (вапна).
Іноді сульфідні мінерали, такі як пірит (сульфіди заліза), піддаються впливу атмосферного кисню. Це дозволяє спеціалізованим бактеріям Thiobacillus окислювати сульфіди, процес, який виробляє сульфатні та окислені іони заліза, відповідно до наступної реакції: 4 FeS 2 + 15 O 2 + 14 H 2 O → 4 Fe (OH) 3 + 16 H + 8 SO 4 2-
Це явище, відоме як кислотно-шахтний дренаж (або як кислотно-гірський дренаж), викликає сильне закислення ґрунту та поверхневих вод. Це може спричинити розвиток рН менше 2,0, з високими концентраціями сульфату та токсичних іонів алюмінію та заліза. Кислотно-шахтний дренаж є важливою проблемою, коли видобуток вугілля та металу піддав впливу мінеральних сульфідів в атмосферу (див. Докладно 19.3).
- Поглинання основних катіонів рослинами. Наземні рослини отримують багато своїх поживних речовин, поглинаючи іони з грунту, в якому вони ростуть. (Однак кілька поживних речовин поглинаються в основному з атмосфери, особливо СО 2.) Кальцій, магній та калій є важливими поживними речовинами, які поглинаються з ґрунту у вигляді катіонів (Ca 2+, Mg 2+ та K+), поглинання яких компенсується вивільненням Н +. У природних екосистемах поглинені Ca 2+, Mg 2+ і K+ з часом повертаються в грунт з рослинною підстилкою, тому довгострокового впливу на кислотність грунту немає. Однак, якщо біомасу видаляють з ділянки, як це відбувається в сільському і лісовому господарстві, ці катіони видаляються, в результаті чого відбувається закислення грунту.
- Вимивання іонів. У більшості ґрунтів аніони нітрат і хлорид легко вимиваються вниз в грунтові води. Вони роблять це тому, що добре розчиняються у воді, і лише слабо утримуються в місцях аніонообміну на органіці і глині. Вилуговані аніони можуть врешті-решт досягти поверхневих вод, таких як струмки та озера. Це стосується і сульфату, особливо на відносно молодих ґрунтах заледенених регіонів, включаючи більшу частину Канади (старі ґрунти більш південних регіонів часто мають більшу здатність утримувати сульфат). У районах з великими витратами підкислювальних речовин кількість NO 3 - і SO 4 2- в ґрунті може бути достатньо високою, щоб призвести до значних темпів вилуговування. Оскільки ці аніони вимиваються з ґрунту, вони супроводжуються такими катіонами, як Ca 2+, Mg 2+, H + та Al 3+, що призводить до підкислення, втрати поживних речовин та токсичності (пов'язаної з Al 3 +) у наземних та водних екосистемах. Наприклад, один контрольований вододіл у південно-центральній частині Онтаріо було виявлено, що втратив 30% ґрунтового кальцію між 1983 та 1999 роками (Watmough and Dillon, 2004).
Атмосферне осадження і грунт
Потенційний вплив атмосферного осадження на кислотність ґрунту вивчався в експериментах, в яких імітовані розчини дощової води додавалися до ґрунту, що міститься в пластикових циліндрах, відомих як лізиметри. Ці експерименти показали, що надзвичайно кислі розчини можуть викликати ці зміни хімії ґрунту:
- підвищення кислотності
- посилене вимивання кальцію, магнію та калію, що призводить до їх виснаження та більшої вразливості ґрунту до підкислення
- підвищена солюбілізація іонів токсичних металів, особливо алюмінію, а також заліза, марганцю та ін.
- переважна здатність грунту поглинати сульфат, після чого цей іон вільно вимивається, зі швидкістю, аналогічною його введенню (оскільки SO 4 2- є аніоном, його вимивання супроводжується катіонами основи і токсичними Al 3+ і H +, що може сприяти підкислення і токсичність поверхневих вод.)
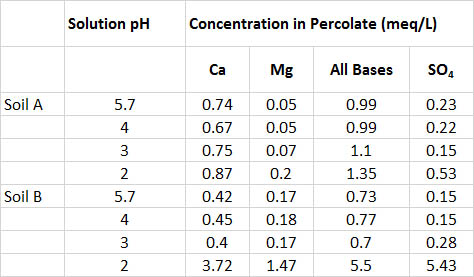
Один експеримент передбачав обробку піщаного ґрунту з соснових насаджень домкрата імітованою дощовою водою, відрегульованою сірчаною кислотою до рН 5,7, 4,0, 3,0 або 2,0 (табл. 19.4). Навіть обробка екстремально кислим рН 2,0 мало впливала на кислотність ґрунту, а перколяційні розчини мали рН вище 6,5 у всіх обробках. Однак вилуговування Ca, Mg, загальних підстав (Ca+ Mg+ K+ Na) та сульфату було набагато вищим при обробці pH 2.0. Загалом, цей експеримент виявив, що ґрунт був досить стійким до впливу кислотного навантаження. Зрештою, однак, стійкість можна було подолати обробкою висококислими розчинами і, можливо, тривалим впливом більш помірної кислотності. Майте на увазі, що такі експерименти є короткостроковими дослідженнями, тоді як підкислення ґрунту в природі є повільним, довгостроковим процесом.
Дослідники, які контролюють хімію ґрунтів у певних місцях поля, можуть визначити, чи відбулося підкислення, хоча такі дослідження не обов'язково виявляють причини зміни. Наприклад, перетворення сільськогосподарських угідь у хвойний ліс зазвичай призводить до підкислення ґрунту. На півдні Онтаріо лісонасадження покинутих сільськогосподарських угідь сосною або ялиною призвело до закислення ґрунту від рН 5,7 до рН 4,7 після 46 років розвитку лісу (Brand et al., 1986). Менш зрозуміло, чи стануть вже лісисті ділянки більш кислими через атмосферні надходження підкислюючих речовин. Дослідження в південному Онтаріо повторно відібрали лісові ґрунти після 16-річного інтервалу, в регіоні, де середній рН опадів становить близько 4,1, але подальшого підкислення ґрунту не спостерігалося (Linzon and Temple, 1980).
Загалом, дослідження, проведені в інших країнах Канади, а також в США та Європі, також прийшли до неоднозначних висновків щодо впливу атмосферного осадження на підкислення ґрунтів. За винятком випадків, коли атмосфера сильно забруднена SO 2, наприклад, поблизу металургійного заводу, немає переконливих доказів того, що атмосферне осадження має підкислений ґрунт у широкому масштабі. Схоже, що підкислення ґрунту є потенційним довгостроковим ризиком, пов'язаним з цим типом забруднення.
Наземна рослинність
Численні дослідження продемонстрували, що рослини можуть бути травмовані обробкою імітованими «кислотними дощами». Однак майже у всіх дослідженнях рН, який спричинив гострі травми, був більш кислим, ніж зазвичай виявляється в атмосферних опадах.
Наприклад, експерименти в Норвегії піддавали молодим хвойним стендам імітації кислотних дощів протягом трьох років (Tveite, 1980). Контрольна обробка становила рН 5,6-6,1, тоді як підкислені обробки використовували рН 4,0 або 3,0. В середньому контрольні саджанці сосни (Pinus contorta) виросли на 15-20% менше, ніж рослини, які отримували кислотні обробки. Зростання сосни скотча (P. sylvestris) та берези (Betula pendula) також стимулювався кислотними обробками, тоді як ялина (Picea abies) не постраждала. Однак наземна рослинність, де переважає мох, була сильно пошкоджена найбільш кислою обробкою (рН 3,0).
Лабораторні експерименти також корисні для визначення впливу рН дощової води на рослини, оскільки умови навколишнього середовища можна добре контролювати. В цілому такі експерименти не знаходять зниження зростання до тих пір, поки рН не стане більш кислим, ніж приблизно 3,0 (для порівняння середня кислотність опадів становить близько рН 4,0 в регіонах, де кислотні дощі вважаються серйозною проблемою). Більше того, продуктивність деяких толерантних видів може стимулюватися дощовою водою навіть більш кислою, ніж рН 3,0. Наприклад, саджанці білої сосни (Pinus strobus) росли швидше при впливі кислого туману в діапазоні від pH 2,3 до 4,0, ніж при рН 5,6 (Wood and Bormann, 1976). В іншому експерименті саджанці 11 порід дерев обробляли розчинами різних рН, але гостра травма листя була викликана тільки після тижня обробки при рН 2,6, що є неприродно кислим впливом (Percy, 1986).
Загалом, здається, що дерева та інші судинні рослини мають невеликий ризик зазнати гострої травми від впливу атмосферних кислотних дощів. Однак стреси, пов'язані з кислими опадами, можуть зменшити ріст рослин навіть за відсутності гострих травм. Ці «приховані травми» (див. Розділ 16) можуть бути спричинені тонким порушенням метаболізму рослин або опосередковано змінами хімії ґрунту. Оскільки кислі опади впливають на великі регіони, навіть невелике зниження продуктивності рослин може мати важливі економічні та екологічні наслідки.
Приховані травми, якщо вони все-таки трапляються, найбільш актуальні для лісової та інших видів природної рослинності. Сільськогосподарські землі підкислюються здебільшого завдяки практикам управління, таким як врожай та використання азотних добрив. Більш того, сільськогосподарський грунт регулярно обробляється вапнуючими засобами для зниження її кислотності.

Ряд досліджень у Східній Північній Америці та Європі вивчали потенційний вплив кислих опадів на продуктивність лісів. Хоча види дерев у деяких регіонах показали недавнє зниження продуктивності, остаточно не було продемонстровано, що ці зміни були спричинені кислими опадами або іншими видами забруднення атмосфери. Продуктивність лісу природним чином зменшується в міру дозрівання стенду, головним чином тому, що закриття навісу посилює конкуренцію серед дерев. На продуктивність лісів також впливають такі фактори, як зміна клімату і практика управління. Поки що польові дослідження не чітко відокремлювали жодного впливу кислих опадів на продуктивність лісів від наслідків, пов'язаних із спадкоємством, зміною клімату, дефоліацією комах або іншими факторами. Однак деякі дослідження, що моделюють зростання, припускають, що продуктивність може знизитися на 10% у східній Канаді, якщо критичні темпи осадження сульфату та нітратів перевищуються (Natural Resources Canada, 1998).
Зрозуміло, що вплив підкислюючих відкладень на грунт і рослинність дещо неоднозначне. Однак, як покаже наступні розділи, вплив на вразливі прісноводні екосистеми може бути серйозним.
Поверхневі води
Поверхневі води включають струмки, річки, озера та ставки. На їх хімію впливають типи грунту і рослинності в вододілі, кліматичні фактори, відкладення хімічних речовин з атмосфери.
У регіонах, де зими холодні і накопичується сніговий пакет, весняна тала вода, яка впадає в струмки та озера, має тенденцію бути відносно кислою. Це так зване явище кислотного шоку відбувається частково тому, що сніготанення не може просочитися в мерзлий грунт, тому його кислотність не нейтралізується взаємодією з там мінералами. Крім того, початкові талі води значно більш кислі, ніж більш пізні фракції. Відносно інтенсивна кислотність танення снігу відповідає за більшу частину токсичності уражених поверхневих вод.
Хімія води двох озер в районі Нової Шотландії, яка піддається кислотним опадам, описана в таблиці 19.5. Ці озера більш розріджені, ніж більшість прісних вод, в сенсі мають низьку концентрацію розчинених іонів, а їх запас поживних речовин розріджений, тому вони непродуктивні (оліготрофні). Тим не менш, ці озера мають більш високі концентрації розчинених речовин, ніж опади, що випадають на них - їх загальні іони в середньому 440 мкекв/л, порівняно з 135 мкекв/л в опадах. Більш високі концентрації обумовлені речовинами, які вимиваються з наземного грунту і з часом мігрують у воду озера. Навпаки, концентрації аміаку та селітри вищі в опадах, ніж в озерах, що свідчить про те, що атмосферні надходження цих поживних речовин «споживаються» біологічним поглинанням у вододілі.
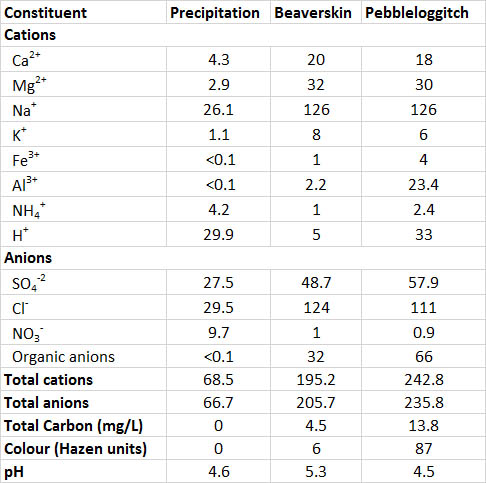
Озеро Бобров слабокисле (рН 5,3) і оліготрофне, з дуже прозорою водою. Для порівняння, на озеро Галькоггіч впливає дренаж з прилеглого болота. Розчинені органічні сполуки (відомі як фульвокислоти) стікають з болота в озеро, надаючи озерній воді темно-коричневий колір і кислотність (рН 4,5), подібну до опадів. Хоча ці два озера розташовані лише в 1 км один від одного, вони помітно відрізняються кислотністю через органічні кислоти в чайному кольорі галькового озера. Взагалі води, що впливають на болото, є природним кислим, зазвичай з кислотністю рН 4,0-5,0.

Підкислення поверхневих вод
Широке підкислення поверхневих вод у східній Канаді пояснюється відкладенням підкислюючих речовин з атмосфери. Схід Сполучених Штатів і Скандинавії також постраждали таким чином.
Обстеження поверхневих вод було проведено Агентством з охорони навколишнього середовища в США (Baker et al., 1991). У національному зразку з 28 300 озер 1180 були кислими, більшість з яких знаходяться в східних штатах. Вважалося, що атмосферне осадження підкислювало 75% кислих озер, тоді як 3% постраждали від кислотно-шахтного дренажу та 22% - кислотності з боліт. З 64 300 відбірних потоків 4670 були кислими, з яких 47% підкислені атмосферним осадженням, 26% - кислотно-шахтним дренажем, 27% - болотами. Флорида має найвищу частоту кислих озер, в основному через органічні кислоти з природних водно-болотних угідь. Вплив атмосферного осадження є найбільш важливим у північно-східних штатах, особливо в горах Адірондак, де 10% озер мають рН ≤5,0, а 20% мають рН ≤5,5.
Хоча таке всебічне обстеження стану озер і струмків в Канаді не проводилося, підкислені поверхневі води, як відомо, поширені, особливо в східних провінціях. Було підраховано, що в Онтаріо, Квебеку та Атлантичних провінціях існує понад 14 000 кислих озер (Environment Canada, 1996). Чутливість поверхневих вод до підкислення пов'язана з кількістю лужності в їх воді, що саме по собі пов'язано з кількістю кальцію і магнію в грунті і породах вододілу (див. Наступний розділ). Поверхневі води на 46% площі суші Канади (близько 4,0 мільйона квадратних кілометрів) вважаються високочутливими до підкислення осадження, а ще 21% (1,8 млн км 2) помірно чутливими.
Хімічні та біологічні зміни, що відбуваються у міру підкислення поверхневих вод, були вивчені у важливих дослідженнях, в яких сірчана кислота навмисно додавалася до озер (Schindler, 1990). Ці експерименти з цілим озером проводилися в районі експериментальних озер (ELA) північно-західного Онтаріо. Найбільш інтенсивно вивчене озеро, назване озеро 223, є оліготрофним водоймою 279 га. Озеро 223 вивчалося протягом двох років, перш ніж було експериментально підкислено, а потім протягом ряду років після цього. Починаючи з 1976 року, сірчана кислота була додана для підкислення озера, яка зменшила його рН з 6,5 спочатку до 5,0-5,1 протягом 1981-1983 років. Тоді його кислотність дозволили знизити до рН 5,5-5,8 протягом 1984-1988 років.
Як і очікувалося, концентрації сульфатних і водневих іонів збільшилися в озері 223, оскільки вони були додані до озера. Сульфат в середньому становив 35 мкмоль/л в 1975 році, порівняно з 115 мкмоль/л у 1979 році. Підвищення концентрації марганцю (на 980% збільшення до 1980 року), цинку (550%) та алюмінію (155%) відбулося через те, що ці хімічні речовини розчинялися з осаду в підкислених умовах. Закислення також призвело до того, що вода стала більш прозорою, що дозволило збільшити проникнення світла і більш глибоке нагрівання протягом літа. Багато біологічних змін також відбулося; вони описані далі в цьому розділі.
Детально 19.3. Кислотно-гірський дренаж.
Дренаж кислотно-гірських порід (ARD; також відомий як кислотно-шахтний дренаж) відноситься до потоків води, які були сильно підкислені окисленням піриту та інших мінералів із зменшеною сіркою. АРД зазвичай передбачає забруднення, пов'язане з видобутком вугілля, але це також може бути пов'язано з видобутком металу. Кислотність виробляється шляхом впливу піритичних мінералів, як правило, сульфіду заліза, атмосферним киснем, що дозволяє спеціалізованим бактеріям Thiobacillus окислювати сульфіди і виробляти сульфатні та окислені іони заліза наступним чином: 4 FeS 2 + 15 O 2 + 14 H 2 O → 4 Fe (OH) 3 + 16 Н + 8 СО 4 2-
Зверніть увагу на велику кількість Н +, які виробляються - це може призвести до сильно кислих умов у воді, що стікає з субстратів, де відбуваються реакції. Насправді, кислотно-шахтний дренаж зазвичай призводить до рН менше 2,0, поряд з високими концентраціями сульфату та токсичного алюмінію, заліза та марганцю. Якщо АРД пов'язаний з гірською породою або хвостами видобутку металів, він також може бути багатим токсичною міддю, нікелем або іншими важкими металами.
Коли потік стікає від джерела ГРЗ, він взаємодіє з нейтралізуючими мінералами, а також може отримувати приплив некислої води. Вони призводять до зниження кислотності, тому рН поступово збільшується. Після того, як рН відновлюється понад 3,0, розчинене залізо виходить з розчину у вигляді жовто-оранжевого осаду Fe (OH) 3, іноді відомого як «жовтий хлопчик». Коли жовтий хлопчик осідає над руслом потоку, він може задушити організми, що живуть знизу.
Скрізь, де це відбувається, дренаж кислотно-гірських порід є серйозною екологічною проблемою, головним чином тому, що він настільки токсичний для водних мешканців. Отже, докладаються зусилля, щоб запобігти ГРЗ у джерела, або лікувати його після того, як це сталося. У Канаді робота над вирішенням ARD зосереджена в рамках програми нейтрального дренажу шахтного середовища (MEND) Natural Resources Canada. Було підраховано, що загальна «відповідальність» від ARD еквівалентна $2-5 млрд, якщо проблеми не розглядаються.
Там, де це можливо, доцільно уникати ГРЗ, запобігаючи впливу сульфідносних порід в атмосферу. Металеві шахти та будівельні галузі часто досягають цього шляхом зберігання сульфідних хвостів під водою. Однак є ще багато випадків, коли вони викликають ГРЗ і потребують лікування, щоб зменшити його токсичність. Звичайним способом пом'якшення ГРЗ є додавання вапнувального агента, такого як вапняк (CaCo 3) або вапно (Ca (OH) 2), який нейтралізує вміст кислоти. У кількох випадках для вирішення проблеми були побудовані «штучні водно-болотні угіддя»: ARD вводиться на одному кінці водно-болотних угідь і виходить на іншому, причому значна частина його кислотного вмісту споживається мікробами, що живуть в анаеробному осаду. Це відбувається тому, що сульфатні іони (SO 4 2-) стають хімічно відновленими до сульфідів, таких як сульфід заліза (FeS 2) або сірководень (H 2 S). Ці реакції споживають кислотність, а також спричиняють осад токсичних іонів металів з розчину.
Вразливість до підкислення
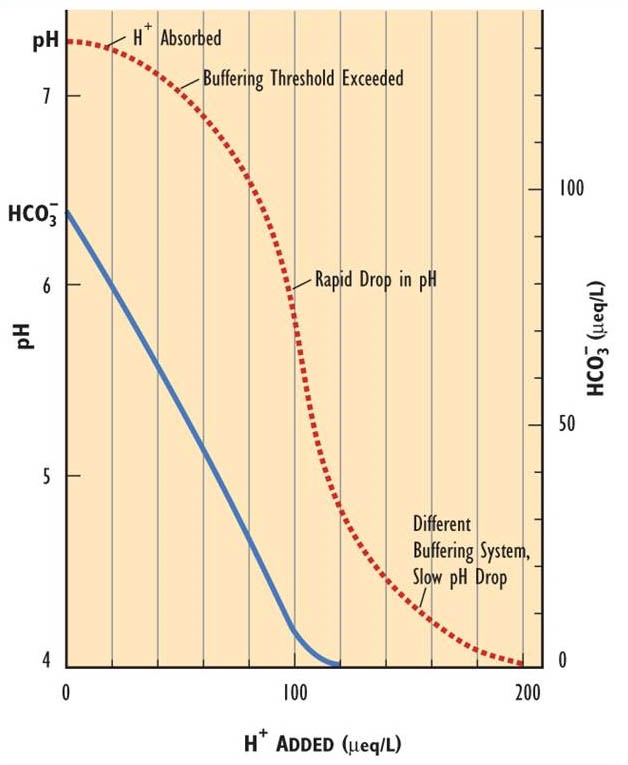
Поверхневі води, вразливі до підкислення, мають низьку лужність, або кислотно-нейтралізуючу здатність. Оскільки H + додається до води, вона поглинається кислотно-нейтралізуючими реакціями до тих пір, поки не буде перевищена здатність нейтралізувати кислоту. Після цього відбувається швидке зниження рН, поки не вступить в дію інша система буферизації (рис. 19.3). Лужність бікарбонату (HCO 3 -) є критичною системою буферизації в окружно-нейтральному діапазоні рН 6,0-8,0. Коли буферна здатність наявного HCO 3 — виснажується, вода швидко підкислюється. Бікарбонат вступає в реакцію з Н + з утворенням H 2 O + CO 2. Оскільки ця реакція нейтралізує доданий Н +, рН не змінюється, поки лужність не вичерпається.
На концентрацію бікарбонату в природних водах впливають геохімічні фактори, особливо наявність вапняку (CaCo 3) або доломіту (Ca, MgCo 3) в грунті або фундаменті вододілу або у водному осаду. У міру розчинення цих мінералів вони створюють бікарбонатну лужність і надають воді ступінь кислотно-нейтралізуючої здатності. Якщо багаті карбонатом мінерали рясні у вододілі, вони можуть генерувати достатню лужність, щоб нейтралізувати підкислюючі входи з атмосфери. Як результат, поверхневі води в цих видах вододілів не чутливі до підкислення навіть в регіоні, де атмосфера і опади забруднені (за винятком, можливо, випадків надзвичайно високих темпів сухого осадження SO 2).
Однак ситуація інша у вододілах, в яких основа, грунт та осад походять з твердих, погано розчинних порід, таких як граніт, гнейс та кварцит, які містять мало карбонатних мінералів. Вододіли цього типу мають невелику здатність генерувати лужність і тому вони легко підкислюються вологими і сухими відкладеннями з атмосфери. Вразливі вододіли особливо поширені у східній Канаді, де тонкі ґрунти, отримані з бідних карбонатами льодовикових, до зазвичай перекривають тверду гранітну породу.
Надводні озера та струмки піддаються особливому ризику підкислення. Ці системи не отримують дренажу з водойм на більш високій висоті, а їх вододіли зазвичай невеликі. Отже, для дощової води мало можливостей взаємодіяти з грунтом і основою, і значна частина кислотності в опадах не нейтралізується до того, як вода досягне верхівки озер і струмків.
На великій висоті в багатьох гірських районах гранітна кора піддається ерозії, і місцевість в таких регіонах також може бути вразливою до підкислення. Це стосується частин Скелястих гір західної Північної Америки та в Аппалачах східних Сполучених Штатів. Знову ж таки, вразливість виникає тому, що граніт сприяє невеликій лужності поверхневих вод.
Однак у вразливому регіоні навіть невелика кишеня багатого кальцієм ґрунту у вододілі може забезпечити достатню лужність, щоб дозволити водоймі протистояти підкисленню. Наприклад, 15 озер були обстежені в районі докембрійського щита на півдні Онтаріо, де опади досить кислі (Dillon et al., 1977). Чотирнадцять озер мали невелику лужність (95-175 мкекв/л), були слабокислими (рН 5,8-6,7) і вважалися дуже вразливими до підкислення. Однак одне озеро мало багаті кальцієм до свого вододілу. Це озеро мало високу лужність (1200 мкекв/л) і високий рН (7,1), і воно навряд чи підкислюється.
Пов'язаним питанням є поступова втрата кальцію і магнію з наземного вододілу через тривалі періоди вимивання кислими підземними водами. Зрештою, постачання цих катіонів також виснажується в оліготрофних потоках та озерах з природним розбавленням концентрацій іонів, які поширені в регіонах гранітної основи, таких на докембрійському щиті. Виснаження кальцію та магнію являє собою виснаження кислотно-нейтралізуючої здатності водойми, і це фізіологічна проблема для організмів, яким потрібна велика кількість цих катіонів для формування їх оболонок карбонату кальцію (наприклад, мідій) або хітину (полісахариду, отриманого глюкозою, який потребує кальцій для затвердіння). Виникнення водного остеопорозу було продемонстровано в озерах на сході Канади, і додаткові дослідження, ймовірно, покаже, що це широко поширена проблема (Jeziorski et al., 2008).
Прісноводні організми
Багато змін відбувається в біоті, коли прісноводні екосистеми підкислюються. Загалом, прісноводні організми значно більш чутливі до підкислення свого середовища існування, ніж наземні рослини.
Прісноводні водорості
Багато видів мікроскопічних одноклітинних водоростей (фітопланктон) мешкають в озерах. Хімія води сильно впливає на конкретні види, які присутні. Оскільки види діатомових водоростей (сімейство Bacilliarophyceae) і золотисто-бурі водорості (Chrysophyceae) особливо чутливі, вони є корисними показниками хімії води. Наприклад, дослідження 72 озер в районі Садбері виявило, що певні види діатомів були показниками окремих аспектів хімії води (Dixit et al., 1991):
- показники кислої води: Eunotia pectinatus, Fragilaria acidobiontica, Pinnularia subcapitata, Tabellaria quadriseptata
- показники кислої води з високими металами (Cu, Ni): Eunotia exigua, E. tenella, Frustulina romboides saxonica, Pinnularia hilseana
- показники некислої води: Achnanthes lewisiana, Cyclotella meneghiniana, Fragilaria construens, F. crotonensis Багаті кремнеземом клітинні стінки діатомових водоростей відрізняються за формою для кожного виду, і вони зберігаються в озерному осаду після загибелі клітини. Також відомі вимоги до хімії води багатьох видів діатомів. Отже, велика кількість діатомових скам'янілостей у застарілих шарах ядер озер може бути використана для висновку історичних спільнот та хімії води. Цей метод був використаний, щоб продемонструвати, що деякі в даний час кислі озера на сході Канади не були кислими ще недавно, як кілька десятиліть тому.
Спільнота фітопланктону помітно змінилася під час підкислення озера 223 в районі експериментальних озер (Findlay and Kasian, 1986). Спочатку в ньому переважали види золотисто-бурих водоростей, але з підкисленням це змінилося на зелені водорості (Chlorophyceae). Хоча видовий склад істотно змінився, різниці в різноманітності видів було мало. Невелике збільшення біомаси водоростей відбулося в результаті підкислення, ймовірно, викликане підвищенням прозорості води, що дозволило досягти більшої продуктивності. Коли озеру 223 було дозволено стати менш кислим, види водоростей, характерні для спільноти попереднього закислення, швидко з'явилися знову.
Однак фітопланктонне співтовариство набагато більш чутливе до родючості води, ніж до зміни її кислотності, особливо реагуючи на фосфор (див. Главу 20). Насправді продуктивність практично всіх прісних вод збільшується, якщо їх удобрювати фосфором. Ця екологічна зміна, відома як евтрофікація, також відбувається в кислих водоймах. Це ілюструється дослідженнями двох сусідніх озер у Новій Шотландії, Літтл Спрінгфілд і Дренаж. Після будівельної діяльності в їх вододілах піддаються пірит-містять мінерали в атмосферу, обидва озера стали висококислими через процес, подібний до кислотно-шахтного дренажу (Kerekes et al., 1984). Маленьке озеро Спрінгфілд мало рН 3,7 і підтримувало невелику продуктивність водоростей - воно було оліготрофним. Однак Дренажне озеро (рН 4,0) отримало багаті фосфором стічні води, і воно стало евтрофічним і високопродуктивним, незважаючи на свою кислотність.
Перифіти - це мікроскопічні водорості, які мешкають на поверхні осаду, гірських порід, деревного сміття та водних рослин. Спільнота перифітонів може включати сотні видів навіть у кислих озерах. Перифіти особливо рясні в озерах з прозорою водою, включаючи кислі, де на їх біомасі пізнього літа можуть утворитися каламутні або повстяні килимки. Під час підкислення озера 223 донний мат ниткоподібних зелених водоростей Mougeotia розвинувся на мілководді після того, як рН знизився нижче 5,6. Причини зростання водорослевих матів невідомі, але вони могли бути обумовлені зменшенням випасу худоби безхребетними.
Акваріумні Рослини
Водні рослини (або макрофіти) можуть бути в достатку в мілководних озерах і ставках. Закислення деяких озер призвело до збільшення водних мохів, особливо видів сфагнуму. У деяких випадках це супроводжувалося зниженням інших рослин, таких як очерет (Phragmites communis), водна лобелія (Lobelia dortmanna) та квіллетка (Isoetes spp.). Більш того, інвазія сфагнумом може інтенсивно підкислювати, оскільки ці мохи мають високу ефективність при поглинанні Ca 2+, Mg 2+ та інших катіонів з води, які вони обмінюють на H +. Мати сфагнуму також перешкоджають хімічним реакціям на межі межі осадок/вода, що перешкоджає нейтралізації відбувається там кислотності.
Спільноти водних рослин сильно відрізняються між кислотними озерами з чистою водою та тими, у яких органічно забарвлена вода. Наприклад, озеро Галькоггіч (табл. 19.5) має темно-коричневу кислу (рН 4,5) воду, що перешкоджає проникненню світла в більш глибокі місця проживання. Отже, водні рослини можуть рости тільки в межах мілководної облямівки навколо краю озера, і тільки 15% дна є рослинним (Stewart and Freedman, 1989). Найбільш поширені макрофіти, такі як жовта латаття (Nuphar variegatum), мають плаваючі листя. Для порівняння, довколишнє озеро Біверскін має надзвичайно прозору воду і практично все дно отримує достатньо світла для підтримки водних рослин навіть на глибину 6,5 м. багато макрофіти, включаючи мати сфагнуму, підтримують всю свою листя під водою.
Навіть в кислих озерах продуктивність макрофітів стимулюється додаванням поживних речовин. Дренажне озеро (згадане вище) є надзвичайно кислим (рН 4,0), але евтрофним озером, з пишною продуктивністю водних рослин. Як і у випадку з фітопланктоном, родючість води набагато більше впливає на продуктивність водних рослин, ніж кислотність.
зоопланктон
Зоопланктон - це крихітні тварини, переважно ракоподібні, які мешкають у товщі води. Більшість зоопланктерів фільтрують-харчуються клітинами фітопланктону, але деякі є хижаками. Деякі види толерантні до кислотності і можуть зустрічатися у воді з рН 4,0 або менше. Вплив підкислення на зоопланктон є складним, оскільки беруть участь кілька факторів:
- токсичність Н + і металів, таких як Al 3+
- зміни в доступності фітопланктону в якості їжі
- зміни хижацтва, особливо якщо ліквідується зоопланктоноїдна риба
Опитування 47 озер в Онтаріо показало, що певний зоопланктон є хорошими показниками хімії води (Sprules, 1975). Показником видів кислих озер з рН < 5,0 були Daphnia catawba, D. pulicaria та Polyphemus pediculus. Інші відбулися лише при рН> 5,0: Дафнія амбігуа, D. galeata mendotae, D. longiremis, D. retrocurva, Diaptomus oregonensis, Epischura lacustris, Leptodora kindtii та Тропоциклоп прасинус мексиканський . Однак деякі зоопланктори були байдужі до кислотності і відбувалися в широкому діапазоні рН. Наприклад, Diaptomus minutus був найбільш часто спостережуваним видом, зустрічається понад рН від 3,8 до 7,0. Кислі озера мали дещо розбійне співтовариство зоопланкторів - ті, хто має рН < 5.0 had 1-7 species with only one or two dominant being dominant, while lakes with a pH > 5,0, мали 9-16 видів, з трьома або чотирма домінуючими.
Експериментальне підкислення озера 223 призвело до збільшення кількості зоопланктону, ефект, який пояснювався збільшенням їх їжі біомаси фітопланктону (Malley et al., 1982). Протягом усього підкислення Diaptomus minutus і Cyclops bicuspidatus залишалися найпоширенішими зоопланкторами, але деякі інші види були нетерпимими. Сюди входила креветка опосум (Mysis relicta), великий хижак, який зник, коли рН знизився нижче 5,6.
Бентичні Безхребетні
Бентосні безхребетні живуть на або в осадах водойм. Кількість видів, як правило, нижче в кислих водах, але їх все одно може бути в достатку, особливо це хижі риби зникли. Найбільш поширеними донними безхребетними в кислих озерах є види комах і ракоподібних (хоча інші види цих груп непереносимі кислотності). Молюски не зустрічаються в сильно кислих умовах, оскільки їм важко підтримувати свою оболонку карбонату кальцію. Дослідження понад тисячі озер у Норвегії виявило, що жоден вид молюсків не може переносити рН нижче 6,0, а равлики нижче 5,2 (Okland and Okland, 1986).
Оскільки осад сильніше буферується, ніж його вищестояща вода, він набагато менш вразливий до підкислення. Наприклад, кислотність осаду не сильно змінилася під час експериментального підкислення озера 223 (Kelly et al., 1984). При рН води трохи вище осаду становив 5,3, при 0,5 см в осад він становив 6,0, а при 2,0 см - 6,7, незмінний від умови попереднього закислення. Оскільки середовище проживання донних безхребетних добре буферизована, деякі з них не сильно постраждали від підкислення вищерозташованої озерної води. Під час підкислення озера 223 велика кількість хірономідних мошок збільшилася і досягла максимуму при рН води близько 5,6 (Міллс, 1984). Однак спочатку рясні личинки мухи зникли при рН 5,0, а раки Orconectes virilis стали виведені через репродуктивну недостатність після того, як рН впав нижче 5,6.
Риба
Популяції риб є найвідомішими жертвами закислення. Багато втрат форелі, лосося та іншої економічно важливої риби сталися в підкислених водах Канади, США та Євразії.
Дослідження в Онтаріо задокументували втрату популяцій риб з підкислених озер в регіоні Кілларні (Beamish and Harvey, 1972; Harvey and Lee, 1982). Ця область схильна до сильнокислих опадів (рН 4,0-4,5) та сухого осадження підкислювального SO 2 через близькість до плавильних заводів у Садбері. Опитування в 1970-х роках показало, що 33 з 150 озер в районі Кілларні мали рН нижче 4,5. Ці екологи фактично контролювали місцеву екстирпацію кількох риб в озерах Люмсден і Джордж. Існували також анекдотичні докази втрат інших популяцій, оскільки місцеві жителі мали пам'ять про історичне спортивне рибальство в нині безрибних озерах. У районі Кілларні було 17 вилучення озерної форелі (Salvelinus namaycush), важливою спортивною рибою, яка не може розмножуватися при рН <5,5. Існують також екстирпації окуня (Micropterus dolomieiu) з 12 озер, озер великого рота (M. salmoides) і судака (Stizostedion vitreum) з чотирьох озер, і жовтий окунь (Perca flavescens) і рок-бас (Ambloplites rupestris) з двох озер.
Озеро Люмсден підкислене від рН 6,8 в 1961 році до 4,4 в 1971 році. Це підкислення призвело до репродуктивної недостатності та екстирпації озерної форелі, озерного оселедця (Coregonus artedii) та білої присоски (Catostomus commersoni). Коли Джордж Лейк досяг рН 4,8-5,3, озерна форель, судак, минь (Лота Лота) і Смолмут окунь зникли. У міру подальшого підкислення спостерігалися втрати північної щуки (Esox lucius), рок-окуня, гарбузового соняшника (Lepomis gibbosus), бурого булхеда (Ictalurus nebulosus) та білої присоски. Ці вилучення були наслідком стійких невдач цих риб розмножуватися в підкислених озерах.
Втрати популяцій спортивних риб також відбулися в Новій Шотландії, де атлантичний лосось (Salmo salar) був втрачений з кислих (рН нижче 4,7) річок, але не з річок з більш високим рН (рис. 19.4). Лакруа і Таунсенд (1987) писали молодий лосось у чотирьох кислих потоках у Новій Шотландії - жоден не вижив при рН нижче 4,7, але все це сталося при більш високих рН.
В іншому місці ранні обстеження (з 1930-х років) в горах Адірондак штату Нью-Йорк виявили, що струмок форелі (Salvelinus fontinalis) були присутні в 82% озер. Однак у 1970-х роках цей вид був відсутній у 43% з 215 озер того ж регіону (Schofield, 1982).
Широке обстеження 700 норвезьких озер у 1970-х роках показало, що форель (Salmo trutta) була відсутня в 40% водойм і розріджена в ще 40% (Wright and Snekvik, 1978). Майже всі ці озера підтримували форель до 1950-х років. Екстирпація популяцій форелі була найбільш обширною на півдні Норвегії, де підкислення відкладення найбільш інтенсивно.
У східній Північній Америці рибами, які найбільш терпимі до закислення, є жовтий окунь, рок-окунь, центральний бруд (Umbra limni), окунь великий рот, блакитний гілл (Lepomis macrochirus), чорний булхед (Ictalurus melas), коричневий булхед, золотистий шинер (Notemigonus crysoleucas) та американський вугор (Anguilla rostrata). Ці види зустрічаються в деяких водоймах з рН більш кислим, ніж 4,6. Інші види більш чутливі до підкислення і, як правило, потребують рН>6,0, щоб вижити.
До експериментального підкислення озеро 223 підтримувало озерну форель, білий присосок, жирний пісок (Pimephales promelas), перловий танець (Semotilus margarita) та слизовий скульптор (Cottus cognatus) (Mills et al., 1987). Садовий пісок був найбільш чутливим до підкислення, і він швидко знижувався, коли рН досяг 5,6. Репродуктивна недостатність озерної форелі почалася при рН 5,4, а білої присоски при рН 5,1, що призвело до зниження популяції, оскільки старша риба померла.
Загалом, молодші стадії життєвої історії (мальки та молодь) більш чутливі до кислотності, ніж дорослі риби. Ось чому більшість втрат населення пояснюється репродуктивною недостатністю, а не смертністю дорослих. Існує, однак, багато спостережень дорослих риб, які загинули внаслідок впливу кислотно-шокових подій під час танення снігу навесні.
У міру підкислення поверхневих вод збільшується концентрація розчинених металів, особливо Al 3+ і AlOH 2+, які є токсичними іонами алюмінію. У багатьох кислих водах токсичність алюмінію достатня для знищення риби, незалежно від будь-якого прямого впливу Н +. Загалом, виживання та ріст личинок риб та старі стадії життєвої історії зменшуються, коли концентрація розчиненого іонного алюмінію перевищує 0,1 проміле, експозиція, яка поширена в кислих водах. Однак у воді коричневого кольору майже всі розчинені алюміній та інші метали присутні як металоорганічні комплекси. Метали в такому стані набагато менш токсичні, ніж вільні іонні форми, що зустрічаються в прозорій воді з подібною кислотністю.
Земноводні
Земноводні залежать від водного середовища проживання протягом принаймні частини свого життєвого циклу. Більшість канадських видів відкладають свої яйцеклітини у воді, в якій живуть їх личинки до тих пір, поки не настане метаморфоза, після чого дорослі особини утилізують довколишнє наземне середовище проживання Дослідження показують, що деякі види земноводних вразливі до закислення свого водного середовища існування, а інші здаються байдужими.
Дослідження місць розмноження земноводних у Новій Шотландії, що охоплюють діапазон рН від 3,9 до 9,0, виявило, що на деякі види явно не впливала кислотність (Dale et al., 1985):
- бичак (Rana catesbeiana) стався від рН 4,0 до 9,0
- весняний підглядач (Hyla crucifer) і саламандра жовто-плямиста (Ambystoma maculatum) від рН 3,9 до 7,8
- зелена жаба (R. clamitans) від рН 3,9 до 7,3
- і деревної жаби (R. sylvatica), від рН 4,3 до 7,8.
Жовто-плямиста саламандра та зелені, бичачі, деревні та пікерельні жаби (R. palustris) мали яйця, розвиваючі личинки та дорослі особини, присутні в деяких місцях проживання при рН 4,0, що свідчить про те, що розмноження відбувається при цій надзвичайній кислотності. Дослідження в інших регіонах, однак, показали, що деякі види земноводних непереносимі кислотності.
Лабораторні експерименти з 14 видами земноводних виявили, що вплив яєць рН 3,7-3,9 спричиняло понад 85% ембріональної смертності, тоді як тривалий вплив рН 4,0 спричиняло рівень смертності > 50% (Freda et al., 1991). Слід мати на увазі, однак, що водний рН настільки кислий, як 4,0, є рідкістю в природі. Більш того, такі кислі умови зазвичай пов'язані з кислотно-шахтним дренажем або природними болотами, а не з підкисленням, викликаним атмосферним відкладенням (яке має поріг підкислення близько 4,5 або вище). В цілому, виявляється, що більшість видів земноводних менш вразливі, ніж риби, до страждання зниження популяції, викликаного закисленням.
Водні птахи
Безпосередньо токсичний вплив підкислення на водоплавних птахів та інших водних птахів не зафіксовано і, ймовірно, не відбувається. Однак підкислення призводить до зміни водних середовищ існування, і це має непрямі наслідки для популяції птахів. Наприклад, якщо підкислення усуне популяції дрібних риб, то постраждають водоплавні птахи, такі як гава (Gavia immer) та merganser (Mergus merganser), як і рибоїдні хижаки, такі як скопа (Pandion haliaetus). У той же час, однак, екстирпація хижих риб може призвести до збільшення кількості водних комах та зоопланктону, що покращує харчовий ресурс для інших водоплавних птахів, таких як крижень (Anas platyrynchos), чорна качка (A. rubripes), качка з кільцеподібною шиєю (Aythya collaris) та золотоглазка (Bucephala клангула).
Успіх селекції простокварів вивчався на 84 озерах Онтаріо (Alvo et al., 1988). Лише 9% спроб розмноження були успішними на озерах з низькою лужністю (< 40 мкекв/л), які є кислими або вразливими до підкислення. На відміну від цього, 57% спроб розмноження були успішними на озерах з лужністю 40-200 мкекв/л та 59%, якщо > 200 мкекв/л, ці спостереження, ймовірно, відображають розмір популяцій риб у цих озерах.
Дослідження 79 малих озер і ставків у Нью-Брансвік виявило більшу біомасу водних безхребетних у прибережній зоні (мілководна, прибережна) у кислих водоймах з рН 4,5-4,9, ніж у тих, у яких рН >5,5 (Parker et al., 1992). П'ять видів качок, які харчуються безхребетними, мали в середньому 3,5 виводка/га на водоймах з рН 5,5, в порівнянні з 0,65 виводками/га при більш високих рН. Більша біомаса безхребетних у кислих водоймах, ймовірно, була пов'язана зі зменшенням хижацтва через зменшення рибного співтовариства.
Дренажне озеро в Новій Шотландії раніше описувалося як висококисле (рН 4,0), але евтрофічне озеро. Дренажне озеро є безрибним, але має великі популяції водних безхребетних і рослин. Це середовище проживання дозволяє чорним качкам і кільцеподібним качкам бути більш продуктивними, ніж це характерно для озер регіону (Kerekes et al., 1984).
Меліорація
Ще до того, як підкислення стало гучним питанням, менеджери дикої природи в деяких регіонах «покращували» середовище існування для спортивних риб у коричневих озерах шляхом обробки кислої води порошкоподібним вапняком (карбонат кальцію, CaCo 3) або вапном (гідроксид кальцію, Ca (OH) 2). Ці процедури, відомі як вапнування, служать для зниження кислотності, прояснення води та підвищення продуктивності риби, такої як форель. Не дивно, що також були проведені значні дослідження щодо використання вапнування лікування для поліпшення стану озер та інших поверхневих вод, які були підкислені атмосферним осадженням.
Вплив вапнування на рН проілюстровано на малюнку 19.5 для трьох вапняних озер та одного еталонного (невапнованого, але кислого) озера в Онтаріо (Dillon et al., 1979; Yan et al., 1979). Спочатку оброблені озера мали рН 4,0-5,0, але це було збільшено до рН 7,0-8,0 шляхом лікування вапнування всього озера. Середній і Ханна Лейкс мали досить стабільний рН після обробки, але Лохі швидко дрейфував назад до кислого стану. Ця різниця відображає розміри вододілів озер - Лохи осушує відносно велику площу і швидко промиває, тому результати її нейтралізації коротше живуть. Відзначимо, що підживлення озер фосфатом, який стимулює продуктивність фітопланктону, також має кислотно-нейтралізуючу дію, хоча і набагато менше, ніж те, що виникло в результаті вапнування.
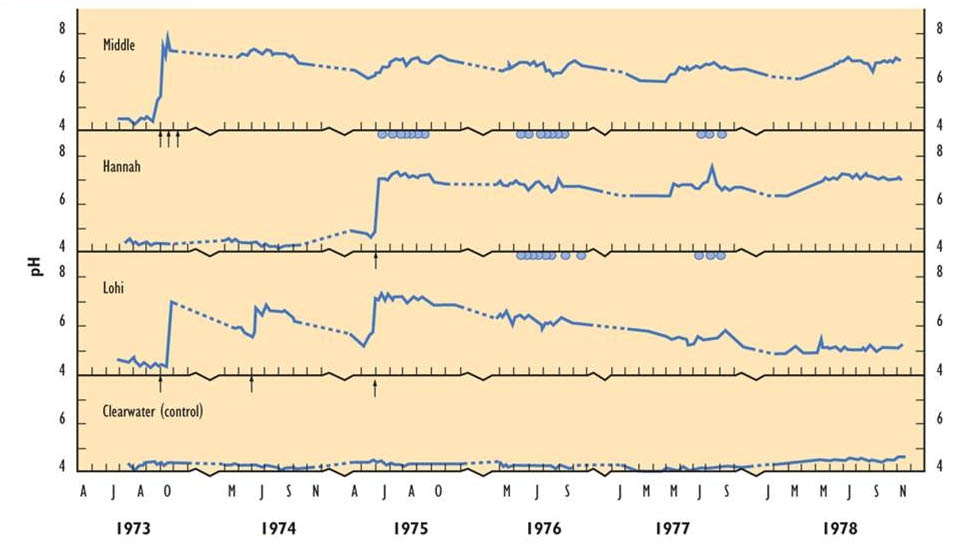
Спочатку оброблені озера мали велике зниження продуктивності фітопланктону і зоопланктону. Однак біомаса фітопланктону незабаром повернулася до стану попереднього вапнування, але з затяжними змінами видового складу. Зоопланктон відновлювався повільніше, і навіть через три роки не повернувся до превапнує достатку. Крім того, риба, що міститься в клітках в вапняних озерах, страждала високими показниками смертності. Це, ймовірно, було пов'язано з токсичністю металів, оскільки озера постраждали від випадання з плавильних заводів Садбері. Хоча водні концентрації Al, Cu, Ni та Zn зменшилися після вапнування, оскільки їх розчинність більша в кислої води, вони все ще залишалися досить високими, щоб стресувати рибу та іншу біоту.
У деяких регіонах Скандинавії вапнування зазвичай використовується для обробки великої кількості підкислених озер і річок. Це робиться для пом'якшення шкоди, спричиненої підкисленням, особливо популяціям риб. Наприклад, Швеція має найбільші в світі програми вапнування (Stensdotter et al., 2005). До кінця 1970-х років близько 17 тисяч озер в Швеції були підкислені атмосферним осадженням (із загальної кількості 90-тисяч озер), як і багато струмків і річок. З підкислених водойм понад 7500 озер і 14 000 км проточних вод обробляють вапнуючими засобами, щорічно використовується близько 200 тис. тонн порошкоподібного вапняку. Як правило, обробку вапнуванням необхідно повторювати на трирічному обертанні. У Норвегії вапнували близько 3000 водойм (State of the Environment Norway, 2008). Вапнування проводилося набагато менш широко в Північній Америці, багато в чому тому, що програми дорогі, а екологічні пріоритети відрізняються від Скандинавії.
Дослідження вапнування показали, що підкислені поверхневі води можуть бути нейтралізовані. Тим не менш, слід розуміти, що вапнування лікує симптоми пошкодження підкислених екосистем, але не причини закислення. Більше того, вапнування саме по собі являє собою екологічний стрес, який перетворює водойму з одного забрудненого стану в інший, який все ще пошкоджений, але менш токсичний. Вапнування спричиняє велику зміну кислотно-адаптованих екосистем, що супроводжується зміною кількості видів у міру розвитку нових спільнот. Загалом, найважливішою перевагою вапнування є те, що менш кислі води можуть підтримувати рибу, тоді як кислі води не можуть. Однак вапнування не є довгостроковим рішенням підкислення прісних вод. Частково це пов'язано з тим, що водні об'єкти необхідно періодично обробляти, оскільки вапнувальні матеріали витрачаються або вимиваються з системи.
Певною мірою підкисленими водоймами також можна керувати шляхом обробки їх добривами для стимулювання їх продуктивності, як це було раніше досліджено для Дренажного озера. Запліднені кислі озера можуть підтримувати велику біомасу фітопланктону, макрофітів та безхребетних. Водоплавні птахи можуть процвітати в цьому середовищі існування, навіть якщо риба не може бути витримана через кислі умови. Однак не обов'язково створювати велику кількість високопродуктивних озер. Наприклад, там, де рекреаційне плавання є важливим заняттям, рясні водорості і макрофіти вважаються неприємністю.

Скорочення викидів
Зрештою, великі збитки, спричинені підкисляючим відкладенням з атмосфери, можуть бути вирішені лише за рахунок зменшення викидів кислотоутворюючих газів. Хоча цей факт інтуїтивно зрозумілий, питання скорочення викидів залишається спірним з наступних причин:
- Вчені точно не знають, скільки викиди SO 2 та/або NO x повинні бути зменшені, щоб запобігти пошкодженню підкислюючим відкладенням.
- Можливі різні стратегії зменшення викидів, і вони різняться за своїми економічними наслідками. Чи було б ефективніше орієнтуватися на великі точкові джерела викидів, такі як електростанції та плавильні заводи, приділяючи менше уваги меншим, але численним джерелам, таким як автомобілі та домашні печі, що спалюють нафту? Або слід агресивно згортати як великі, так і малі джерела?
- Щоб бути ефективними, скорочення викидів повинно координуватися між сусідніми країнами. Наприклад, що станеться, якщо уряд однієї країни (можливо, з великими викидами SO 2 та NO x) не розгляне підкислення як пріоритетну проблему, але сусідні країни це роблять?
Не дивно, що галузі та регіони, які відповідають за великі викиди кислотоутворюючих газів, схильні протистояти введенню значних законодавчо скорочень їх викидів. Загалом, вони стверджують, що наукове обґрунтування скорочень ще не є переконливим, тоді як витрати на контроль, як відомо, великі та потенційно руйнівні для економіки.
Крім того, наскільки низькими повинні бути темпи атмосферного осадження сполук сірки та азоту, щоб уникнути подальшого підкислення чутливих поверхневих вод або дозволити їх відновлення? На критичні темпи осадження підкислюючих сполук частково впливає вразливість приймаючих екосистем - райони з неглибоким, бідним поживними речовинами ґрунтом можуть підтримувати набагато менші витрати підкислюючих речовин, ніж райони, багаті кальцієм. Вважається, що високочутливі озера на сході Канади мають порогові значення критичного навантаження <20 мэкв/га осадження сірки та азоту (рис. 19.6).
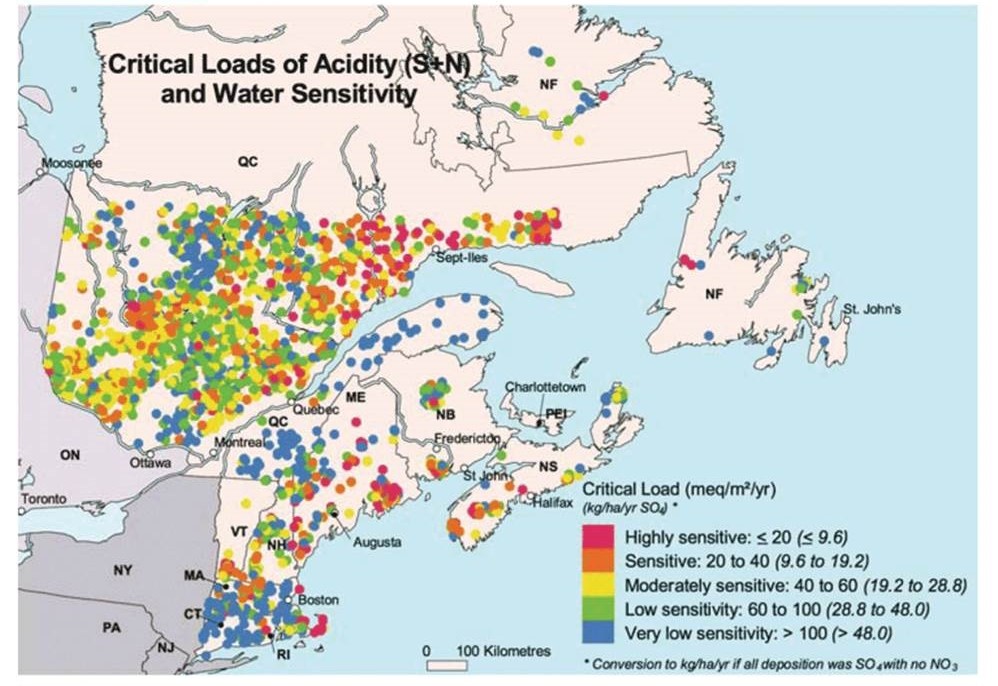
Хоча існує багато невизначеностей щодо конкретних причин та величини шкоди, спричиненої атмосферним відкладенням підкислюючих речовин, очевидно, що те, що йде вгору (викиди газів-попередників кислоти), має зрештою знизитися (як підкислююче осадження). Ця ідея здорового глузду підкріплена великою кількістю наукових доказів. Ці знання в поєднанні з обізнаністю громадськості та занепокоєнням щодо підкислення у багатьох країнах спонукали політиків почати вживати ефективних заходів. Це призводить до зменшення викидів SO 2 та NO x, особливо у відносно заможних країнах Північної Америки та Західної Європи.
У 1992 році уряди Канади та США підписали двонаціональну угоду, спрямовану на зменшення підкислювального осадження в обох країнах. Ця угода, відома як Угода про якість повітря між Канадою та США, вимагає великих витрат галузей та урядів, щоб суттєво скоротити викиди забруднювачів повітря, особливо SO 2. Ці скорочення є на вершині скорочення викидів, яких обидві країни вже досягли протягом 1980-х років. У Сполучених Штатах викиди SO 2 зменшилися з 23,1 млн т в 1980 році до 16,9 млн т в 1995 році і до 6,0 Мт в 2011 році, тоді як викиди NO x трохи збільшилися з 20,7 млн т в 1980 році до 21,8 млн т в 1995 році, а потім зменшилися до 13.6 Mt в 2011 (EPA, 2014; див. також Таблицю 16.2). Для порівняння, канадські викиди SO 2 зменшилися з 4,7 млн т у 1980 році до 2,5 млн т у 1995 році та до 1,3 млн т у 2012 році, тоді як викиди NO x залишалися приблизно такими ж протягом 1980 до 1995 року на рівні 2,4—2,6 млн т/рік, а потім знизилися до 1,9 млн т/рік у 2012 році (Environment Canada, 2014).

Основним компонентом ініціатив США щодо скорочення викидів SO 2, створених відповідно до Закону про чисте повітря 1990 року, є створення ринку для торгівлі викидами. По суті, будь-яка компанія, яка випускає SO 2 за ставкою, меншою, ніж це дозволено Агентством з охорони навколишнього середовища (EPA), має право продавати (або торгувати) ті невикористані «кредити» іншому бізнесу, який перевищує його цільовий показник викидів. Це важлива ініціатива, оскільки вона допомагає встановити «ринкову вартість» для викидів певних забруднюючих речовин, а також для інвестицій для зменшення їх викиду. З екологічної точки зору, цей ринок викидів є логічним інструментом, оскільки атмосфера є загальним ресурсом власності, який належить і впливає на кожен, тому будь-які зміни у викиді забруднюючих речовин (будь то збільшення чи зменшення) мають глобальний ефект. По суті, компанія, викиди якої менші, ніж її надбавка, може отримати прибуток, продаючи свої кредити, тоді як інша, яка перевищила свою мету, несе витрати. Ці витрати можуть бути оплачені або шляхом придбання кредитів на викиди або шляхом вжиття заходів щодо зменшення викидів, таких як встановлення технології видалення SO 2, перехід на паливо з низьким вмістом сірки, або, в крайньому випадку, закриття особливо брудних об'єктів.
Гнучкість, пов'язана з цими варіантами, розглядається багатьма економістами та політиками як важлива перевага системи торгівлі викидами. Тим не менш, створення ринку, який продає випуск SO 2, звільняє багато компаній від дорогих інвестицій, які будуть потрібні для досягнення відчутного скорочення їх викидів. Цей факт породив суперечки, як і потенційне створення глобального ринку для торгуваних викидів парникових газів відповідно до Кіотського протоколу (глава 17).
У будь-якому випадку, чи є скорочення викидів достатньо великими, щоб досягти передбачуваного ефекту запобігання та відновлення підкислення екосистем? Згідно з науковою оцінкою, проведеною Environment Canada, скорочення викидів SO 2 призвело до зниження темпів підкислення осадження в Канаді (на основі порівняння даних за 1990—1994 та 1996—2000; Environment Canada, 2005). Тим не менш, за оцінками, 21-75% східної Канади все ще отримує кількість підкислювального осадження, які перевищують критичні навантаження (менші цифри відповідають найкращому сценарію, а більші - гіршому). Навколишнє середовище Канади також припускає, що для захисту екосистем від подальшої шкоди, спричиненої підкислюючим осадженням, Канада та Сполучені Штати вимагатимуть ще 75% зменшення викидів SO 2, крім тих, які погоджені відповідно до існуючої Угоди про якість повітря. До подібного висновку прийшло Агентство з охорони навколишнього середовища США у власній науковій оцінці питання (2011 р.).
Крім того, не було вжито великих заходів для зменшення викидів NO x, і це, здається, працює проти екологічних переваг, пов'язаних із посиленням контролю SO 2. Дуже важливо, щоб майбутні регуляторні дії включали зменшення викидів як SO 2, так і NO x, і що кислотні дощі та його пошкодження навколишнього середовища продовжували контролювати.
Договір про забруднення повітря 1992 між Канадою та Сполученими Штатами є корисним досягненням. Хоча в деяких районах спостерігається зниження кислотності опадів та поверхневих вод, здається, що скорочення викидів SO 2 недостатньо велике, щоб повністю пом'якшити багато збитків, спричинених підкислювальним осадженням. Поки що на надзвичайно великі ділянки місцевості продовжують впливати підкислення, спричинене атмосферним відкладенням.
Удосконалення тенденцій хімії опадів та стічних вод у Хаббард-Брук, штат НХ, місце моніторингу з видатними довгостроковими даними такого роду даних, показані на малюнку 19.7. Дані опадів показують, що кислотність опадів знижується (рН збільшується), і що концентрації сульфату і нітрату також зменшуються. Зниження концентрацій сульфатів особливо велике, і, ймовірно, відображає той факт, що регуляторний контроль зосередився на викидах SO 2 (основний попередник сульфату) більше, ніж на NO x (попередники нітрату). Дані стічних вод також показують зниження кислотності і концентрації сульфатів, а також стійке зниження концентрацій кальцію. Останнє спостереження може відображати прогресуючу втрату кальцію з цих вододілів, що являє собою деградацію здатності системи забезпечувати кислотно-нейтралізуючу здатність проти майбутніх надходжень підкислюючих речовин. Джон Смол (2008) з Університету Королеви посилається на явище прогресивних втрат кальцію як до свого роду «остеопорозу», який впливає і деградує багато вододілів, в грунті та корінні породи яких мало кальцію.
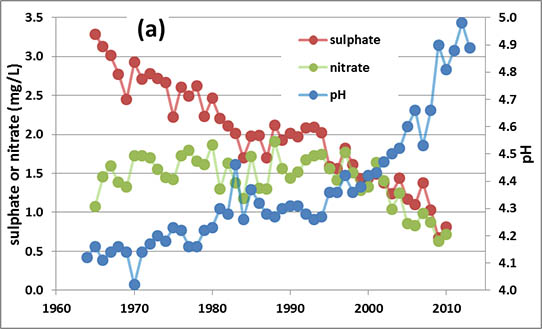
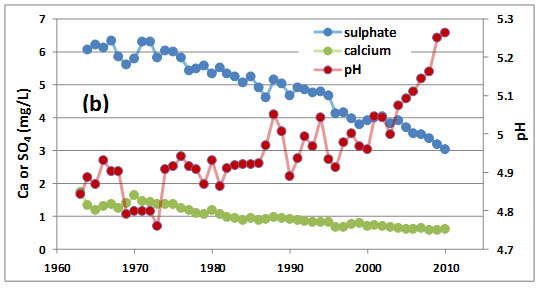
Деякі озера також отримують вигоду від зменшення завантаження сульфатів. Опитування 202 озер, що спостерігалося на сході Канади з початку 1980-х років, показало, що кислотність 33% знизилася, тоді як 56% були незмінними, а 11% стали більш кислими (Environment Canada, 1998. Загалом, близько 80% нещодавно відібраних озер у Новій Шотландії мали рН <6,0, як і 40% в Онтаріо та 25% в Нью-Брансвік (зверніть увагу, що рН <6,0 вважається критичним порогом толерантності до чутливих риб та інших водних тварин; Навколишнє середовище Канади, 2005). Багато з цих озер природно кислі через органічні речовини, що вилуговуються з боліт, особливо в Новій Шотландії, де бурі води складають близько 40% кислих озер. Однак у східній Канаді вважається, що 0,5-0,6 мільйона озер все ще вразливі до підкислення в умовах атмосферного осадження, подібного до режиму осадження в останні роки.
Потрібно визнати, що контроль забруднення надзвичайно дорогий. Наприклад, це може коштувати 600 мільйонів доларів щорічно для подальшого зменшення викидів SO 2 на 50% нижче поточних цілей для східної Канади та східних Сполучених Штатів. Через цю вартість політика, яка сприяє зменшенню викидів SO 2 та NO x, може не бути в змозі пережити часті виклики, встановлені політиками, економістами та діловими людьми, які не вважають, що такі дії необхідні.
Поки що дії щодо скорочення викидів SO 2 та NO x були енергійними лише у відносно заможних регіонах Північної Америки та Західної Європи. У менш заможних країнах політична увага в основному приділяється промисловому та економічному зростанню. Однак забруднення повітря та інші екологічні збитки «субсидують» це економічне зростання і часто приділяють мало уваги. У найкоротші терміни набагато більше політичної та наукової уваги необхідно приділити проблемам підкислення осадження та інших видів забруднення в країнах Східної Європи, Росії, Китаю, Індії, Південно-Східної Азії, Мексики та інших швидко зростаючих економіках. У цих країнах викиди SO 2, NO x та інших важливих забруднюючих речовин у повітрі виходять з-під контролю.
Висновки
Закислення - це природний процес, який відбувається, коли екосистеми взаємодіють з кліматичними та біологічними впливами, наприклад, у болотах та хвойних лісах. Підкислення також спричинене антропогенними впливами, зокрема викидами SO 2 та NO x, які окислюються з утворенням кислот, перебуваючи в атмосфері або після того, як вони сухі відкладені в екосистеми. Водні та наземні екосистеми, вразливі до підкислення, мають невелику кислотно-нейтралізуючу здатність, значною мірою через невелику кількість карбонатів кальцію та магнію в їх ґрунті, осадах або гірських породах. Прісні води з низькою лужністю особливо схильні до ризику підкислення атмосферним осадженням. Коли водойма підкислюється до рН менше приблизно 6,0, він починає втрачати свої популяції вразливих видів риб та іншої чутливої біоти. Підкислюючі впливи також пошкоджують вбудоване середовище, розмиваючи матеріали з вапняку, мармуру та деяких металів, таких як мідь. Хоча деякі екологічні збитки, спричинені підкисленням поверхневих вод, можуть бути пом'якшені вапнуванням, цю обробку доводиться повторювати, як правило, приблизно на трирічну ротацію. Найкращий спосіб уникнути екологічних проблем, пов'язаних з підкислюючим осадженням, - це зменшення викидів ключових газів-попередників кислоти (SO 2 і NO x). Значною мірою це робиться в заможних країнах, включаючи Канаду. Однак швидко зростаючі економіки, такі як Китай та Індія, не приділяють особливої уваги цій екологічній проблемі, і вона швидко погіршується, оскільки вони агресивно збільшують свої пропозиції комерційної енергії шляхом спалювання сірчистих викопних палив, особливо вугілля.
Питання для рецензування
- Поясніть принцип збереження електрохімічної нейтральності? Наскільки вона має відношення до хімії опадів і поверхневих вод?
- Які впливи навколишнього середовища призводять до того, що грунт стає кислим? Як можна пом'якшити цю проблему?
- Як підкислення прісноводної середовища проживання впливає на водну біоту, включаючи фітопланктон, макрофіти, зоопланктон, донних безхребетних, риб та птахів?
- Визначте критичне навантаження та поясніть фактори, що впливають на його значення для окремих видів рельєфу та поверхневих вод.
Питання для обговорення
- Порівняйте хімію дощової води та озерної води в регіоні, вразливому до підкислення. Які причини відмінностей?
- Як сприяють закисленню вологі і сухі відкладення підкислюючих речовин? Чому їх показники та відносне значення відрізняються між міськими та сільськими районами?
- Чи є поверхневі води в районі, де ви живете кислими або, ймовірно, стануть такими? Поясніть свою відповідь з точки зору факторів місцевості, які впливають на вразливість до підкислення.
- Поясніть, чому заможні країни вживають заходів щодо скорочення викидів газів-попередників кислоти, але швидко зростаючі економіки, такі як Китай та Індія, цього не роблять. Які ймовірні наслідки цієї політики?
Вивчення проблем
- Існує два широких варіанти боротьби з підкислюючим осадженням: (1) зменшення викидів для запобігання проблеми та (2) вапнування води та ґрунту для лікування симптомів. Деякі люди називають скорочення викидів «рішенням на мільярд доларів», а вапнування «рішенням на мільйон доларів». Це пов'язано з потенційно більшими капітальними витратами, пов'язаними з технологіями зменшення викидів SO 2 та NO x. Який із цих варіантів (або обидва) ви вважаєте найбільш підходящим для вирішення підкислення як екологічної проблеми? Поясніть свою відповідь.
- Канада та США домовилися про договір щодо транскордонного переміщення забруднювачів повітря з акцентом на підкислення осадження з атмосфери. Основними аспектами договору є скорочення викидів SO 2, і в меншій мірі NO x в атмосферу. Ви є вченим, який працює в Environment Canada, і на нього покладено відповідальність за моніторинг того, чи були досягнуті переговори скорочення викидів успішними в покращенні умов у провінції, де ви живете - чи підкислення стає менш проблемою? Як би ви розробили програму екологічного моніторингу та досліджень, щоб відповісти на це важливе питання? Які екологічні питання та питання здоров'я людини ви б розглянули?
Цитуються посилання та подальше читання
Алво, Р., Дж. Дж. Гусселл, і М. Беррілл. 1988 рік. Успіх розмноження звичайних галин (Gavia immer) стосовно лужності та інших характеристик озера в Онтаріо. Канадський журнал зоології, 66:746-752.
Бейкер, Л.А., Герліги А.Т., П.Р., Кауфманн, і Дж.М. Ейлерс. 1991. Кислі озера та струмки в Сполучених Штатах: роль кислотного осадження. Наукова, 252:1151-1154. Біміш, Р.Дж. і Х.Х. Харві. 1972. Підкислення гірських озер Ла-Клош, Онтаріо, і внаслідок цього смертність риб. Журнал Науково-дослідної ради рибальства Канади, 29:1131-1143.
Бренд, Д.Г., П. Кехо, і М.Коннорс. 1986. Хвойне лісонасадження призводить до закислення грунту в центральній частині Онтаріо. Канадський журнал досліджень лісу, 16:1289-1391.
Бродін Ю.В. та Ю.К.І.Куйленстєрна. 1992. Підкислення та критичні навантаження в країнах Північної Європи: передумови. Амбіо, 21:332-338.
Бусо, округ Колумбія, Г.Е. Лікенс, і Дж.С. Ітон. 2000. Хімія опадів, потокової води та озерної води в дослідженні екосистеми Хаббард-Брук. Загальний технічний звіт NE-275, Міністерство сільського господарства США, Північно-східна лісова експериментальна станція, Ньютаун Сквер, Пенсильванія.
Чан, В.С., Р.Дж. ветеринар, К.Ю. Ро, А.Й.С. Тан, і М.А. Лузіс. 1984. Довгострокова якість опадів і вологе осадження в басейні Садбері. Атмосферне середовище, 18:1175-1188.
Крокер, Р.Л. і Дж. майор. 1955. Розвиток ґрунту по відношенню до рослинності та поверхневого віку в Glacier Bay, Аляска. Екологічний журнал, 43:427-448.
Дейл, Дж. М., Фрідман, і Дж. Керекес. 1985 рік. Кислотність та попутна хімія вод середовищ існування земноводних у Новій Шотландії. Канадський журнал зоології, 63:97-105.
Діллон, П.Дж., Д.С. Джефферіс, Снайдер, Р.Рейд, Н.Д. Ян, Д. Еванс, Дж. Мосс, і В.А. Шейдер. 1977. Кислотні дощі в Південно-Центральному Онтаріо. Міністерство навколишнього середовища Онтаріо, Рексдейл, ON.
Діллон, П.Дж., Н.Д. Ян, В.А. Шидер, і Н.Конрой. 1979. Кислі озера в Онтаріо, Канада: характеристика, ступінь та відповіді на базові та поживні добавки. Архів гідробіології, додаток 13:317-336.
Діксит, С.С., А.С. Діксит, і J.P. Смол. 1991. Багатоваріантні екологічні висновки на основі діатомових асамблей з озер Садбері (Канада). Біологія прісноводної води, 26:251-266.
Довкілля Канади. 1996 р. Стан навколишнього середовища Канади. Уряд Канади, Оттава, ON.
Довкілля Канади. 1998 р. Канадська оцінка кислотних дощів. Том 1. Підсумок результатів. Навколишнє середовище Канада, Оттава, ON.
Довкілля Канади. 2005 р. Канадська кислота осадження наукової оцінки 2004. Метеорологічна служба Канади, Downsview, ON. http://publications.gc.ca/pub?id=9.688243&sl=0
Довкілля Канади. 2014 рік. Національний інвентаризація викидів забруднюючих речовин та підсумки та тенденції викидів забруднюючих речовин у повітря. Навколишнє середовище Канада, Оттава, ON. http://www.ec.gc.ca/inrp-npri/default.asp?lang=en&n=0EC58C98-1#Emission_Summaries Доступ до січня 2015 року.
Агентство з охорони навколишнього середовища (EPA). 2011 рік. Національна програма оцінки опадів кислоти доповідь Конгресу 2011: Комплексна оцінка. EPA США, дослідницький трикутник парк, NC. Доступ до січня 2014 року.
Агентство з охорони навколишнього середовища (EPA). 2014 рік. Повітряні тенденції. EPA США, дослідницький трикутник парк, NC. https://www.epa.gov/air-trends Доступ до січня 2014 року.
Фіндлі, Д.Л. і С.Е.М. Касьян. 1986. Відповіді фітопланктону спільноти на підкислення озера 223, Експериментальні озера, північно-західний Онтаріо. Забруднення води, повітря та ґрунту, 30:719-726.
Фреда, Дж., Садинський В.Дж., і В.А. Дансон. 1991. Тривалий моніторинг популяцій земноводних щодо впливу кислотного осадження. Забруднення води, повітря та ґрунту, 55:445-462. Фрідман, Б. 1995 р. Екологія навколишнього середовища. 2-е изд. Академічна преса, Сан-Дієго, Каліфорнія.
Фрідман Б. та Т.А. Клер. 1987. Залишки іонної маси та сезонні потоки з чотирьох кислих потоків коричневої води в Новій Шотландії. Канадський журнал рибного господарства та водної науки, 44:538-548.
Герхардссон, Л., Оскарссон, і С.Скервінг. 1994. Кислотні опади — вплив на мікроелементи і здоров'я людини. Наука про загальне довкілля, 153:237-245.
Годболд, Д.Л. та А.Гуттерманн (ред.). 1994 р. Вплив кислотних дощів на лісові процеси. Вілі-Лісс, Хобокен, Нью-Джерсі.
Харві, Х.Х. та Лі. 1982. Історичні зміни рибальства, пов'язані зі зміною рН поверхневих вод в Канаді. С. 45-55 в: Матеріали Міжнародного симпозіуму з кислотних дощів та рибальства.
Генріксен, А. 1980. Підкислення прісних вод — масштабне титрування. С. 68-74 в: Екологічний вплив кислотних опадів, (Drablos and A. Tollan, ред.). Проект SNSF, Осло, Норвегія.
Джеффріс, Д.С., Т.Г. Брайджес, П.Дж. Діллон, і У. Келлер. 2003. Моніторинг результатів програм боротьби з кислотними дощами Канади/США; деякі відповіді озера. Моніторинг та оцінка навколишнього середовища, 88:3-19.
Йоськов, П.Л., Еллерман А.Д., Ж.-П. Монтеро, Р.Шматензее, і Е.М. Бейлі. 2000 рік. Ринки чистого повітря: Програма кислотних дощів США. Кембриджський університетський прес, Кембридж, Великобританія.
Келлі, C.A., J.WM Радд, А.Фурутані, і Д.В. Шиндлер. 1984. Вплив закислення озер на швидкість розкладання органічних речовин у відкладах. Лімнологія та океанографія, 29:687-694.
Керекес, Дж. і Б. Фрідман. 1988 р. Фізичні, хімічні та біологічні характеристики трьох вододілів у національному парку Kejimkujik, Нова Шотландія. Архіви забруднення навколишнього середовища та токсикології, 18:183-200.
Керекес, Дж., Фрідман, Г. Хауелл, і П. Кліффорд. 1984 рік. Порівняння характеристик кислого евтрофічного та кислого оліготрофного озера поблизу Галіфаксу, Нова Шотландія. Дослідницький журнал забруднення води Канади, 19:1-10.
Лакруа, Г.Л. і Д.Р. Таунсенд. 1987. Відгуки молодіжного атлантичного лосося (Salmo salar) на епізодичне підвищення кислотності річок Нової Шотландії. Канадський журнал рибного господарства та водної науки, 44:1475-1484.
Лінзон, С.Н., і храм П.Дж. Перепробовування ґрунту та вимірювання рН після 18-річного періоду в Онтаріо. С. 176-177 в: Екологічний вплив кислотних опадів, (Drablos and A. Tollan, ред.). Проект SNSF, Осло, Норвегія.
Ловетт, Г.М., В.А. Райнерс та Р.К. Олсон. 1982. Осадження крапель хмар у субальпійських бальзамових ялицевих лісах: гідрологічний та хімічний бюджети. Наукова, 218:1303-1304.
Маллі, Д.Ф., Д.Л. Фіндлі, і P.S.S. Чанг. 1982. Екологічний вплив кислотних опадів на зоопланктон. С. 297-327 в: Вплив кислотних опадів на екологічні системи (Ф.М. Д'Ітрі, ред.), Енн-Арбор Наука, Енн-Арбор, Мічіган.
Міллс, К.Х. 1984. Реакція популяції риб на експериментальне закислення невеликого озера Онтаріо. Pp. 117-131 в: Ранні біотичні реакції на просування підкислення озера (G.R. Hendry, ред.). Баттерворт, Торонто.
Міллс, К.Г., Чаланчук С.М., Л.С. Мор, і І.Дж. Девіс. 1987. Відгуки популяцій риб в озері 223 до 8 років експериментального підкислення. Канадський журнал рибного господарства та водної науки, 44, Suppl. 1, 114-125.
Моррісон, І.К. 1983. Склад перколату з реконструйованих профілів ґрунтів соснового лісу домкратних під впливом кислотного введення. С. 195-206 в: Вплив скупчень забруднювачів повітря в лісових екосистемах. (Б. Ульріх і Дж. Панкрат, ред.). Reidel, Берлін, Німеччина.
Природні ресурси Канади. 1998 р. Вплив кислотного осадження на ліси Канади. Природні ресурси Канади, Оттава, ON.
Окланд, Дж. і К.А. Окланд. 1986. Вплив кислотного відкладення на донних тварин в озерах і струмках. Експериментальна, 42:471-486.
Паркер, Г.Р., М.Дж. Петрі, і Д.Т. Сірс. 1992. Розподіл водоплавних птахів щодо кислотності водно-болотних угідь. Журнал управління дикою природою, 56:268-274.
Персі, К.Е. 1986. Вплив імітованих кислотних дощів на схожість, ріст та морфологію саджанців лісових дерев. Новий фітолог, 104:473-484.
Ройсс, Дж. Р. і Д.В. Джонсон. 1985 рік. Вплив ґрунтових процесів на підкислення води кислотними опадами. Журнал якості навколишнього середовища, 14:26-31.
Ро, К.Ю. 2014. Проаналізовано поля даних з Національної бази даних хімії атмосфери (NatChem) та Analysis Facility. Відділ досліджень якості повітря, Навколишнє середовище Канади, Торонто, ON. www.msc—smc.ec.gc.ca/natchem (Надається як особисте спілкування.)
Роуз, Дж. (ред.). 1994 р. Кислотний дощ: поточна ситуація та засоби правового захисту. Видавці Gordon & Breach Science, Івердон, Швейцарія.
Шайдер, В.А., Д.С. Джефріс, і П.Дж. Діллон. 1980. Масове осадження в районах Садбері і Маскока-Халібертон Онтаріо під час зупинки INCO Ltd. в Садбері. Міністерство навколишнього середовища Онтаріо, Рексдейл, ON.
Шиндлер, Д.В. 1988. Вплив кислотних дощів на прісноводні екосистеми. Наукова, 239:149-157. Шиндлер, Д.В. 1990. Експериментальні збурення цілих озер як випробування гіпотез щодо структури та функції екосистем. Оікос, 57:25-41.
Шиндлер, Д.В., К.Х. Міллс, Д.Ф. Маллі, Д.Л. Фіндлі, Дж.А. Ширер, І.Дж. Девіс, М.А. Тернер, Г.А. Лінсі, і Д.А. Крукшенк. 1985. Довгостроковий екосистемний стрес: наслідки багаторічного експериментального підкислення на невелике озеро. Наукова, 228:1395-1401.
Скофілд, C.L. 1982. Історичні зміни рибальства в США пов'язані зі зниженням рН поверхневих вод. С. 57-67 в: Матеріали Міжнародного симпозіуму з питань кислоти. Дощ і рибальство. Американське товариство рибного господарства, Bethesda, MD.
Шеннон, Дж. і Б.М. Лехт. 1986. Оцінка матриць джерело-рецепторного осадження NO x —N. забруднення води, повітря та ґрунту, 30:815-824.
Спралз, В.Г. 1975. Спільноти зоопланктону ракоподібних в кислотно-стресових озерах. Журнал Науково-дослідної ради рибальства Канади, 32:389-395.
Стенсдоттер, У., Т. Свенсон, У. Ларссон, і Г. Перссон. 2005. Пом'якшення закислення в озерах шляхом вапнування. Комплексні дослідження впливу вапнування підкислених вод, Шведське агентство з охорони навколишнього середовища, Стокгольм, Швеція.
Стюарт, C.C., і Б.Фрідман. 1989 рік. Порівняння макрофітних спільнот прозорої води та буроводного оліготрофного озера в національному парку Кеджимкуджик, Нова Шотландія. Забруднення води, повітря та ґрунту, 46:335-341.
Твейте, Б. 1980 р. Вплив кислотних опадів на ґрунт і ліс. Зростання дерев в польових експериментах. С. 206-207 в: Екологічний вплив кислотних опадів (Драблос та А.Толлан, ред.). Проект SNSF, Осло, Норвегія.
Уотмуг, С.А. та П.Дж. Діллон. 2004 рік. Основні потоки елементів з хвойного вододілу в центральній частині Онтаріо, 1982-1999 рр. Біогеохімія, 67:369-398.
Ватт, В.Д., К.Д. Скотт, і У.Дж. Уайт. 1983. Свідчення закислення деяких річок Нової Шотландії та його впливу на атлантичний лосось. Канадський журнал рибного господарства та водної науки, 40:462-473.
Вуд, Т. і Ф.Х. Борман. 1976. Короткостроковий вплив імітованого кислотного дощу на ріст і поживні відносини Pinus strobus. Pp. 815—824 в: Загальний технічний звіт NE-23, Північно-Східна лісова експериментальна станція, Лісова служба США, Верхній Дарбі, Пенсильванія.
Райт, Р.Ф. і Е.Снеквік. 1978 р. Кислотні опади: Хімія та популяція риб у 700 озерах у найпівденнішій Норвегії. Міжнародна перевірка теоретичних та ангевандтових лімногій, 20:765-775.
Ян, Н.Д., Р.Е. Жирар, і К.Дж. Лафранс. 1979. Виживання райдужної форелі, Salmo gairdneri, в занурених вольєрах в озерах, оброблених нейтралізуючими агентами поблизу Садбері, Онтаріо. Міністерство навколишнього середовища Онтаріо, Рексдейл, ON.
