13.8: Рівновага, коли компонент також присутній у вигляді конденсованої фази
- Page ID
- 21583
Припустимо, що дуже велика система рівноваги з ідеальними складовими газу при тиску\(P_A\)\(P_B\)\(P_C\)\(P_D\),,,, також містить кількість рідини\(A\). (В даний час ми припускаємо, що це чиста рідина\(A\); компоненти\(B\)\(C\), і\(D\) не розчиняються в рідині\(A\).) Якщо ця розширена система знаходиться в рівновазі, ми знаємо, що рідина\(A\) знаходиться в фазовій рівновазі з ідеальним газом\(A\) під тиском\(P_A\). Тобто тиск пари рідини\(A\) при фіксованій температурі,\(P_A\) яку ми розглядаємо, і зміна вільної енергії Гіббса для перетворення рідини\(A\) в її ідеальний газ при\(P_A\) дорівнює нулю. Поки рідина знаходиться в фазовій рівновазі зі своїм ідеальним газом, зв'язок між ідеальним парціальним тиском газу та стандартною зміною вільної енергії Гіббса для реакції не впливає присутність рідини. Ці ж міркування застосовуються, коли дуже велика система рівноваги містить як ідеальний газ, так\(A\) і тверде тіло\(A\), до тих пір, поки рівноважний тиск сублімації дорівнює парціальному тиску ідеального газу А,\(P_A\).
Тепер припустимо, що речовина\(A\) - це нелетка рідина або тверда речовина. У цьому випадку ми, можливо, не зможемо виміряти стандартну вільну енергію Гіббса утворення ідеального газу\(A\). З практичної точки зору це важливий аспект; якщо ми не можемо знайти стандартну вільну енергію Гіббса утворення ідеального газу, ми не можемо використовувати її для обчислення констант рівноваги. З теоретичної точки зору це менш важливо; ми можемо розумно уявити, що будь-яка речовина має кінцевий тиск пари при будь-якій температурі, навіть якщо значення занадто мале для експериментального вимірювання. Ми можемо міркувати про зв'язок рівноважного тиску пари з іншими величинами, чи можемо ми його виміряти чи ні.
Якщо речовина\(A\) є нелеткою рідиною (або твердою речовиною) при температурі, що цікавить, корисно змінити цикл, введений в попередньому розділі. Ми можемо знайти стандартну вільну енергію освіти Гіббса для рідини з теплових вимірювань, і ми можемо використовувати рідкий,\(A\) а не ідеальний газ\(A\) як стандартний стан. Якщо\(A\) енергонезалежний, він присутній в системі рівноваги тільки як рідина. Для наведених цілей ми знову припустимо, що інші компоненти нерозчинні в рідині\(A\); тоді, єдина відмінність між\(A\) в її стандартному стані і\(A\) в системі рівноваги полягає в тому, що тиск на\(A\) в стандартному стані становить один бар, а тиск на рідину \(A\)в системі рівноваги є\(P=P_B+P_C+P_D\). Тому, коли\(a\) родимки рідини\(A\) переходять зі свого стандартного стану в систему рівноваги, зміна вільної енергії Гіббса становить
\[{\Delta }_{press}G_A=a\int^P_{P^o}{{\overline{V}}^{\textrm{⦁}}_A}\left(\ell \right)dP\]
де\({\overline{V}}^{\textrm{⦁}}_A\left(\ell \right)\) - молярний обсяг чистої рідини\(A\). Коли\(a\) молі рідини\(A\) виробляються при рівноважному тиску від елементів, зміна вільної енергії Гіббса становить
\[a{\overline{G}}_A\left(\ell ,P\right)=a\ {\Delta }_fG^o\left(A,\ell \right)+a\int^P_{P^o}{{\overline{V}}^{\textrm{⦁}}_A}\left(\ell \right)dP\]
У розділі 15.3 ми приділяємо додаткову увагу значенню цього інтеграла; поки просто зауважимо, що воно незначне за принципово будь-яких обставин. Ці міркування означають, що ми можемо змінити ліву частину циклу на малюнку 5, як зазначено на малюнку 7.
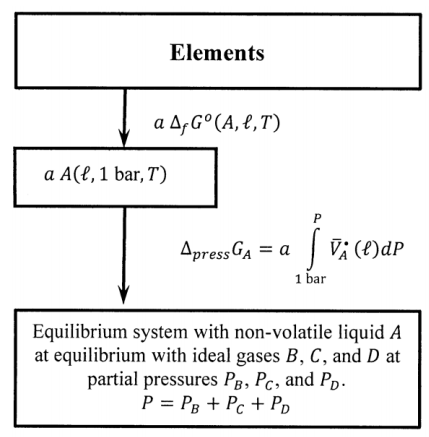
Коли ми підсумовуємо навколо модифікованого циклу таким же чином, як і раніше, ми знаходимо
\[0=a\ {\Delta }_fG^o\left(A,\ell \right)+b\ {\Delta }_fG^o\left(B,P^o\right)-c\ {\Delta }_fG^o\left(C,P^o\right)\]\[-d\ {\Delta }_fG^o\left(D,P^o\right)+a\int^P_{P^o}{{\overline{V}}^{\textrm{⦁}}_A}\left(\ell \right)dP+RT{ \ln p^b_B\ }\]\[-RT{ \ln p^c_C-RT{ \ln p^d_D\ }\ }\]
де ми доповнили наші позначення, щоб підкреслити, що\(A\) є нелеткою рідиною в той час\(B\)\(C\), і\(\ D\) є ідеальними газами. Ми продовжуємо використовувати\({\Delta }_rG^o\) для представлення різниці між стандартними вільними енергіями продуктів Гіббса та енергіями реагентів. За нинішніх обставин ми маємо
\[{\Delta }_rG^o=\ c\ {\Delta }_fG^o\left(C,P^o\right)+d\ {\Delta }_fG^o\left(D,P^o\right)-a\ {\Delta }_fG^o\left(A,\ell \right)-b\ {\Delta }_fG^o\left(B,P^o\right)\]
Приймаючи значення інтеграла як нуль, наш результат спрощує
\[{\Delta }_rG^o=-RT{ \ln \frac{p^c_Cp^d_D}{p^b_B}\ }\]
Ми знову прийшли до висновку, що «концентрація» чистого твердого речовини або рідини може бути встановлена рівною одиниці в рівноважному постійному вираженні для реакції, в якій вона бере участь. Коли ми це зробимо, ми повинні використовувати вільну енергію Гіббса утворення конденсованої фази при розрахунку\({\Delta }_rG^o\).
