1.1: Рішення вибраних проблем глави 2
- Page ID
- 20703
П2.1:
зв'язок а - сигма-зв'язок, утворена перекриттям орбіти sp 3 на одному вуглеці та орбітальної sp 2 на іншому вуглецю.
зв'язок b - це зв'язок s igma, утворена перекриттям орбіти sp 2 на одному вуглеці і sp 2 орбітальної на інший вуглець.
зв'язок c - сигма-зв'язок, утворена перекриттям орбітальної sp 2 на вуглець і sp 2 орбітальної на азоті, поєднаної з pi зв'язком, утвореним перекриттям 2 р орбітальної на вуглець і 2 р орбітальний на азоті.
зв'язок d - сигма-зв'язок, утворена перекриттям орбіти sp 2 на азоті та 1s орбіталі на водні.
зв'язок е - сигма-зв'язок, утворена перекриттям орбіти sp 2 на одному вуглеці і sp 3 орбітальної на інший вуглець.
зв'язок f - це зв'язок s igma, утворена перекриттям орбіти sp 3 на одному вуглеці і sp 3 орбітальної на інший вуглець.
П2.2:
а)

б)
Вгору: вкладник праворуч є неповнолітнім через поділ заряду.
Середній: вкладник зліва є незначним через одного вуглецю, який не має повного октету.
Внизу: Показані дописувачі приблизно еквівалентні.
Р2.5:
зв'язок а - сигма-зв'язок, утворена перекриттям орбіти sp 2 на одному вуглеці та орбітальної sp 3 на іншому вуглецю.
зв'язок b - сигма-зв'язок, утворена перекриттям орбіти sp 2 на вуглець і sp 2 орбітальної на кисень, поєднана з p i зв'язком, утвореним перекриттям a 2 р орбітальної на вуглець і a 2 р орбітальний на кисень.
зв'язок c - це зв'язок s igma, утворена перекриттям орбіти sp 3 на вуглець і sp 3 орбітальної на інший вуглець.
зв'язок d - це s igma зв'язок, утворений перекриттям sp 3 орбіталі на вуглець і sp 3 орбітальної на кисень.
зв'язок e - це зв'язок s igma, утворена перекриттям орбіти sp 3 на вуглець і sp 3 орбітальної на кисень.
зв'язок f - це зв'язок s igma, утворена перекриттям орбіти sp 2 на вуглець і sp 3 орбітальної на азоті.
зв'язок g - це зв'язок s igma, утворена перекриттям орбіти sp 3 на вуглець і sp 2 орбітальної на азоті.
зв'язок h - сигма-зв'язок, утворена перекриттям орбіти sp 3 на вуглець і sp 3 орбітальної на азоті.
зв'язок i - сигма-зв'язок, утворена перекриттям орбіти sp 2 на одному вуглеці і sp 3 орбітальної на інший вуглець.
Р2.6:
а) С сп3 — О сп3 б) С сп2 — С сп3 в) С сп2 — Н сп2 г) С сп2 — С сп2 д) С сп3 — С сп3 ф) С сп2 — С сп2
г) С сп3 - С сп3 ч) С сп2 — Н 1с i) С сп2 — О сп2 ж) С сп2 — Сл 3 р k) Н сп 3 — Н 1с
л) З'єднання тростини містить два альдегіди, з'єднання один містить ефір, з'єднання 2 містить амід, з'єднання 3 містить кінцевий алкен, а з'єднання 4 містить вторинний амін.
м) Молекулярна формула сполуки тростини - C 10 H 14 O 2.
Р2.7:
найкоротший
облігація е (потрійний зв'язок)
облігація c (подвійний зв'язок)
зв'язок d (одиночний зв'язок між sp 2 і sp гібридизованими вуглецями)
зв'язок f (одиночний зв'язок між sp і sp 3 гібридизованими вуглецями)
зв'язок b (одиночний зв'язок між sp 2 і sp 3 гібридизованими вуглецями)
зв'язок a (одиночний зв'язок між двома sp 3 гібридизованих вуглецю)
найдовший
П2.11:
найкоротший
облігація c (подвійний зв'язок)
зв'язок d (одиночний зв'язок між двома sp 2 гібридизованих вуглецю)
зв'язок b (одиночний зв'язок між sp 2 і sp 3 гібридизованими вуглецями)
зв'язок a (одиночний зв'язок між двома sp 3 гібридизованих вуглецю)
найдовший
P2.12: Амід, показаний нижче, не здатний діяти як донор водневих зв'язків (він не має ніяких N-H зв'язків), і, таким чином, як очікується, буде менш розчинний у воді. Інші три аміди тієї ж формули мають одну або кілька N-H зв'язків і, таким чином, можуть брати участь у водневому зв'язку з водою як донор, так і акцептор.
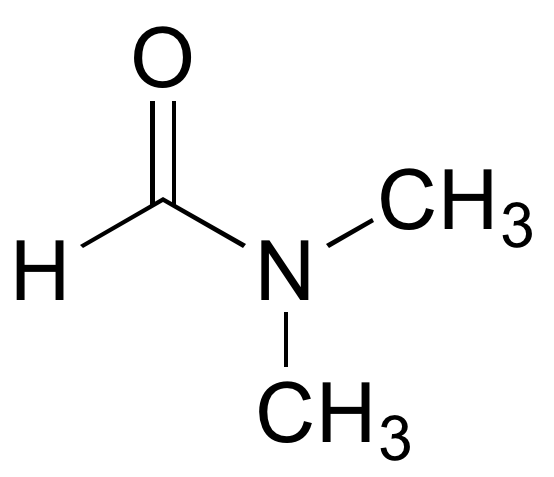
П2.13:

П2.14:

П2.15:

П2.16:

П2.17:

П2.18:

П2.19:
а)
1: Ч 3 Ф
2: СН 2 Ф 2
3: СН 3 CHF 2
4: ВЧ
2 і 3 мають два фтору і є більш полярними, ніж 1, тому вони мають сильніші міжмолекулярні диполь-дипольні взаємодії. 3 має на один більше вуглецю, ніж 2, і тому сильніші взаємодії ван дер Ваальса. 4 здатний до водневого зв'язку, тому він має найсильніші міжмолекулярні взаємодії та найвищу кипіння точка.
б)

1 і 2 мають лише взаємодії ван дер Ваальса, але 2 має більше вуглецю, тому ці взаємодії трохи сильніші. 3 має полярну карбонільну групу, а 4 здатний до водневого зв'язку.
в)

1 не здатний до водневого зв'язку. 2 і 3 обидва мають групи водневих зв'язків, але 3 мають ще один вуглець і, отже, сильніші загальні взаємодії ван дер Ваальса.
г)

1 має лише взаємодії ван дер Ваальса. 2 має полярну тіольну групу, але 3 має гідроксильну групу, яка здатна зв'язуватися з воднем. 4 - сіль: взаємодії заряд-заряд дуже сильні і призводять до дуже високої температури кипіння.
П2.20:
а) З'єднання праворуч є більш розчинним (менше гідрофобних вуглеців)
б) З'єднання зліва є більш розчинним (іонно-фосфатна група)
в) З'єднання зліва є більш розчинним (менше гідрофобних вуглеців)
г) З'єднання зліва більш розчинне (здатне зв'язуватися з воднем)
д) З'єднання праворуч є більш розчинним (менше гідрофобних вуглеців)
P2.22: Самотні парні електрони на пептидному азоті кон'югуються з карбонільним зв'язком пі, і, таким чином, не доступні, щоб діяти як акцептори водневих зв'язків.

P2.23: Обидві зв'язки мають однакову довжину і мають порядок зв'язку 1,5 (одна частина одинарного зв'язку, одна частина подвійного зв'язку). Центральний кисень sp 2 гібридизований (зверніть увагу на «зігнуту» геометрію).

P2.26: П'ятичленне кільце не є частиною ароматичної системи через наявність в кільці гібридизованого вуглецю sp 2.
П2.27:
А не ароматичний (sp 3 гібридизованого вуглецю в кільці)
B є ароматичним (порахуйте самотню пару, і ви отримаєте 10 pi електронів, що є числом Геккеля)
C не є ароматичним (орбітальна 2 р на карбокатіоні порожня, тому в системі є лише чотири пі-електрони, що не є числом Геккеля)
D не ароматичний (чотири пі-електрони, а не число Геккеля)
Е не ароматичний (sp 3 гібридизованого вуглецю в кільці)
F не ароматичний (sp 3 гібридизованого вуглецю в кільці)
G не є ароматичним (одиночна пара електронів вважається частиною системи пі, таким чином, існує чотири pi електрони, які не є числом Гюкеля.
H ароматичний (карбокація sp 2 гібридизована, орбітальна 2 р порожня, тому в системі є два електрони p i, а 2 - число Геккеля)
I не ароматичний (в системі є три кон'юговані pi зв'язку з шістьма пі-електронами, але з'єднання не є циклічним).
П2.28:

П2.29:

П2.30:

