7.8: Галогеніди вуглецю
- Page ID
- 17973
Існує два загальних класи галогенідів вуглецю.
- Гомолептичні галогеніди, наприклад, CCl 4, cCl 2 F 2, C 6 Cl 6 і т.д.
- Карбонілові галогеніди, наприклад, Cl 2 C = O.
Короткий зміст деяких простих галогенідів вуглецю наведено в табл\(\PageIndex{1}\).
| З'єднання | Мп (°C) | Ап (°C) | Зауваження |
| ЦФ 4 | -185 | -128 | Дуже стабільний газ |
| ККл 4 | -23 | 76 | Безбарвна рідина, стабільна |
| Кбр 4 | 93 | 190 | Блідо-жовта тверда речовина, розкладається при кипінні |
| CI 4 | 171 | - | Яскраво-червона тверда речовина, розкладається перед кипінням, сублімована при низькому тиску |
| F 2 С=О | -114 | -83 | Розкладається Н 2 О |
| Сл 2 С=О | -118 | 8 | Фосген, високотоксичний |
| Br 2 С=О | - | 65 | Випари в повітрі |
тетрагалогеніди вуглецю
Тетрагалогеніди вуглецю, як правило, отримують прямою (тепловою) реакцією вуглецю з відповідним галогеном (7.8.1); однак для кожної похідної можливі специфічні синтези.
\[ \text{C + 2 X}_2 \rightarrow \text{CX}_4\]
Крім прямої реакції фтору з вуглецем, CF 4 можна отримати з SiC, (7.8.2). Бічний продукт SiF 4 видаляється пропуском реакційної суміші через розчин NaOH, в якому SiF 4 реагує з утворенням силікату. Різниця в реактивності SiF 4 і CF 4 пояснюється відсутністю енергетично доступного п'ятикоординатного проміжного продукту, необхідного для асоціативного механізму.
\[ \text{SiC + F}_2 \rightarrow \text{SiF}_4\text{ + CF}_4 \]
Тетрабромід вуглецю можна отримати шляхом бромування СН 4 з HBr або Br 2, або шляхом реакції CcL 4 з AlBr 3, (7.8.3). Тетрайодид вуглецю (CI4) може бути виготовлений за допомогою реакції обміну галогенів, каталізованої кислотою Льюїса, (7.8.4).
\[ \text{3 CCl}_4\text{ + 4 ALBr}_3 \rightarrow \text{3 CBr}_4\text{ + 4 AlCl}_3\]
\[ \text{CCl}_4\text{ + 4 C}_2\text{H}_5\text{I} \rightarrow \text{CI}_4 \text{ + 4 C}_2\text{H}_5\text{Cl}\]
CF 4 дуже стабільний. Насправді він настільки стійкий, що навіть не вступає в реакцію з розплавленим натрієм. На відміну від CF 4, чотирихлористий вуглець (cCl 4) легко реагує з лужними металами (K і Na) або іншими сильними відновниками (наприклад, F 2, Al, Ba, Be та Zn). У той час як CcL 4 термодинамічно нестійкий щодо гідролізу, він кінетично стабільний і, таким чином, знаходить широке застосування як розчинник. Фотоліз може призвести до перенесення хлоридного радикала на різні субстрати. Він також використовується при перетворенні оксидів металів в хлориди. Тетрабромід вуглецю (CBr 4) нерозчинний у воді та інших полярних розчинниках, але розчинний у бензолі. Тетрайодид вуглецю (CI 4) розкладається термічно, (7.8.5).
\[ \text{2 CI}_4 \rightarrow \text{2 I}_2 \text{ + I}_2\text{C=CI}_2 \]
Зниження стабільності СХ 4, від фтору до йоду, безпосередньо пов'язане з енергією зв'язку C-X.
| С-Х | Енергія зв'язку (кДж/моль) |
| С-Ф | 485 |
| C-Cl | 327 |
| C-Br | 285 |
| C-I | 213 |
Небезпеки
Незважаючи на його використання в якості розчинника, CCl 4 має значні небезпечні ефекти. Вдихання парів чотирихлористого вуглецю може викликати головні болі, психічну сплутаність свідомості, депресію, втому, втрату апетиту, нудоту, блювоту та кому. Симптоми можуть зайняти багато годин. Пара і рідина дратують очі, а внутрішнє роздратування, нудота та блювота викликаються при прийомі всередину. Хронічні ефекти від тривалих інгаляцій включають бронхіт і жовтяницю, тоді як вплив шкіри може викликати дерматит.
Тетрабромід вуглецю токсичний при вдиханні, а пар є наркотичним, якщо приймати його у високих концентраціях. Як і у випадку з CcL 4, CbR 4 може реагувати вибухонебезпечно з лужними металами.
Вищі гомолептичні галогеніди
Органічні сполуки, які містять тільки вуглець і галоген, називаються галовуглецями, і до них відносяться фторуглероди і хлорвуглеці. Найпростіший шлях до фторуглеродів включає реакцію вуглеводню з високовалентним фторидом (наприклад, CoF 3) або реакцію хлоровуглецю з SbF 3. Загалом, хлорвуглеці з атомами вуглецю sp 3 більш стабільні, ніж ті, у яких вуглецеві центри sp 2. Винятком з цього є ароматичні сполуки типу C 6 Cl 6.
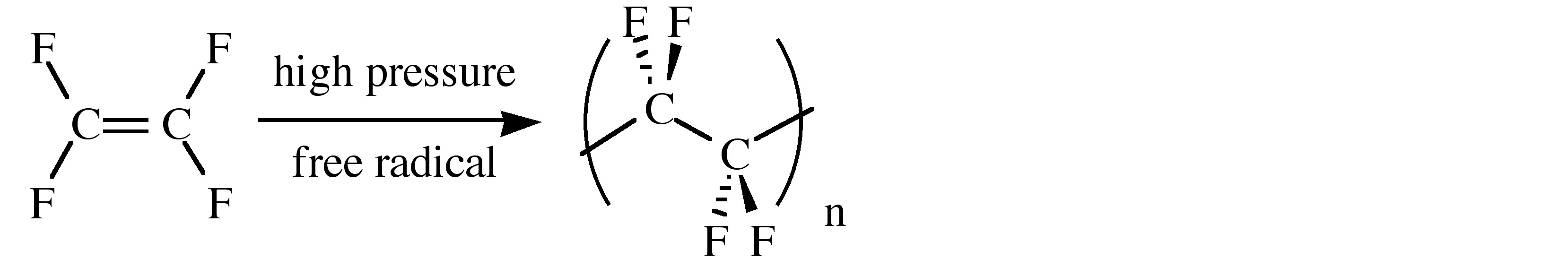
Фізичні властивості фторуглеродів варіюються від інертних до токсичних. Таким чином, полі (тетрафторетилен), (C 2 F 4) n, відомий або його абревіатурою (PTFE), або його торговою назвою (тефлон), хімічно інертний і має низький коефіцієнт тертя (табл.\(\PageIndex{3}\)). Як наслідок, його використання включають покриття на бронебійних куль (для припинення зносу ствола пістолета), лабораторні контейнери та магнітні мішалки, трубки для агресивних хімічних речовин та різьблення ущільнювальної стрічки в сантехнічних додатках (сантехнічна стрічка). Короткий зміст фізичних властивостей ПТФЕ наведено в табл\(\PageIndex{3}\). ПТФЕ синтезується емульсійною полімеризацією мономера тетрафторетилену під тиском через каталізатор вільних радикалів.
| Нерухомість | Значення |
| Щільність | 2,2 г/см 3 |
| Точка плавлення | 327 °C |
| Модуль Юнга | 0,5 ГПа |
| межа плинності | 23 МПа |
| коефіцієнт тертя | 0,05 - 0,10 |
| Діелектрична проникність | 2.1 |
| Діелектрична міцність (1 МГц) | 60 мВ/м |
На відміну від ПТФЕ октафторізобутилен, (CF 3) 2 C = CF 2, є високотоксичним, тоді як перфтордекагідронафталін (C 10 F 8, рис.\(\PageIndex{1}\)) використовується як кров'янозамінник компонента.

змішані галогеніди
Змішані галогеніди є важливим класом галовуглецевих сполук. Вони синтезуються шляхом галогенідного обміну, (7.8.6). Висока вартість SbF 3 означає, що реакція, як правило, протікає з надлишком хлориду.
\[\text{3 CCl}_4 \text{ + 2 SbF}_3 \rightarrow \text{2 CCl}_2\text{F}_2 \text{ + 2 SbCl}_2\]
Звичайна назва змішаного галогеніду вуглецю - галон або фреон, хоча фреон насправді є торговою маркою Du Pont. Список обраних сполук фреону наведено в табл\(\PageIndex{4}\). Галони нетоксичні, негорючі і не мають запаху. Однак саме їх відсутність реактивності викликало проблему.
| Фреон | Формула | Використовує |
| 12 | ККл 2 Ф 2 | Холодоагент |
| 11 | ККл 3 Ф | Холодоагент |
| 114 | КЛ 2 С-ККЛ 2 | Холодоагент |
| 113 | Сл 3 С-КФ 3 | Розчинник |
| 13B1 | КбРФ 3 | Вогнегасник |
| 1211 | Cbr/Кльф 2 | Вогнегасник |
Вплив хлорфторвуглецевих сполук на навколишнє середовище (ХФУ)
Хлорофторвуглецеві сполуки (ХФУ) дуже стабільні і не руйнуються в навколишньому середовищі. Як наслідок, вони транспортуються до стратосфери, де вони розкладаються при фотолізі, (7.8.7). Отриманий хлоридний радикал є каталізатором розкладання озону, (7.8.8), а також каталізатором реакції озону з молекулярним киснем, (7.8.9).
\[ \text{CCl}_2\text{F}_2\text{ + h}\nu \rightarrow \text{CClF}_2\text{ + Cl}\cdot \]
\[ \text{2 O}_3 \xrightarrow{\text{Cl}\cdot} \text{3 O}_2\]
\[ \text{O}_3 \text{ + O} \xrightarrow{\text{Cl}\cdot} \text{2 O}_2 \]
Широке використання ХФУ в якості холодоагентів і палива означало, що до 1986 року в атмосферу було звільнено 2,5 мільярда фунтів ХФУ. Це було еквівалентно 1/2. фунтів на людину на планеті. Оскільки озоновий шар забезпечує життєво важливий захист життя на поверхні Землі від високоенергетичного ультрафіолетового випромінювання, виділення ХФУ (поряд з іншими хімічними речовинами) викликало різку зміну озонового шару, включаючи збільшення полярної діри в озоновому шарі. В результаті ЄС закликав до повної заборони ХФУ (за якою послідували інші країни). На їх місці були розроблені нові хімічні речовини зі схожими властивостями холодоагенту. Ці сполуки містили C-H зв'язки (наприклад, C 2 HCl 2 F 3 і C 2 H 3 Cl 2 F), які легко розриваються в нижній атмосфері, обмежуючи тим самим транспорт до стратосфери.
карбонілові галогеніди
Відомі всі карбонілгалогеніди (X 2 C = O, X = F, Cl, Br, I) (табл.\(\PageIndex{1}\)). Фосген (Cl 2 C = O) був вперше синтезований Джоном Деві (рис.\(\PageIndex{2}\)) в 1812 році шляхом впливу суміші окису вуглецю та хлору сонячному світлу (7.8.10). Він назвав його фосгеном від грецької, phos (світло) та ген (народжений), стосовно використання світла для сприяння реакції. Фторид також отримують шляхом реакції чадного газу з галогеном, в той час як бромід отримують частковим гідролізом CbR 4 сірчаною кислотою.
\[ \text{CO + Cl}_2 \rightarrow \text{Cl}_2\text{C=O} \]

Синтез ізоціанатів з алкіл або ариламінів ілюструє електрофільний характер фосгена і його здатність вводити еквівалент «СО 2+», (7.8.11). Ця реакція проводиться в присутності такої основи, як піридин, яка поглинає хлористий водень. Фосген також може використовуватися для отримання ацилхлоридів з карбонових кислот (7.8.12). Однак тіонілхлорид частіше і безпечніше використовується в цій реакції.
\[ \text{RNH}_2 \text{ + Cl}_2\text{C=O} \rightarrow \text{RN=C=O + 2 HCl} \]
\[ \text{RCO}_2\text{H + Cl}_2\text{C=O} \rightarrow \text{RC(O)Cl + HCl + CO}_2 \]
Фосген як зброя війни
Фосген - токсичний газ із запахом «новоскошеного сіна» і використовувався в хімічній боротьбі під час Першої світової війни (рис.\(\PageIndex{3}\)), де він був більш потужною зброєю, ніж хлор. Хоча хлор був потенційно смертельним, він викликав жертву жорстоко кашляти і задихатися (природний захист тіла до обмеження вдихання), на відміну від цього, фосген викликав набагато менше кашлю, в результаті чого більше його вдихнули. Фосген часто мав відстрочений ефект; очевидно, здорових солдатів було знято з отруєнням фосгеном газу до 48 годин після інгаляції. Смертельна доза фосгену в кінцевому підсумку призвела до поверхневого дихання і ривоти, пульсу до 120, попелястого обличчя і скидання чотирьох пінт жовтої рідини з легенів щогодини протягом 48 потопаючих спазмів.

Хоча температура кипіння фосгена (7,6° C) означала, що це пара, так звана «біла зірка» суміш фосгену та хлору зазвичай використовувалася на Соммі, оскільки хлор постачав необхідну пару, з якою переносити фосген. Короткий опис жертв, заподіяних бойовими хімічними агентами під час Великої війни, наведено в табл\(\PageIndex{5}\).
| Країна | Загальна кількість жертв | Смерть |
| Росія | 419 340 | 56 000 |
| Німеччина | 200 000 | 9 000 |
| Франція | 190 000 | 8 000 |
| Британська імперія | 188 706 | 8 109 |
| Австро-Угорщина | 100 000 | 3 000 |
| США | 72 807 | 1 462 |
| Італія | 60 000 | 4 627 |
| Інші | 10 000 | 1 000 |