6.10: сполуки бору з донорами азоту
- Page ID
- 17653
Одиниця «B-N» - ізоелектронна (3 + 5 валентних електронів) до одиниці «С-С» (4 + 4 валентних електронів). Ці два фрагменти також є ізоглобальними, і як такі є багато типів з'єднань, утворених вуглецем, мають аналогічні похідні в хімії бору азоту.
Льюїс кислотно-лужні добавки сполуки
Сполуки бору, BX 3, є сильними кислотами Льюїса і як такі утворюють стабільні добавки з основами Льюїса, зокрема з лігандами донорів азоту.
\[ \text{BF}_3 \text{ + NMe}_3 \rightarrow \text{F}_3\text{B-NMe}_3\]
В принципі ці кислотно-лужні комплекси Льюїса повинні бути схожі з їх ізоглобальними вуглеводневими аналогами, однак, тоді як диполь в етані дорівнює нулю (по симетрії), диполь в H 3 NBH 3 дорівнює 5,2 D як наслідок різниці електронегативності Паулінга (тобто B = 2.04 і N = 3.04). Саме цей диполь, як правило, диференціює B-N сполуки від їх аналогів С-С.
Гомолітичне розщеплення зв'язку С-С в етані дасть два нейтральних метильних радикали, (6.7.2). На відміну від цього, гетеролітичне розщеплення призведе до утворення двох заряджених видів (6.7.3). Таким чином, продукти або мають чистий спин, (6.7.2), або чистий заряд, (6.7.3). На відміну від цього, розщеплення B-N зв'язку в H 3 N-BH 3 або дає продукти як зі спіном, так і з зарядом, (6.7.5), або ні, (6.7.4). Гетеролітичне розщеплення B-N зв'язку дає нейтральні сполуки (6.7.4), тоді як гемолітичне розщеплення призводить до утворення радикальних іонів (6.7.5).
\[\text{H}_3\text{C-CH}_3 \rightarrow \cdot\text{CH}_3 \text{ + } \cdot\text{CH}_3 \]
\[\text{H}_3\text{C-CH}_3 \rightarrow \text{CH}^+_3 \text{ + } \cdot\text{CH}^-_3\]
\[\text{H}_3\text{N-BH}_3 \rightarrow \text{NH}_3 \text{ + BH}_3 \]
\[\text{H}_3\text{N-BH}_3 \rightarrow \text{NH}^+_3\cdot \text{ + BH}^-_3\cdot\]
Різниця міцності зв'язку між Н 3 N-BH 3 і етаном відбивається на різниці довжин зв'язків (табл.\(\PageIndex{1}\)).
| З'єднання | Довжина облігації (Å) | Міцність зв'язку (ккал/моль) |
| Н 3 С-СН 3 | 1.533 | 89 |
| Н 3 Н-БГ 3 | 1.658 | 31 |
Амінобани
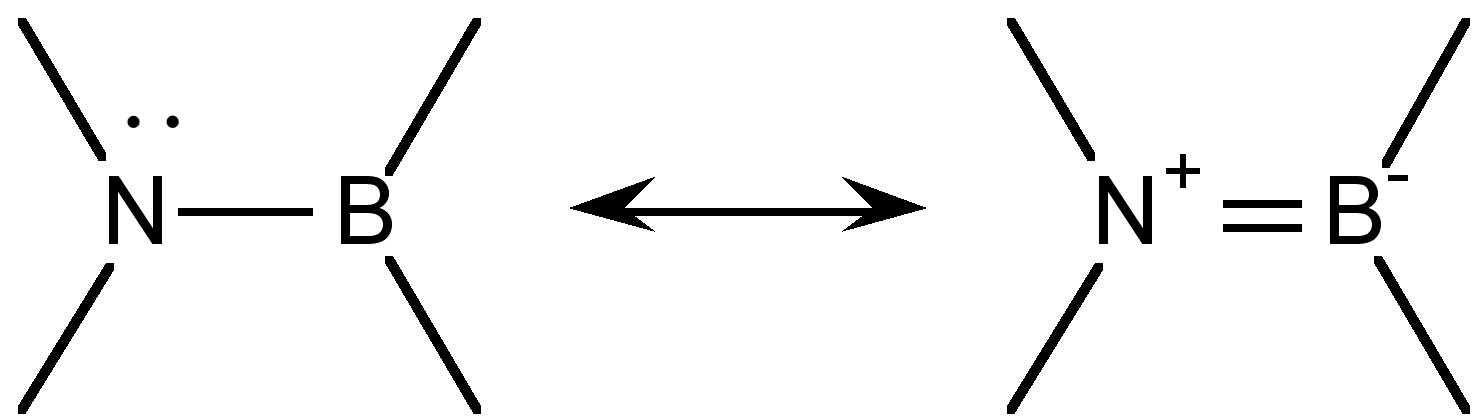
Група R' 2 N-BR 2 є ізоелектронною і ізоглобальною до олефіну субодиниці R' 2 C = CR 2, і існує навіть помітний π-зв'язуючий характер (рис.\(\PageIndex{1}\)). Міру множинного характеру зв'язку можна побачити з порівняння розрахункового зв'язку B-N в H 2 NBN 2 (1.391 Å) порівняно з типовим олефіном (1.33 Å). Цікаво, що розгляд можливої резонансної форми (рис.\(\PageIndex{1}\)) припускає, що диполь у σ-зв'язку знаходиться в протилежному напрямку, ніж у π-зв'язку.
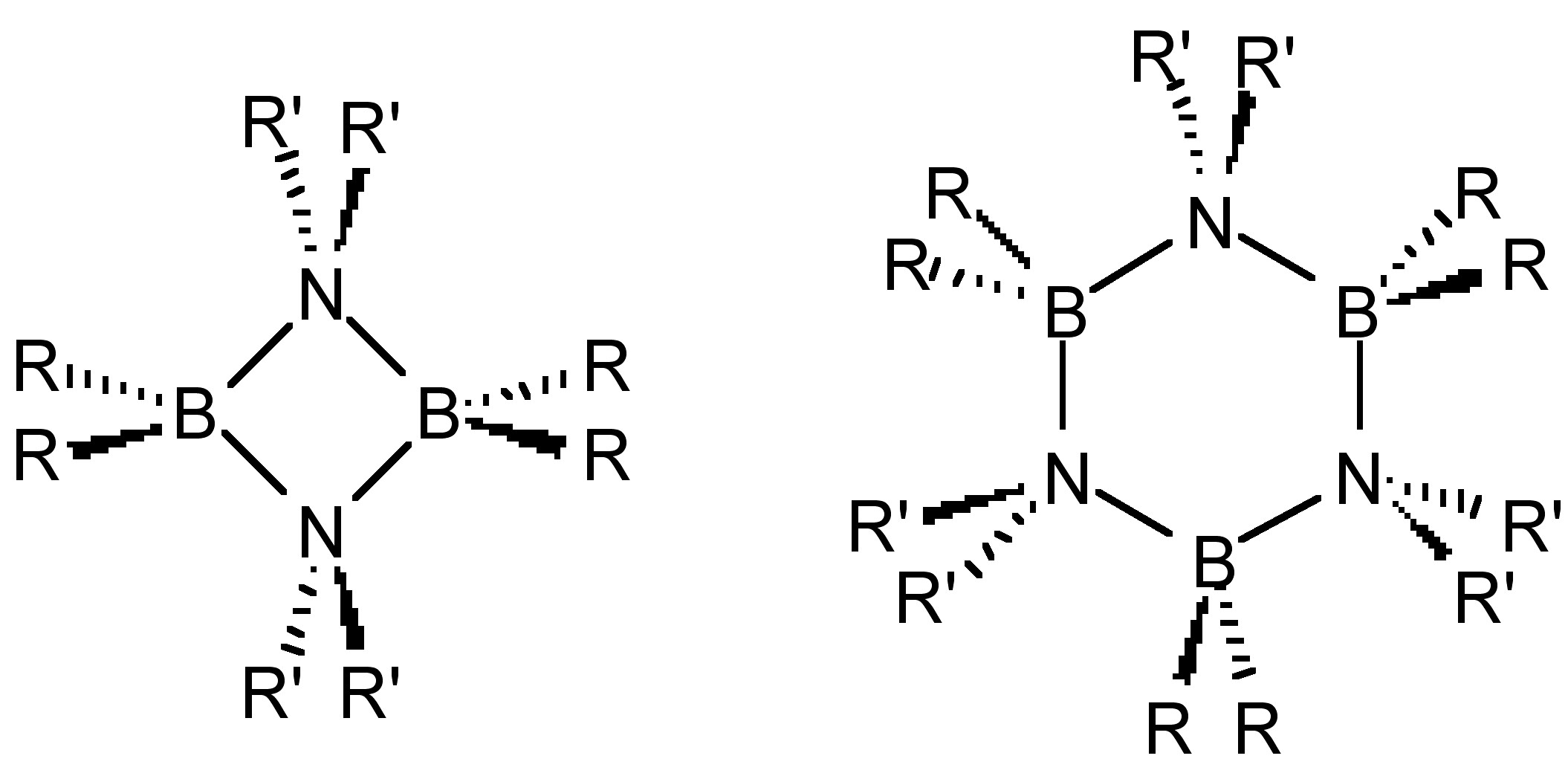
На відміну від олефінів, боразини олігомеризуються з утворенням диммерів і тримерів (рис.\(\PageIndex{2}\)) при відсутності значних стеричних перешкод. Аналогічні структури спостерігаються і для інших гомологів групи 13-15 (R 2 AlNr' 2, R 2 GapR' 2 та ін.).
Боразини
Конденсація гідриду бору аміаком призводить до утворення бензольного аналога: боразин, (6.7.6). Заміщені похідні утворюються в результаті реакції з первинними амінами.
\[ \text{BH}_3 \text{ + NH}_3 \rightleftharpoons \text{H}_3\text{B-NH}_3 \xrightarrow[\text{- H}_2]{\Delta} \text{[H}_2\text{B-NH}_2\text{]}_n \xrightarrow[\text{- H}_2]{\Delta} \text{[HBNH]}_6\]
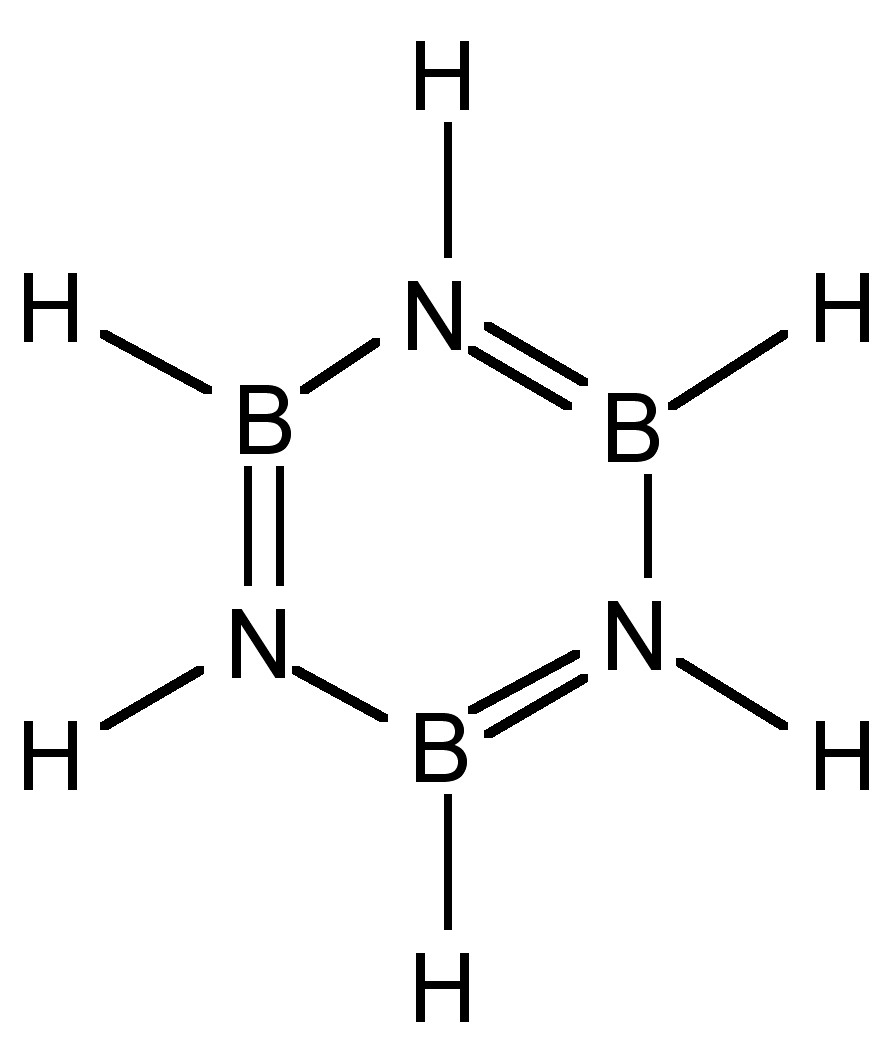
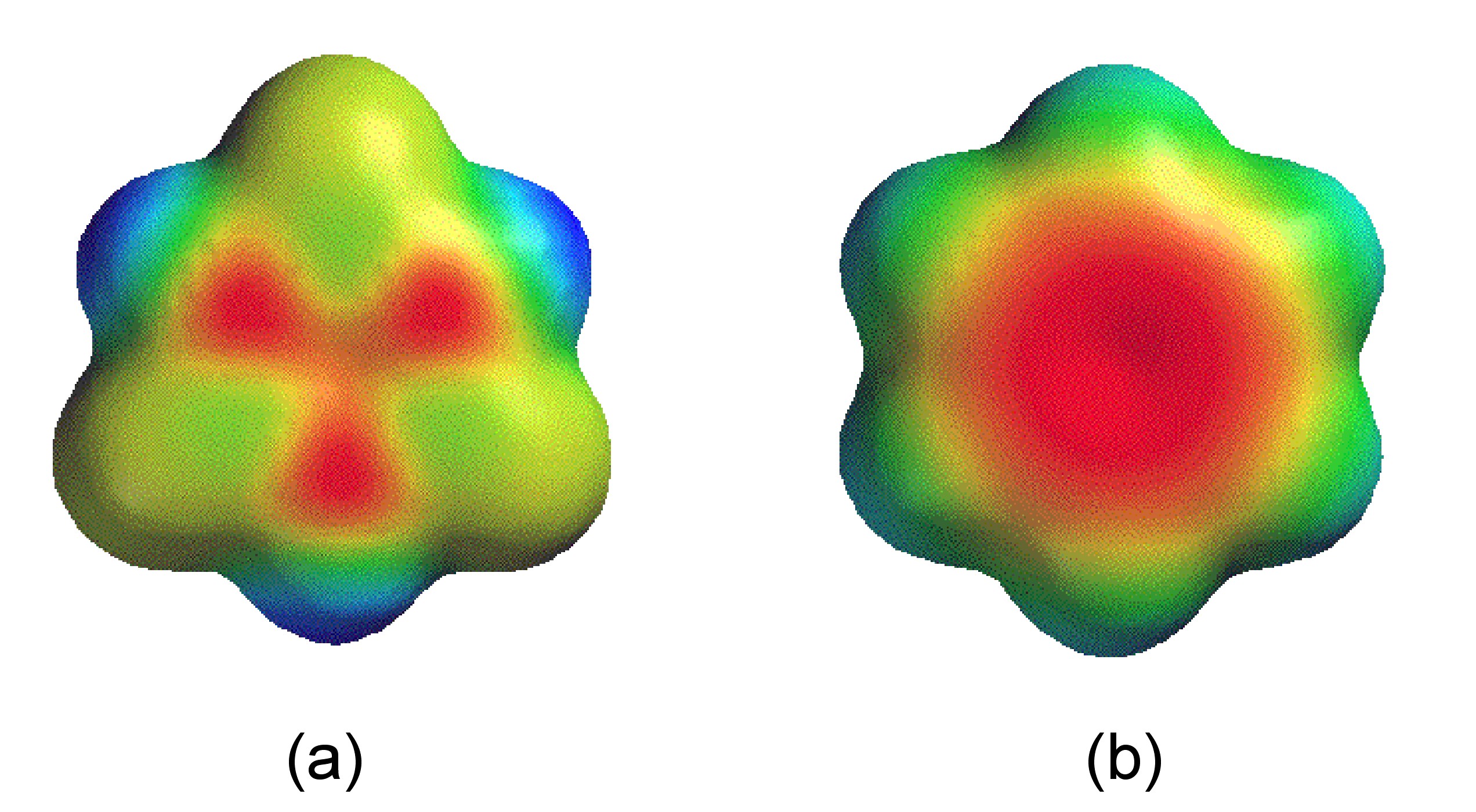
Незважаючи на циклічну будову (рис.\(\PageIndex{3}\)), боразин не є справжнім аналогом бензолу. Незважаючи на те, що всі відстані зв'язку B-N рівні (1,44 Å), що відповідають делокалізованій структурі, різниця в електронегативності бору та азоту (2,04 та 3.04 відповідно) призводить до поляризації зв'язків (тобто B Δ+ -N δ-) і, отже, до межі делокалізації. Молекулярні орбіталі π-системи в боразині за зовнішнім виглядом кускові (рис.\(\PageIndex{4}\) А) порівняно з бензолом (рис.\(\PageIndex{4}\) Б). Цей нерівномірний розподіл робить боразин схильним до реакцій додавання, роблячи його як молекулу менш стабільною, ніж бензол.
Іміноборани: аналоги ацетилену
Іміноборани, RB = NR', є аналогами алкінів, але, як і аміноборани, виділяються лише як мономери зі стерильно перешкодженим існуючим. При відсутності достатньої стеричної об'ємної олігомеризації відбувається, утворюючи заміщені бензольні аналоги.
Нітриди бору: аналоги елементарного вуглецю
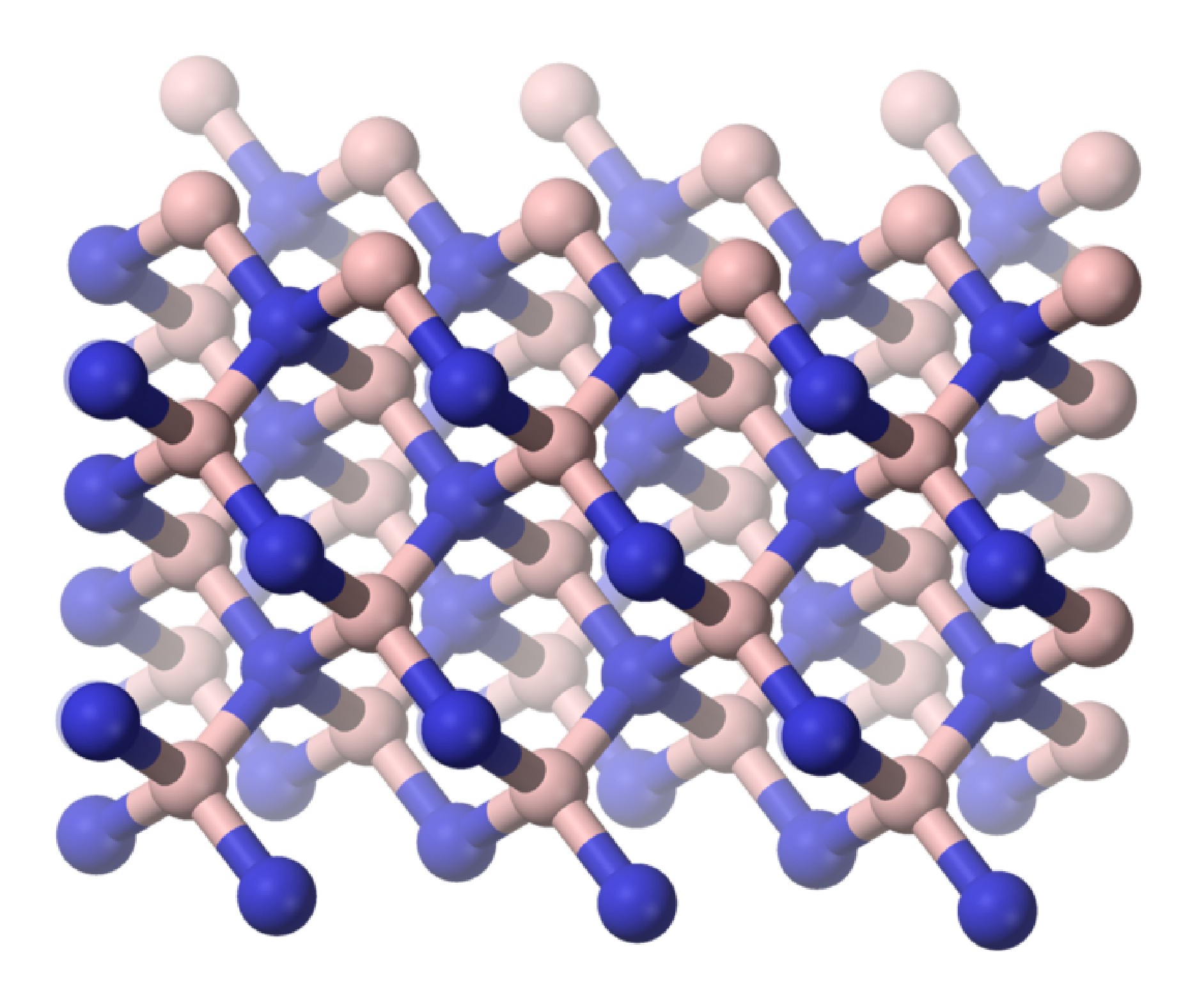
Злиття бури, Na 2 [B 4 O 5 (OH) 4] з хлоридом амонію (NH 4 Cl) призводить до утворення гексагонального нітриду бору (h-bN). Хоча H-bN має плоску шарувату структуру, що складається з шестичленних кілець, схожих на графіт (рис.\(\PageIndex{5}\)), Він являє собою біле тверде тіло. Різниця в кольорі є симптоматикою більш локалізованого склеювання в BN, ніж в графіті.

Як встановлено для його вуглецевого аналога, гексагональний нітрид бору (h-bN або α-Bn) перетворюється при високих температурах (600 - 2000° C) і тиску (50-200 кбар) у кубічну фазу (C-BN або β-Bn). Подібно до алмазу, Cubic-BN дуже важко насправді може різати алмаз, і, як наслідок, його основне використання - як промисловий шліфувальний агент. Кубічна форма має кристалічну структуру сфалериту (рис.\(\PageIndex{6}\)). Нарешті, відома вурцитова форма нітриду бору (W-bN), яка має подібну структуру, як лонсдалеїт, рідкісний гексагональний поліморф вуглецю. \(\PageIndex{2}\)У таблиці наведено порівняння властивостей гексагональної і кубічної фаз БН з їх вуглецевими аналогами.
| Фаза | Вуглець | Нітрид бору |
|---|---|---|
| Кубічний | Безбарвний, твердий, мп = 3550 °С, С-С = 1,514 Å | Безбарвний, твердий, B-N = 1,56 Å |
| шестикутна | Чорне тверде тіло, площинні шари, провідник, mp = 3652 - 3697° C (субліми), C-C = 1.415 Å | Біле тверде тіло, площинні шари, напівпровідник (Eg = 5.2 еВ), mp = 2973° C (субліми), B-N = 1,45 Å |
Частково іонна структура шарів BN в h-bN зменшує ковалентність та електропровідність, тоді як міжшарова взаємодія збільшується, що призводить до більшої твердості h-bN щодо графіту.
Бібліографія
- Біссетт і Т.М. Гілберт, Органометаліка, 2004, 23, 850.
- П.Паетцольд, адв. ін.г. Хім. , 1987, 31, 123.
- Л.Р. Торн, Р.Д. Суенрам, і Ф.Дж. Ловас, Дж. Фіз. , 1983, 78, 167.