10.2: Принципи карбонільних комплексів
- Page ID
- 18366
Введення в карбонільні комплекси
У цьому розділі ми докладніше розглянемо карбонільні комплекси, часто просто звані карбонілами. Чому? Вони цікаві з ряду причин. По-перше, це досить великий клас з'єднань з різноманітною координаційної хімією. Дізнаємося, що СО ліганд може зв'язуватися з металом різними, іноді неочевидними способами. Крім того, карбоніли часто використовуються в якості вихідних матеріалів для інших координаційних сполук. Це пояснюється тим, що карбонільний ліганд не має заряду, а чадний газ - газ. Через це реакцію заміщення ліганду можна легко загнати в праву сторону шляхом продувки СО з реакційної судини. СО - це одиниця С 1, і це часто використовується в каталізі з карбонілами. Карбоніли часто є проміжними речовинами в реакціях, які додають один атом вуглецю до вуглеводневого ланцюга. Захоплюючим фундаментальним властивістю карбонілів є те, що його\(\pi\) -приймаючі властивості стабілізують метали в низьких, іноді навіть негативних числах окислення.
Склеювання в СО

Малюнок\(\PageIndex{1}\): Склеювання в молекулі СО. Діаграма МО (зліва) та відповідна структура валентних зв'язків (праворуч). Для більш детальної роз'яснення натисніть тут.
Вуглець в молекулі СО є більш реактивним кінцем, і тому СО воліє зв'язуватися з вуглецем з металом, а не з киснем. Це не очевидно, оскільки вуглець менш електронегативний, ніж кисень. Причина полягає в тому, що HOMO молекули СО є приблизно незв'язною орбіталлю, яка в першу чергу локалізується на вуглеці (рис.\(\PageIndex{1}\)). У картині валентного зв'язку він нагадує електрон-одиночну пару у атома вуглецю. Електронна одинока пара на кисні нагадує молекулярну орбіталь 2a 1, яка має значно нижчу енергію, тому вона рідко використовується в зв'язку. Обидва\(\pi\) і\(\pi\) *-орбіталі відносно близькі за енергією до HOMO, і, таким чином, ці орбіталі також можуть бути використані для склеювання в карбонілах. Це пояснює різноманітну координаційну хімію карбонілів.
σ-зв'язування режимів карбонільного ліганду
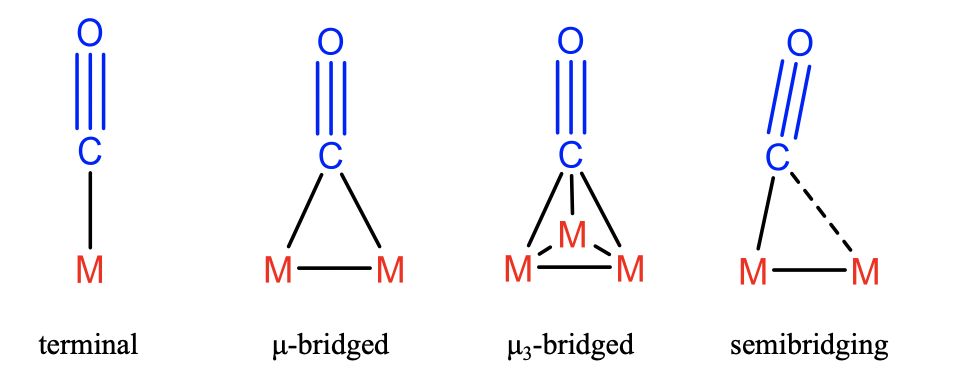
У найпростішому випадку СО використовує свою електронну одиночну пару у вуглецю для зв'язування з одним атомом металу M (рис.\(\PageIndex{2}\)). У цьому випадку ми називаємо СО термінальним карбонільним лігандом. Крім того, не виключено, що електронна одинока пара ділиться між двома або навіть трьома металами, які з'єднані між собою за допомогою зв'язків метал-метал. У цих випадках ми говоримо, що СО діє як\(\mu\) -мостовий, і\(\mu_3\) -бригадний ліганд відповідно. Якщо два металу, скріплених між собою зв'язком метал-метал, різні, то взаємодія СО з одним металом може бути міцніше, ніж з іншим. У цьому випадку ліганд СО виступає в ролі напівмостового ліганда. У всіх цих випадках СО діє як 2-електронний донор, оскільки він дарує свої два електрони в електронній парі в атомі вуглецю.
На додаток до електронної одиночної пари у вуглецю ліганд СО також може використовувати свої зв'язування\(\pi\) -орбіталі для донорства електронів в металеві орбіталі (рис.\(\PageIndex{3}\)). Однак ці електрони можуть бути використані лише спільно з електронною одинокою парою при С, оскільки електронна пара має вищу енергію, ніж\(\pi\) -електрони, і електрони вищої енергії завжди використовуються першими. З стеричних причин електронна одинока пара і\(\pi\) -електрони завжди подаються різним металам, які утримуються між собою металево-металевими зв'язками.
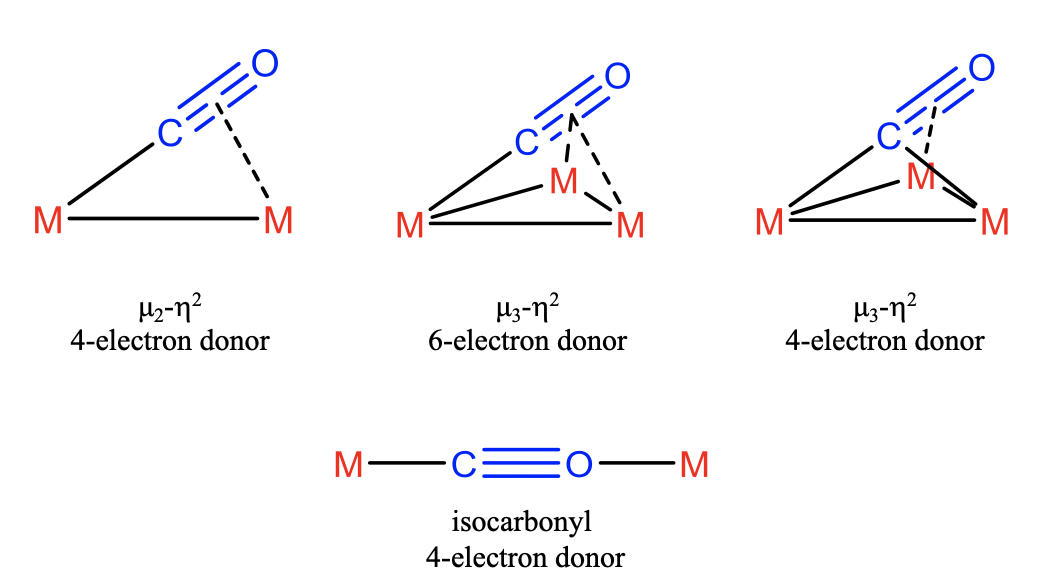
У найпростішому випадку ліганд СО зв'язується в\(\mu_2\) -\(\eta_2\) режимі, що означає, що електронна одинока пара зв'язується з одним металом, а два\(\pi\) -електрони зв'язуються з іншим. При цьому ліганд СО виступає в ролі 4-електронного донора. Крім того, не виключено, що в зв'язку беруть участь всі чотири\(\pi\) -електрони крім одинокої пари електронів. У цьому випадку задіяні три атома металу. Перший взаємодіє з електронною парою, другий - з двома\(\pi\) -електронами, а третій - з двома іншими\(\pi\) -електронами. Оскільки три метали мостові, і обидва атоми ліганду беруть участь у зв'язку з металом, можна сказати, що СО зв'язується в\(\mu_3\) -\(\eta_2\) моді і діє як 6-електронний донор. Можливо також, що електрон-одиночна пара ділиться між двома металами, а два\(\pi\) -електрони подаються третьому металу. Також в цьому випадку ліганд зв'язується по\(\mu_3\)\(\eta_2\) - моді, але виступає в ролі 4-електронного донора. Інший спосіб, яким ліганд СО може діяти як 4-електронний донор, - це коли він діє як ізокарбонільний ліганд. У цьому випадку він використовує свої електронні пари як на C, так і на O-атомах. Це можливо лише тоді, коли стеричні обставини сприяють використанню одиничної пари О-електронів над енергетично вищими\(\pi\) електронами. Таке трапляється рідко.
\(\pi\)-режими зв'язування карбонільного ліганду
Карбонільний ліганд може використовувати свої\(\pi\) *-орбіталі для склеювання з металевими\(\pi\) d-орбіталями по-моді. Ліганд діє як\(\pi\) -акцептор. Існує дві можливості прив'язки (рис.\(\PageIndex{4}\)).
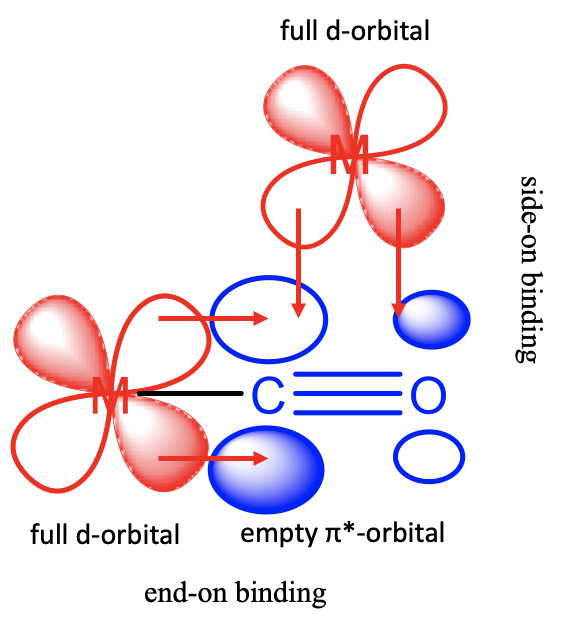
Перший з них виникає, коли Ко-ліганд діє як кінцевий ліганд, що зв'язує кінець на. У цьому випадку дві частки\(\pi\) *-орбіталів у вуглецю взаємодіють з частками металу d-орбіталі. Також зв'язкові\(\pi\) орбіталі мають правильну симетрію, щоб перекриватися металевою d-орбіталлю в цьому режимі, але їх енергії набагато далі від енергій d-орбіталів, так що цими взаємодіями можна знехтувати. Друга можливість полягає в тому, що СО зв'язується збоку на металево-d-орбіталі. При цьому одна частка при С і одна частка при О взаємодіє з металом d-орбіталі. Ці взаємодії є менш сильними порівняно з кінцевими взаємодіями, оскільки орбітальне перекриття є менш ефективним через нерівний розмір часток\(\pi\) орбіталі*. \(\pi\)*-орбітальний в основному локалізується на атомі вуглецю, оскільки атом вуглецю є більш електропозитивним атомом. Зверніть увагу, що склеювання\(\pi\) -орбіталі не мають правильної симетрії, щоб перекриватися з metal-d орбітальної в\(\pi\) -моді, вони можуть перекриватися лише в σ-моді, коли прив'язка знаходиться збоку.
Модель Дьюар-Чатта-Данкансона
Взаємодії σ-донора та\(\pi\) -акцептора в карбонільних комплексах синергетично підсилюють один одного. Цей синергетичний ефект називається моделлю Дьюара - Чатта-Данкансона для карбонілів. Як ми можемо зрозуміти синергетичні взаємодії. Розглянемо карбонільний ліганд, який зв'язує наскрізний з металом.

Давайте спочатку розглянемо σ-донорські взаємодії. Електронна одинока пара на вуглеці дарує електронну щільність в порожні металеві d-орбіталі і утворюється давальний зв'язок між металом і вуглецем. Донорована електронна щільність підсилює енергію d-електронів металу за рахунок посилення електронно-електронного відштовхування. Через свою підвищену енергію d-електрони легше приймаються карбонільним лігандом через\(\pi\) -акцепторні взаємодії. Взаємодії\(\pi\) -акцептора збільшують порядок зв'язку між металом і вуглецевим зв'язком. При цьому порядок зв'язку між вуглецем і киснем зменшується через те, що електронна щільність була перенесена з металу в\(\pi\) *-орбіталі (рис.\(\PageIndex{5}\)).
Сила взаємодій\(\pi\) -акцептора може значно відрізнятися у карбонілів. Можна намалювати три різні структури для слабких, проміжних і сильних\(\pi\) -акцепторних взаємодій (рис\(\PageIndex{6}\).\(\PageIndex{8}\)

Коли присутні лише слабкі взаємодії, ми можемо представляти зв'язок M-C як єдиний зв'язок, а зв'язок C-O як потрійний зв'язок.

Коли взаємодії мають проміжну міцність, ми можемо представляти як зв'язок M-C, так і зв'язок C-O як подвійні зв'язки.

Коли взаємодія\(\pi\) -акцептор сильна, то зв'язок M-C стає потрійним зв'язком, а зв'язок C-O стає єдиним зв'язком.
Від чого залежить сила взаємодій\(\pi\) -акцептора? Це залежить здебільшого від заряду на карбоніл. Карбонільні катіони із зарядом +2 або вище, як правило, мають слабкі\(\pi\) -акцепторні взаємодії. Нейтральні карбоніли або карбоніли з зарядом +1 або -1 мають проміжні\(\pi\) -акцепторні взаємодії. а ті з негативним зарядом 2- і вище мають сильні\(\pi\) -акцепторні взаємодії. З цього видно, що чим менше позитивний заряд і чим вище негативний заряд, тим вище порядок зв'язку метал-вуглець, і тим міцніше зв'язок метал-вуглець. Як наслідок негативні заряди мають тенденцію стабілізувати карбоніли, тоді як позитивні заряди дестабілізують їх. Тому карбонілатні аніони, як правило, більш стабільні порівняно з карбонільними катіонами. Стабільність нейтральних карбонілів є проміжною.
Гомолептичні карбоніли перехідних металів
Розібравшись з принципами склеювання в карбонілах, давайте далі подумаємо про те, які структури роблять карбоніли перехідних металів. Структури слідують здебільшого правилу 18 електронів. Для найпростіших гомолептичних карбонілів, в яких карбонільний ліганд зв'язується наприкінці з перехідним металом, що діє як двоелектронний донор, ми просто збираємо стільки лігандів, скільки потрібно, поки у нас не буде 18 електронів. Це дало б нам координаційний номер у карбонілі, з якого ми могли б відняти структуру. Це добре працює для перехідних металів з парним числом валентних електронів.

У цьому випадку кількість лігандів х становить всього 18 мінус кількість електронів металів, розділене на 2. Тому ми очікуємо мононуклеарного карбонілу типу M (CO) x (рис.\(\PageIndex{9}\)). Для металів з непарною кількістю електронів ситуація складніша, оскільки непарне число на два, помножене на ціле число, ніколи не дає 18. У цьому випадку до металу додається стільки лігандів x, скільки потрібно для створення 17-валентного електронного комплексу, а потім 17-валентний електронний комплекс димеризується, утворюючи двоядерний карбоніл композиції M 2 (CO) x. Винятком є ванадій. Це робить гексакарбоніл валентного електрона ванадію 17, який не димеризується, оскільки координаційне число 7 не є сприятливим.
Гомолептичні карбоніли 6-ї групи (М = Cr, Mo, W)
Тепер розглянемо докладніше карбоніли з металами з парною кількістю електронів. Ми можемо почати з групи 6, яка містить елементи хром, молібден і вольфрам. Наше завдання - визначити склад і структуру карбонілів.

Згідно з правилом 18 електронів нам потрібно загалом 18 електронів. Скільки вноситься металом? Оскільки метали знаходяться в групі 6, всі вони мають шість електронів. Карбоніли не несуть заряду, тому немає електронів, які слід віднімати або додавати. Скільки електронів лігандів нам потрібно, щоб дістатися до 18? Ну, тобто 18-6 = 12 електронів. Скільки карбонільних лігандів потрібно тоді? Оскільки кожен ліганд вважається донором двох електронів, нам потрібні 12/2 = 6 лігандів. Таким чином, склад карбонілу буде M (CO) 6. Карбоніл приймає восьмигранну форму, щоб максимізувати відстань лігандів один від одного. Карбоніли групи 6 - безбарвні, кристалічні та сублімовані тверді речовини.
Заряджені октаедричні карбоніли з 18 електронами
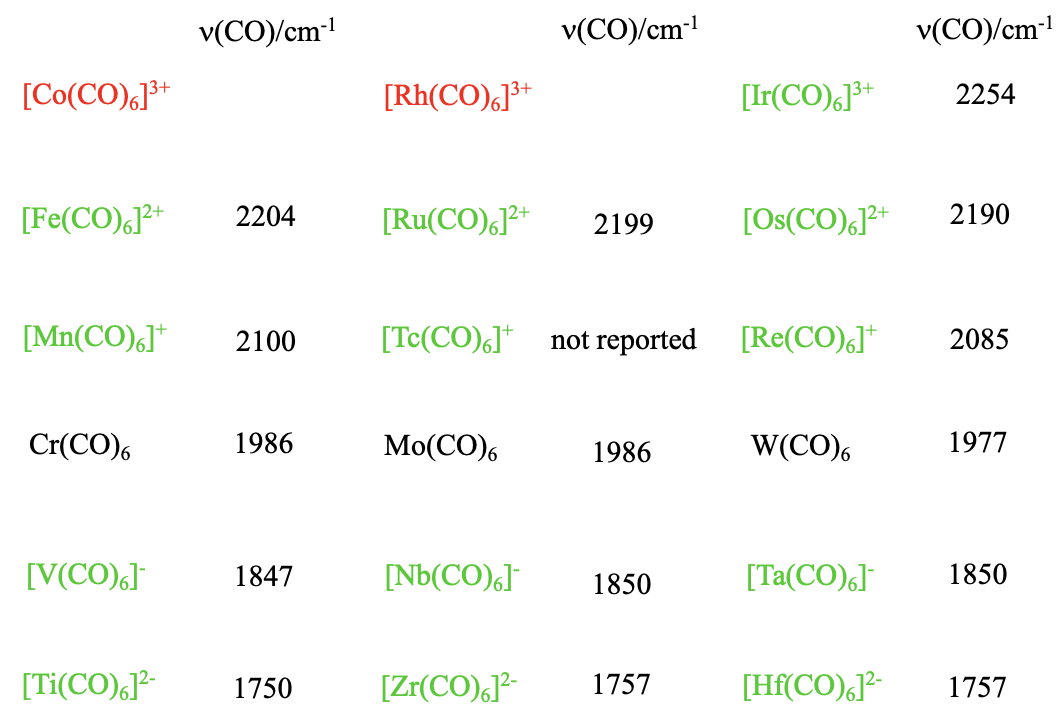
Чи існують також інші 18 e карбоніли типу M (CO) 6 з іншими металами, але групи 6 металів? Так, але заряд у карбонілу потрібно відрегулювати так, щоб в комплексі було 18 електронів. Наприклад, ми можемо замінити Cr на V, але тоді нам потрібен 1- заряд, який призводить до карбонілату формули V (CO) 6 -. Чому? Ванадій знаходиться в групі 5 і має на один електрон менше хрому. З цієї причини ми повинні додати електрон, який дає комплексу 1- заряд. Також відомі вищі гомологи Nb (CO) 6 - і Ta (CO) 6. Що робити, якщо ми підемо далі вліво в таблиці Менделєєва? Титан залишився до ванадію, і має чотири валентних електронів. Тому 18-валентний електрон гексакарбоніл титану має 2- заряд, а формула - Ti (CO) 6 2-. Знову ж таки, відомі вищі гомологи Ti (CO) 6 2-, Zr (CO) 6 2- і Hf (CO) 6 2-. Чи можемо ми також перейти вправо в таблиці Менделєєва? Марганець сидить праворуч від хрому. Марганець має на один електрон більше хрому, тому 18-електронний гексакарбоніл марганцю повинен бути карбонільним катіоном із зарядом 1+, а формула - Mn (CO) 6 2+. З вищих гомологів також відомі як Tc (CO) 6 +, так і Re (CO) 6 +. Праворуч від Mn знаходиться Fe, який має 8 валентних електронів. Тому 18-електронний гексакарбоніл заліза повинен мати заряд 2+, а формула - Fe (CO) 6 2+. Відомі також вищі гомологи Ru (CO) 6 2+ і Os (CO) 6 2+. Чи можемо ми піти ще далі вліво, до Ко? Очікувана формула карбонілу Co (CO) 6 3+, але це невідомо, і ні вищий гомолог, Rh (CO) 6 3+. Виділено лише Ir (CO) 6 3+. Це відображає загальну тенденцію в карбонільної хімії. Позитивні заряди дестабілізують карбоніл, а карбоніли з високими позитивними зарядами часто не стабільні. З іншого боку, негативні заряди стабілізують карбоніл і навіть карбонілати з високими негативними зарядами стабільні. Ми можемо легко пояснити це тим, що порядок зв'язку між металом і вуглецем зменшується зі збільшенням позитивного заряду, і збільшується зі збільшенням негативного заряду. Збільшення порядку зв'язку підсилює стабільність карбонілу. З цього ми бачимо, що властивості\(\pi\) -акцептора досить важливі для стабільності карбонілів. Ми також бачимо, що в карбонілатах числа окислення металів негативні. Негативні числа окислення досить незвичні для металів. Зроблено висновок, що карбонільний ліганд має незвичайну властивість стабілізувати метал в негативних станах окислення.
Чи є спосіб легко виміряти порядок зв'язку M-C зв'язку? Ми можемо зробити це побічно, вимірюючи ІЧ-спектр карбонілу. Оскільки порядок зв'язку зв'язку C-O зменшується зі збільшенням порядку зв'язку M-C, хвильовий номер для вібрації розтягування C-O може бути використаний як міра для порядку зв'язку M-C. Чим менший хвильовий номер, тим нижчий порядок облігацій C-O, і тим вище порядок облігацій M-C. Коли ми дивимося на цифри для різних карбонілів протягом певного періоду, ми бачимо, що, як і очікувалося, хвильові числа збільшуються зі збільшенням числа групи, що вказує на зменшення порядку зв'язку. Ми також можемо подивитися вниз групи. Ми бачимо, що в цьому випадку цифри майже не змінюються, а це означає, що на порядок зв'язку навряд чи впливає період металу.
Гомолептичні карбоніли 8-ї групи (Fe, Ru, Os)
Які нейтральні карбоніли заряду ми очікували б для групи 8 елементів Fe, Ru та Os?

Загалом, ці карбоніли повинні мати 18 електронів. При цьому метали мають 8 електронів. Заряд дорівнює 0. Це означає, що ми мали б 18-8 = 10 електронів, які повинні були б надходити з ліганду. Тому кількість лігандів, необхідних, буде 10/2 = 5. Таким чином, ми очікували б пентакарбоніли складу M (CO) 5 (рис.\(\PageIndex{12}\)). Ці карбоніли приймають тригонально-біпірамідальну форму. Карбоніли групи 8 - це всі рідини. Пентакарбоніл заліза має світло-помаранчевий колір, тоді як рутеній та карбоніли осмію безбарвні.
Заряджені тригонально-біпірамідні карбоніли з 18 електронами
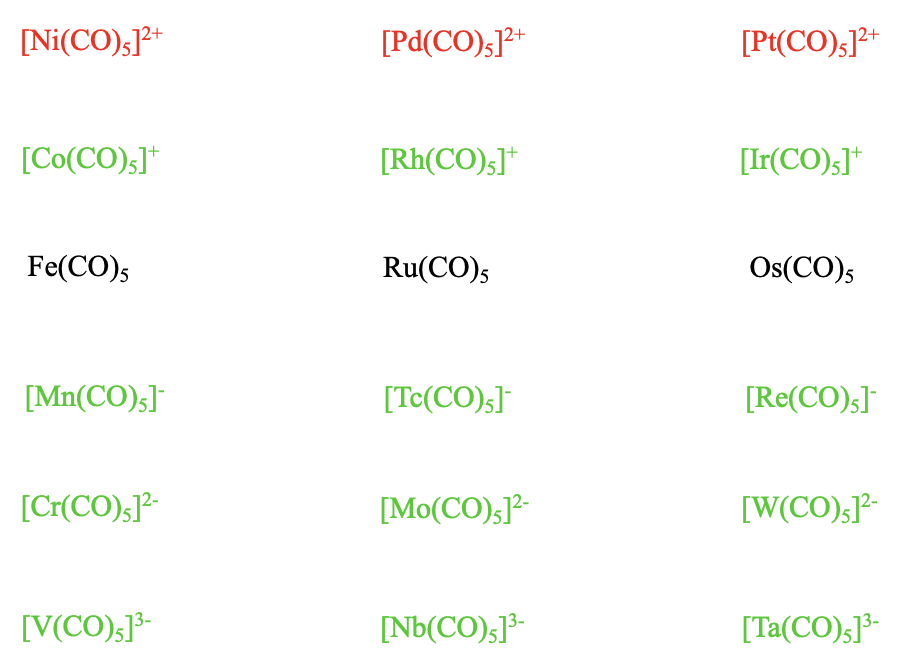
Ми можемо знову запитати, чи є заряджені ізостеричні пентакарбоніли з 18 е металів, відмінних від металів групи 8. Відповідь - так. Марганець залишився залізу в таблиці Менделєєва і має на один електрон менше. Тому його пентакарбоніл повинен мати 1- заряд, а склад - Mn (CO) 5 -. Також існують вищі гомологи, Tc (СО) 5 - і Re (СО) 5. Cr має на один електрон менше, ніж Mn, тому його пентакарбоніл має 2- заряд і формула Cr (CO) 5 2-. Також відомі Мо (СО) 5 2- і W (СО) 5 2-. У ванадію інший електрон менше, оскільки він знаходиться в 5-й групі, тому його пентакарбоніл має 3- заряд, а формула V (CO) 5 3-. Знову ж таки, вищі гомологи, Nb (CO) 5 3- і Ta (CO) 5 3- також стабільні. Також для пентакарбонілатів високі негативні заряди не є проблемою для стабільності комплексів завдяки стабілізуючому ефекту\(\pi\) -акцепторних взаємодій. А як щодо карбонільних катіонів з тригональною біпірамідною формою? Коли ми переходимо від Fe до Co, нам потрібен заряд 1+ на карбонілі, щоб досягти 18 електронів. Відповідний катіон Co (CO) 5 + стабільний, як і їх вищі гомологи, Rh (CO) 5 + і Ir (CO) 5 +. Однак пентакарбонілові катіони групи 10 Ni (CO) 5 2+, Pd (CO) 5 2+ та Pt (CO) 5 2+ не є стабільними. 2+ позитивний заряд занадто послаблює метало-вуглецевий зв'язок. Така поведінка узгоджується з ослабленням зв'язку М-С при збільшенні позитивного заряду за рахунок більш слабких\(\pi\) -акцепторних ефектів.
Гомолептичні карбоніли групи 10 (Ni, Pd, Pt)
А як щодо карбонілів групи 10?

При цьому метали мають 10 електронів. Заряду немає. Необхідна кількість електронів лігандів становить 18-10 = 8 електронів. Таким чином, кількість лігандів становить 8/2=4. Тому склад - М (СО) 4 (рис.\(\PageIndex{14}\)). Форма чотиригранна, тому що ми маємо 18, а не 16-валентний електронний комплекс. Тетракарбоніл нікелю - летюча безбарвна рідина. Вищі гомологи Pd (CO) 4 і Pt (СО) 4 не є стабільними. Ми можемо пояснити це, пам'ятаючи, що\(\pi\) -орбітальне перекриття в чотиригранних комплексах, як правило, слабке. Тому вуглецевий зв'язок M-C менш ефективно стабілізується за допомогою\(\pi\) -акцепторних взаємодій порівняно з октаедричними та тригонально-біпірамідними карбонілами. Цей ефект ще більш виражений для карбонілів Pd і Pt, оскільки вони мають більші орбіталі, які можуть перекриватися ще менш ефективно з відносно невеликими\(\pi\) * -орбіталями ліганду СО. У цьому випадку\(\pi\) -акцепторні взаємодії настільки слабкі, що вся молекула вже не стабільна.
Заряджені тетраедричні карбоніли з 18 електронами

А як щодо заряджених 18 електронів тетраедричних карбонілів з іншими металами? Знову ж таки, негативно заряджені карбонілати стабільні навіть при високих негативних зарядах. Co (СО) 4 -, Fe (CO) 4 2-, Mn (CO) 4 3- та Cr (CO) 4 4- є стабільними, як і їх вищі гомологи. Відомий також Cu (CO) 4 +, який має позитивний заряд 1+, але його вищі гомологи, Ag (CO) 4 + та Au (CO) 4 + не є.
Загальні тенденції стабільності

В цілому стабільність карбонілів має тенденцію до зниження від 6 групи до групи 8 до групи 10 (рис.\(\PageIndex{16}\)). Ця тенденція пояснюється тим, що восьмигранна форма дозволяє найкраще орбітальне перекриття для\(\pi\) -акцепторних взаємодій, а потім тригональна біпірамідна, а потім чотиригранна форма. Стабільність також має тенденцію до зниження з 4-го по 6-й період. Цю тенденцію можна пояснити менш ефективним орбітальним перекриттям через все більш різний розмір орбіти між лігандом і металевими орбіталями. Ці ефекти досить великі для Pd (CO) 4 і Pt (CO) 4, щоб зробити їх нестабільними.
Карбоніли групи 4 та групи 12 (неіснуючі)
Ми обговорювали карбоніли групи 6, 8 та 10, але не групи 4 та групи 12. Чому? Тому що ніякі карбоніли цих груп не є стабільними. У чому причина? Для карбонілів групи 4 нам знадобиться сім карбонільних лігандів. Це призведе до координаційного числа семи, що є неприпустимо високим для карбонілів. Для карбонілів групи 12 нам знадобляться лише три карбонільні ліганди. Це призвело б до неприпустимо низького координаційного числа 3.
Гомолептичні карбоніли 7-ї групи (М = Mn, Tc, Re)
Тепер подумаємо, які структури утворюють гомолептичні карбоніли з металами, що мають непарну кількість електронів. Почнемо з 7-ї групи, яка складається з металів Mn, Tc і Re. Наш підхід полягає в тому, щоб побачити, скільки лігандів нам потрібно, щоб створити 17-валентний електронний фрагмент, а потім димеризувати цей фрагмент.
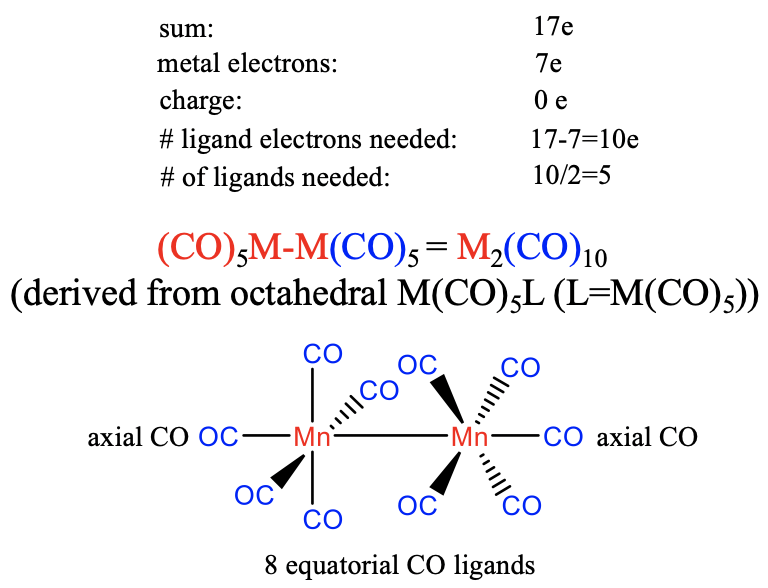
Метали групи 7 мають сім валентних електронів. Знову ж таки, будемо вважати, що заряду на карбонілі немає. Таким чином, кількість електронів лігандів для отримання фрагмента валентних електронів 17 становитиме 17-7 = 10. Отже, необхідна кількість лігандів становить 10/2 = 5, припускаючи, що карбонільний ліганд є 2-електронним донором, що зв'язує кінець на металі. Це дає фрагмент M (CO) 5, який димеризується, утворюючи карбоніл M 2 (CO) 10 із зв'язком метал-метал. Можна вважати, що структура походить від восьмигранної структури, в якій кожен метал оточений октаедрально п'ятьма лігандами СО та фрагментом M (CO) 5, що діє як шостий ліганд. Кожна одиниця M (CO) 5 має один осьовий ліганд і чотири екваторіальних ліганда, завдяки чому осьовий ліганд співспрямований з зв'язком метал-метал. Чотири екваторіальні ліганди першого металу знаходяться в шаховому порядку щодо чотирьох екваторіальних лігандів другого металу через стеричні аргументи відштовхування.
Заряджені ізоелектронні карбоніли типу М 2 (СО) 10
Чи можемо ми виготовити заряджені ізоелектронні карбоніли типу М 2 (СО) 10 з іншими металами? Відповідь так, але тільки карбонілатні аніони з низьким негативним зарядом і без карбонільних катіонів. Освіта карбонільних катіонів заборонено через ослаблення\(\pi\) -акцепторних взаємодій, що виникають в результаті позитивного заряду. Високі негативні заряди неможливі, оскільки занадто багато негативних зарядів на атомах металу призводять до електростатичного відштовхування та дестабілізації зв'язків метал-метал.
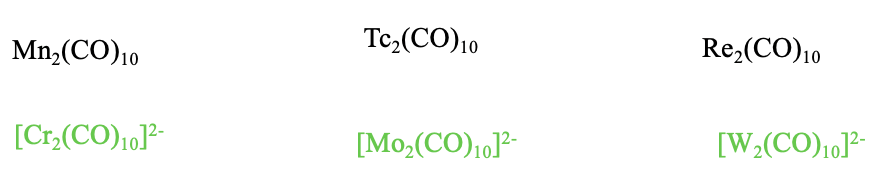
Тому існують тільки Cr 2 (CO) 10 2-, а вищі гомологи Mo 2 (CO) 10 2- і W 2 (CO) 10 2-, але ніяких інших карбонільних іонів типу M 2 CO 10.
Гомолептичні карбоніли 9-ї групи (М = Co, Rh, Ir)
Які передбачувані структури для гомолептичних карбонілів групи 9?
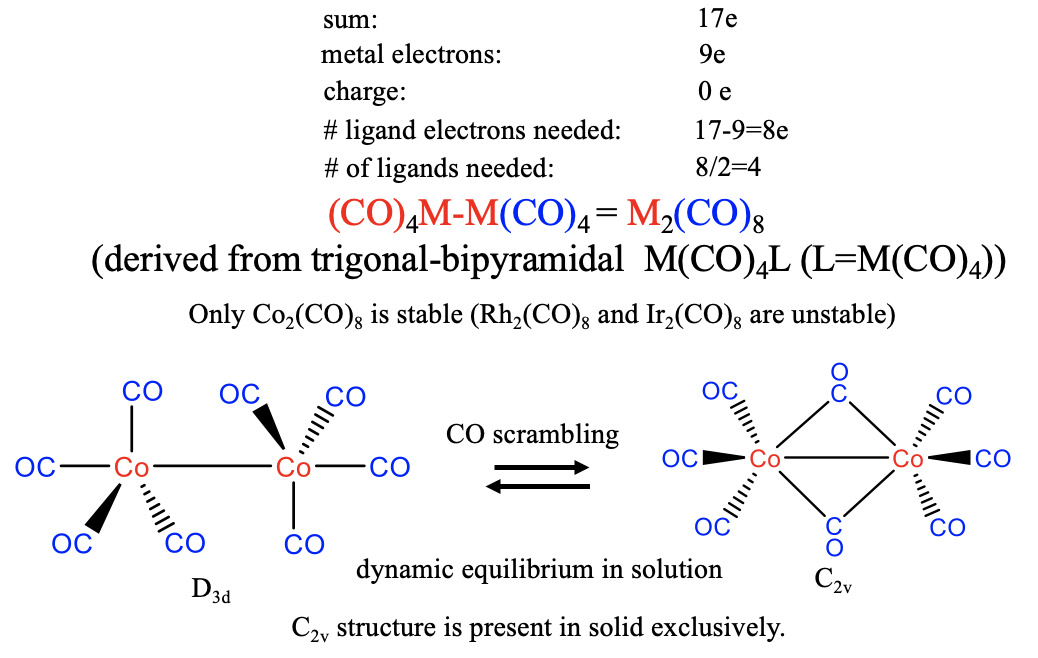
При цьому метал вносить 9 електронів, а це означає, що з карбонільного ліганду потрібно надходити 17-9 = 8 електронів. Тому нам потрібні молекули 8/2 = 4 CO, щоб створити валентний електронний фрагмент M (CO) 4 17. Потім два фрагменти димеризуються з утворенням двоядерного карбонілу складу M 2 CO 8. У природі ж реалізується тільки Ко-карбоніл, Rh і Ir аналоги нестабільні. Структура карбонілу Co 2 (СО) 8 може бути отримана з тригональної піраміди M (CO) 4 L, за допомогою якої L є другою одиницею M (CO) 4 (рис.10.2.19). Відповідно до цього координаційний номер дорівнює 5. Існують два осьових та шість екваторіальних лігандів, за допомогою яких екваторіальні ліганди орієнтовані в шаховому порядку. У розчині ця структура знаходиться в динамічній рівновазі з другою структурою з симетрією C 2v, в якій два ліганди СО з'єднуються. Завдяки цій рівновазі відбувається постійне скремблювання лігандів, що означає, що ліганди СО постійно переміщаються з осьових в екваторіальні положення і мігрують з одного атома металу в інший. У твердому стані структура типу C 2v присутня виключно вказує на те, що вона трохи більш стабільна.
Заряджені ізоелектронні карбоніли типу М 2 (СО) 8
Заряджені ізоелектронні карбоніли типу М 2 (СО) 8 поводяться аналогічно типу М 2 (СО) 10. Немає високозаряджених біядерних карбонілатних аніонів та карбонільних катіонів.
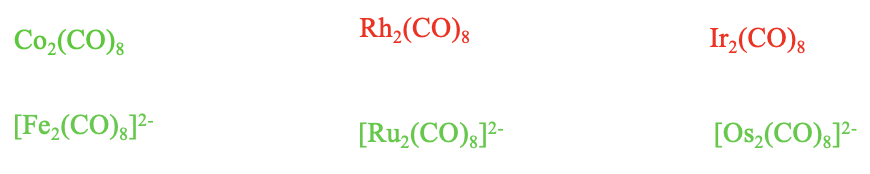
Існують лише слабо негативно заряджені [Fe 2 (CO) 8] 2-, [Ru 2 (CO) 8] 2-, і [Os 2 (СО) 8] 2-. Слабо негативний заряд стабілізує зв'язок метал-вуглецю, не надто дестабілізуючи зв'язок метал-метал. Ми можемо далі бачити з цього, що слабо негативний заряд кращий для стабільності виду, ніж взагалі відсутність заряду.
Гомолептичні карбоніли 11-ї групи (М = Cu, Ag, Au)
Метали групи 11 Cu, Ag і Au мають одинадцять валентних електронів.
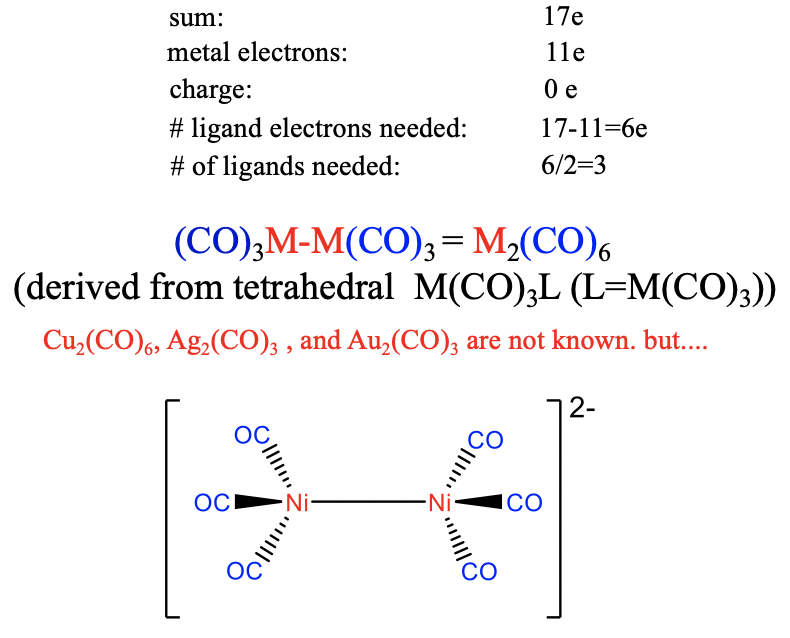
Тому для досягнення 17 електронів необхідно шість електронів лігандів (рис.\(\PageIndex{21}\)). Це означає, що 6/2 = 3 CO ліганди необхідні для отримання 17-валентного електронного фрагмента. Димер його має склад M 2 (СО) 6 і його структура може бути виведена з чотиригранної структури M (CO) 3 L, в якій L - другий фрагмент M (CO) 3. Ні Cu, ні Ag, ні карбоніл Au не відомі через слабке\(\pi\) перекриття в чотиригранній координації. Однак відомий слабо негативний [Ni 2 (CO) 6] 2- іон, що може пояснюватися стабілізуючим впливом одного негативного заряду на зв'язок М-С.
Загальні тенденції стабільності
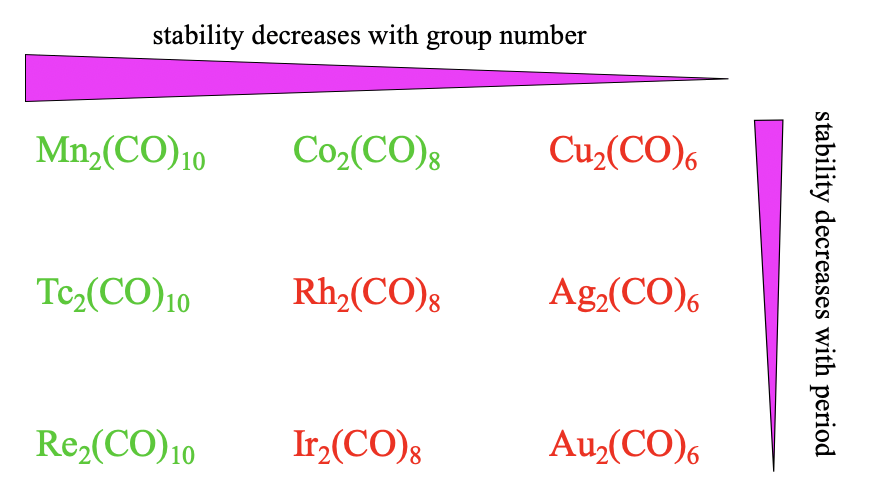
В цілому ми спостерігаємо ті ж тенденції стабільності для динуклеарних карбонілів порівняно з мононуклеарними. Стабільність зменшується з номером групи, тому що\(\pi\) -перекриття стає меншим з меншими координаційними числами. Також ми бачимо, що стабільність зменшується з періодом через зменшення відповідності орбітальних розмірів.
Гомолептичні карбоніли 5-ї групи (М = V, Nb, Ta)
17-валентний електронний фрагмент карбонілу ванадію має склад V (CO) 6. Він не димеризується, оскільки координаційне число 6 набагато сприятливіше в порівнянні з координаційним номером 7. V (СО) 6 - темно-фіолетовий радикал восьмигранної форми. Радикальний електрон стерично неактивний. V (CO) 6 може бути використаний як окислювач, оскільки він може бути легко відновлений до 18 валентних електронів виду V (CO) 6 -. Вищі гомологи Nb (CO) 6 і Ta (CO) 6 не відомі. Це може пояснюватися слабшим орбітальним перекриттям між відносно невеликими\(\pi\) *-орбіталями карбонільного ліганду і великими металевими d-орбіталями Nb і Ta.